垂盆草提取物對TGF-β 1誘導的腎小管上皮細胞-肌成纖維細胞轉分化和基質累積的影響
楊嫆嫆,陸紅,吳蓮鳳,王斯璐,林成成,梁勇,白永恒(溫州醫科大學附屬第一醫院,浙江 溫州 3505,.醫學檢驗中心;.外科實驗室)
·論 著·
垂盆草提取物對TGF-β 1誘導的腎小管上皮細胞-肌成纖維細胞轉分化和基質累積的影響
楊嫆嫆1,陸紅1,吳蓮鳳1,王斯璐2,林成成2,梁勇2,白永恒2
(溫州醫科大學附屬第一醫院,浙江 溫州 325015,1.醫學檢驗中心;2.外科實驗室)
目的:探討垂盆草提取物(SSBE)對轉化生長因子(TGF-β1)誘導的腎小管上皮細胞-肌成纖維細胞轉分化(EMT)和基質累積的影響。方法:將體外培養的大鼠腎小管上皮細胞系(NRK-52E)細胞分為只加入溶劑的對照組,只加入TGF-β1(濃度為5μg/L)的誘導組,以及加入SSBE(濃度為10和100 mg/L)和TGF-β1(濃度為5μg/L)的干預組。細胞形態變化采用倒置相差顯微鏡觀察;細胞免疫熒光染色檢測I I I型膠原、α-平滑肌肌動蛋白(α-SMA)和鈣黏蛋白(E-cadherin)的表達;反轉錄聚合酶鏈反應檢測α-SMA、骨形成蛋白-7(BMP-7)、緊密連接蛋白(Tjp1)、I型膠原(Col1a1)、I I I型膠原(Col3a1)、基質金屬蛋白酶-2 (MMP-2)和抑制因子-2(TIMP-2)mRNA的表達。結果:TGF-β1作用后,NRK-52E細胞形態發生變化,形成了長梭狀的肌成纖維細胞(MFs);其上皮標志物E-cadherin和Tjp1的表達水平顯著下降,而MFs標志物α-SMA表達顯著增加;基質成分Col1a1和Col3a1的表達也明顯增高。應用10和100 mg/L的SSBE干預后,抑制了TGF-β1誘導的細胞形態改變和α-SMA、Col1a1和Col3a1的高表達,并促進E-cadherin和Tjp1的表達。另外,SSBE也提高了BMP-7表達水平和MMP-2/TIMP-2比值。結論:SSBE可抑制TGF-β1誘導的腎小管上皮細胞纖維化樣改變,而這一作用與其能有效阻止EMT進程和基質累積有關。
垂盆草提取物;轉化生長因子-β1;上皮-間葉轉分化;基質累積
腎小管上皮細胞向肌成纖維細胞表型轉化(epithelial-mesenchymal transition,EMT)是腎間質纖維化發生發展的關鍵環節[1]。在EMT過程中,小管細胞喪失了上皮細胞的標志,如鈣黏蛋白(E-cadherin)等,形成了陽性表達α-平滑肌肌動蛋白α-SMA)的肌成纖維細胞(myofibroblasts,MFs)[2]。MFs是一種基質產生細胞,可分泌大量基質成分I型膠原(Col1a1)和I I I型膠原(Col3a1)在腎組織間隙累積從而導致纖維化的發生。抑制EMT進程,對防治腎間質纖維化具有十分重要的意義。垂盆草是一種景天科多年生草本植物,我們的前期研究顯示,其提取物(Sedum sarmentosum Bunge extract,SSBE)可拮抗馬兜鈴酸所致的腎小管上皮細胞纖維化樣改變[3]。這種抗纖維化作用,我們推測可能與SSBE抑制TGF-β 1的高表達密切相關。因此,本研究中我們擬采用TGF-β 1誘導腎小管上皮細胞(NRK-52E)出現EMT轉變,來探討SSBE對EMT和基質累積的影響。
1 材料和方法
1.1 材料 SSBE,安徽宣城百草植物工貿公司;DMEM細胞培養液,美國Hyclone公司;胎牛血清,杭州四季青生物公司;胰蛋白酶和TRIzol提取液,美國Gibco公司;人重組TGF-β 1蛋白,美國PeproTech公司;Col3a1一抗,北京Bioss公司;α-SMA一抗,美國Santa Cruz公司;E-cadherin一抗,美國Abcam公司;熒光素(FITC)標記山羊抗兔IgG,北京康位生物公司;RT-PCR試劑,美國Promega公司。MyCycler梯度PCR儀,美國Bio-Rod公司;7500定量PCR儀,美國Applied Biosystems公司;Varioskan Flash全波長多功能掃描儀,美國Thermo Scien-tific公司;DM4000 B LED熒光正置顯微鏡,德國Leica公司。
1.2 方法
1.2.1 細胞:大鼠腎小管上皮細胞株(NRK-52E)購于中科院上海生命科學研究院細胞資源中心。
1.2.2 實驗分組和細胞形態學觀察:細胞培養前,按適當濃度接種于六孔板中,待融合到70%~80%時,換成無血清DMEM培養液并開始正式實驗。①對照組:未加入SSBE或TGF-β 1;②誘導組:培養液中加入TGF-β 1(濃度為5μg/L);③治療組:培養液中同時加入SSBE和TGF-β 1(濃度為5μg/L),SSBE的濃度分別為10和100 mg/L。上述處理后的細胞置37 ℃和5% CO2的培養箱中培養,用倒置相差顯微鏡觀察細胞形態變化。
1.2.3 real-time RT-PCR檢測mRNA表達:采用Trizol試劑提取已處理細胞中的RNA,于260/280 nm測定吸光度值以確定樣本純度和濃度。根據試劑說明書將RNA反轉錄成cDNA。設計骨形成蛋白-7(BMP-7)、α-SMA、緊密連接蛋白(Tjp1)、基質金屬蛋白酶2 (MMP-2)、基質金屬蛋白酶組織抑制劑2(TIMP-2)、Col1a1和Col3a1 mRNA特異性引物,以β-actin作為內參對照(見表1),由上海捷瑞公司合成。取反轉錄產物1 μL進行PCR擴增,PCR擴增體系:5 μL 2×SYBR Green熒光定量試劑、2 μL引物(上、下游各1μL,終濃度200 nmol/L)、2μL反應緩沖液、1μL cDNA。擴增程序為:95 ℃ 5 min、95 ℃ 10 s、60 ℃ 35 s,40個循環。采用溶解曲線評價PCR結果可靠性,采用2-△△Ct計算相對mRNA表達量。△△Ct= [Ct目的基因(待測樣品)-Ct內參(待測樣品)]-[Ct目的基因(校正樣品)-Ct內參(校正樣品)]。

表1 擴增EMT和基質成分mRNA特異性引物
1.2.4 細胞免疫熒光染色檢測EMT和基質成分相關分子的表達:將細胞經胰酶消化收集后分別以1× 105個細胞接種于含載玻片的六孔板中,細胞培養至70%融合后,分別用TGF-β 1和TGF-β 1聯用SSBE進行處理24 h,用4%多聚甲醛固定30 min,0.3% Triton-X(1 mL/孔)破膜,室溫20 min。0.5%正常山羊血清封閉。在各細胞爬片上滴加E-cadherin、α-SMA和Col3a1一抗工作液,4 ℃孵育過夜。滴加Dylight488(綠色)或594(紅色)標記的二抗工作液,37 ℃孵育60 min。滴加DAPI于蓋玻片上,室溫染色5 min。細胞胞質綠色或紅色和胞核藍色為陽性著色。每組取3張片,每張片子取10個高倍視野,運用Image Pro Plus軟件分析平均光密度值。
1.3 統計學處理方法 采用SPSS15.0統計學軟件。計量數據以±s表示,兩組樣本比較采用t檢驗和精確概率法,多組間樣本比較采用方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 SSBE抑制TGF-β1誘導NRK-52E細胞的形態改變
相差顯微鏡下,對照組NRK-52E細胞培養24 h后呈現鋪路石狀,細胞結合緊密,細胞間隙不明顯(見圖1);5μg/L的TGF-β 1的誘導下,NRK-52E細胞呈梭形或不規則形狀,細胞間隙拉大;在TGF-β 1基礎上用10 mg/L的SSBE干預后,梭形細胞有所改善,細胞間隙縮小;當SSBE濃度增加到100 mg/L后,細胞形態恢復到鋪路石狀,細胞間隙減小,相互間結合緊密。這些結果提示SSBE抑制了TGF-β 1誘導的小管上皮細胞纖維樣改變,并呈現濃度依賴性。
2.2 SSBE抑制TGF-β1誘導的EMT和基質累積 免疫熒光染色結果顯示,5 μg/L TGF-β 1的作用下,NRK-52E細胞中上皮細胞標志物E-cadherin蛋白的表達水平明顯下調,而MFs標志物α-SMA的表達水平明顯升高,見圖2。此外,TGF-β 1也促進了基質成分Col3a1蛋白的表達。Real-time RT-PCR結果顯示,TGF-β 1抑制了緊密連接蛋白Tjp1 mRNA的表達,促進了α-SMA、Col1a1和Col3a1 mRNA的表達(見圖3)。應用10和100 mg/L SSBE干預后,TGF-β 1誘導的這些EMT改變以及基質累積均被抑制,并且其抑制作用呈現濃度相關性。
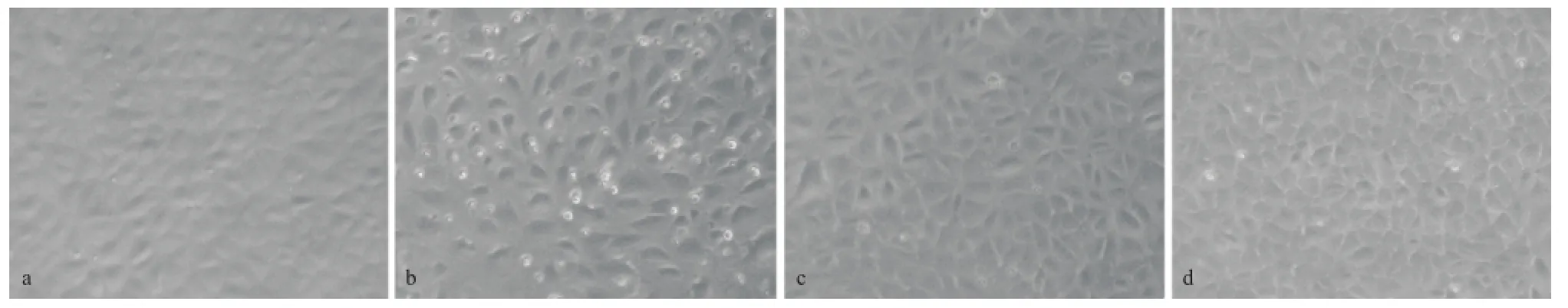
圖1 SSBE對TGF-β 1作用下NRK-52E細胞形態的影響(×200)
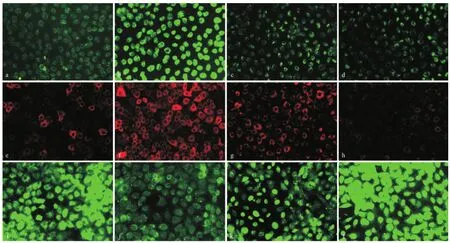
圖2 SSBE對TGF-β 1作用下NRK-52E細胞EMT和膠原累積的影響(×200)
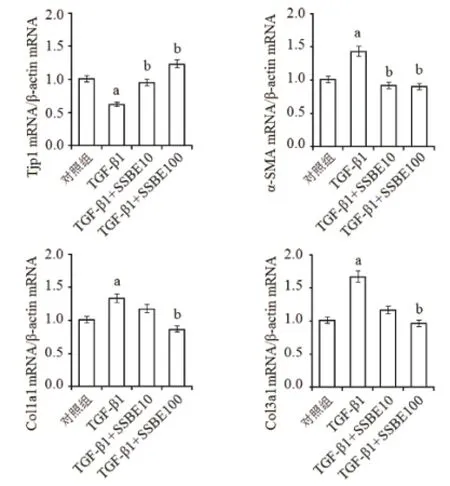
圖3 SSBE對TGF-β 1誘導的EMT和基質累積相關基因表達的影響
2.3 SSBE逆轉TGF-β1誘導的BMP-7高表達 以前研究顯示,TGF-β 1誘導的EMT反應可被BMP-7所逆轉,BMP-7表達下降可能是EMT形成重要的原因之一[4]。因此,我們評價了SSBE對BMP-7的影響。Real-time RT-PCR結果顯示,在TGF-β 1作用后,NRK-52E細胞中BMP-7 mRNA的表達水平顯著下調;而SSBE干預后,BMP-7 mRNA的表達水平恢復(見圖4A)。
2.4 SSBE恢復TGF-β1誘導的MMP-2/TIMP-2失衡
MMP-2及TIMP-2是體內基質成分合成和降解重要的調節因素[5]。MMP-2/TIMP-2比例一旦降低,說明基質合成速度超過降解速度,導致基質累積和纖維化。本研究中,TGF-β 1雖同時上調了MMP-2和TIMP-2 mRNA表達水平,但上調TIMP-2 mRNA的程度高于MMP-2,從而導致其比例降低(見圖4B-C)。而應用SSBE干預后,盡管MMP-2和TIMP-2 mRNA表達水平均下調,但TIMP-2 mRNA的表達水平下降更為嚴重。這些結果提示SSBE恢復了TGF-β 1誘導的MMP-2/TIMP-2失衡,從而改善基質成分累積程度。
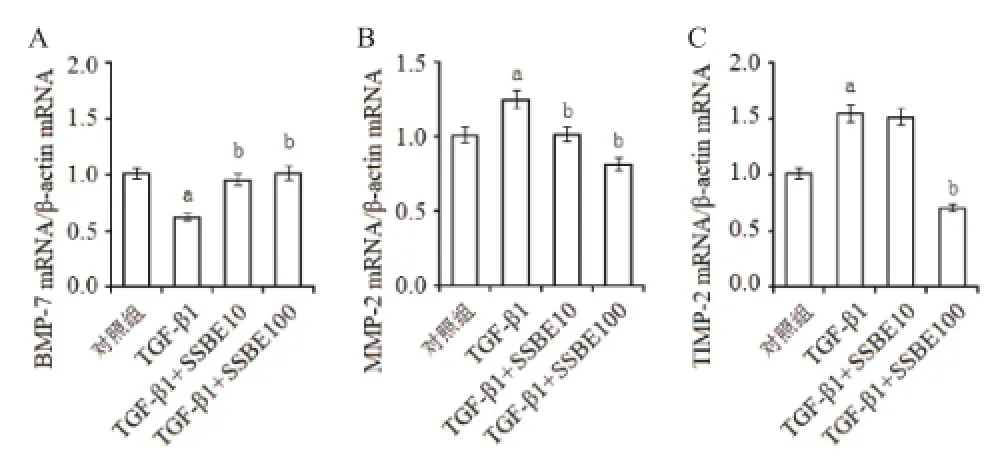
圖4 SSBE干預TGF-β1對BMP-7、MMP2和TIMP-2 mRNA表達的影響
3 討論
根據功能學和形態學分類,可將腎組織分為上皮和間葉兩種細胞類型,每一種都有其特有的功能。上皮細胞是多細胞結構,由緊密連接的細胞組成,并緊密黏附于基底膜表面。間葉細胞(主要為MFs)則為連接疏松的細胞,主要存在于細胞外基質,它們自己產生并有非常強的遷移能力。現今越來越多的證據證明上皮細胞能通過EMT改變其表型獲得MFs的特征,使其增加移動和合成基質成分,如Col1a1 和Col3a1等[2]。EMT通常見于胚胎生長期組織形態形成和腫瘤的生長過程。然而,在惡劣或損傷微環境中,上皮細胞可以通過EMT,使其獲得適應環境的表型,參與損傷后組織修復和纖維化[5]。在機體內,多種因素均可導致EMT的發生,如促纖維因子TGF-β 1表達的升高,BMP-7表達的下調等[6-7]。本實驗中,我們應用TGF-β 1作用腎小管上皮細胞后,小管上皮細胞出現纖維樣改變,NRK-52E細胞表達上皮細胞標志物E-cadherin和Tjp1減少,而表達MFs標志物α-SMA增多,基質成分Col1a1和Col3a1表達增加,這些結果提示TGF-β 1誘導了EMT的發生。應用SSBE干預后,小管上皮細胞EMT轉變得到緩解,并且拮抗EMT作用的BMP-7表達也隨之升高。因此,這些結果提示SSBE能拮抗TGF-β 1誘導的EMT和腎纖維化作用。
SSBE為垂盆草的回流提取物[8],而后者屬于景天科多年生草本植物,是中國藥典記載的常用中藥之一,具有清利濕熱、解毒功效。考慮到SSBE是一種多組分的混合物,是否是由于其內組分的作用而影響其效應呢?我們前期通過高效液相色譜法測定其成分,發現SSBE中含有槲皮素、山萘酚、異鼠李素、木犀草素和異甘草素等,其中槲皮素含量最高。槲皮素又名櫟精,具有降低血壓、增強毛細血管抵抗力、減少毛細血管脆性、降血脂等作用。此外,槲皮素也具有抗腫瘤和抗纖維化的作用,并且這種抗纖維化作用主要是通過調控MMP-2的表達來實現[9]。本研究中,我們也分析了SSBE對MMP-2及其抑制因子TIMP-2表達的影響。結果發現SSBE恢復了由于TGF-β 1所致的MMP-2/TIMP-2比值下調,說明SSBE抑制了MFs合成基質,促進其降解。基于上述證據,推測SSBE的抗纖維化作用可能與其主要組分槲皮素存在一定的相關性。
綜上所述,我們從體外實驗角度證實了SSBE能拮抗TGF-β 1誘導的EMT效應,抑制基質合成,促進降解,進而發揮抗腎纖維化作用。在未來的工作,我們將評價SSBE各組分對于小管上皮細胞EMT以及腎纖維化的作用,并且深入探索其可能的分子機制,為今后纖維化類疾病的中草藥治療提供理論依據。
[1] Liu Y.Cellular and molecular mechanisms of renal fibrosis [J].Nat Rev Nephrol,2011,7(12):684-696.
[2] Liu Y.New insights into epithelial-mesenchymal transition in kidney fibrosis[J].J Am Soc Nephrol,2010,21(2):212-222.
[3] Bai Y,Lu H,Hu L,et al.Effect of Sedum sarmentosum BUNGE extract on aristolochic acid-induced renal tubular epithelial cell injury[J].J Pharmacol Sci,2014,124(4):445-456.
[4] Xu Y,Wan J,Jiang D,et al.BMP-7 counteracts TGF-beta1-induced epithelial-to-mesenchymal transition in human renal proximal tubular epithelial cells[J].J Nephrol,2009,22(3):403-410.
[5] Anglani F,Ceol M,Mezzabotta F,et al.The renal stem cell system in kidney repair and regeneration[J].Front Biosci,2008,13:6395-6405.
[6] 胡麗萍,陸紅,白永恒,等.小G蛋白Rac1在馬兜鈴酸誘導腎小管上皮細胞損傷中的作用及意義[J].溫州醫學院學報,2013,43(12):775-778.
[7] Lian YG,Zhou QG,Zhang YJ,et al.VEGF ameliorates tubulointerstitial fibrosis in unilateral ureteral obstruction mice via inhibition of epithelial-mesenchymal transition[J].Acta Pharmacol Sin,2011,32(12):1513-1521.
[8] Bai Y,Lu H,Zhang G,et al.Sedum sarmentosum Bunge extract exerts renal anti-fibrotic effects in vivo and in vitro[J].Life Sci,2014,105(1-2):22-30.
[9] Yoon JS,Chae MK,Jang SY,et al.Antifibrotic effects of quercetin in primary orbital fibroblasts and orbital fat tissue cultures of Graves’ orbitopathy[J].Invest Ophthalmol Vis Sci,2012,53(9):5921-5929.
(本文編輯:吳健敏)
Effect of Sedum sarmentosum Bunge Extract on TGF-β1-induced renal epithelial-to-mesenchymal transi- tion and matrix accumulation
YANG Rongrong1,LU Hong1,WU Lianfeng1,WANG Silu2,LIN Chengcheng2,LIANG Yong2,BAI Yongheng2.
1.Department of Laboratory Medicine,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015; 2.Wenzhou Key Laboratory of Surgery,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015
Objective:To investigate the protective effects of Sedum sarmentosum Bunge Extract (SSBE) on TGF-β1-induced epithelial-to-mesenchymal transition (EMT) and matrix accumulation in renal tubular epithelial cells (NRK-52E).Methods:NRK-52E cells were divided randomly into:control group treated with only solvent,TGF-β1 group treated with TGF-β1 at the concentrations with 5 μg/L and SSBE group treated with TGF-β1 plus SSBE at the concentrations with 10 and 100 mg/L.The morphology of the NRK-52E cells was observed under inverted/phase contrast microscope.Immunofluorescent analysis was performed to detect the expression of epithelial marker α-smooth muscle actin (α-SMA),mesenchymal marker E-cadherin,and matrix component type III collagen.Gene expression of α-SMA,bone morphogenic protein-7 (BMP-7),tight junction protein-1 (Tjp1),Col1a1,Col3a1,MMP-2,and TIMP-2 were also quantified by real-time RT-PCR.Results:In TGF-β-treated NRK-52E cells,fibrosis-like phonotype was obviously increased.TGF-β1 increased the expression of α-SMA,and decreased the expression of E-cadherin and Tjp1.Also,TGF-β1 enhanced the expression of type I and III collagens.Treatment with SSBE at the concentrations with 10 and 100 mg/L inhibited TGF-β1-induced fibrosislike phenotype of NRK-52E cells,accompanied with down-regulated expression of α-SMA,Col1a1 and Col1a1 and up-regulated expression of E-cadherin and Tip1.In addition,SSBE increased the expression of BMP-7 and the ratio between MMP-2 and TIMP-2.Conclusion:SSBE treatment reduce TGF-β1-induced fibrosis-like reaction in renal tubular epithelial cells through inhibiting EMT and matrix accumulation.
Sedum sarmentosum Bunge Extract; TGF-β1; epithelial-to-mesenchymal transition; matrix accumulation
R730.52
A
10.3969/j.issn.2095-9400.2015.04.003
2014-09-11
浙江省自然科學基金資助項目(LQ12H05001);溫州市科技計劃項目(Y20110028,Y20140023)。
楊嫆嫆(1961-),女,浙江樂清人,主管技師。
白永恒,主管技師,Email:greatsailor@163.com。

