開菲爾粒增殖條件的優化研究
劉克營,鐘浩,郭愛珍,劉朋龍,王亮
(1.江蘇大學食品與生物工程學院,江蘇鎮江212013;2.天潤乳業股份有限公司,烏魯木齊830000)
0 引言
開菲爾粒是一種天然的發酵劑,其中乳酸菌最多,其次是酵母菌和醋酸菌[1]。開菲爾粒在發酵過程中容易造成發酵不均勻等問題,嚴重影響了開菲爾的風味和質構[2-3]。而純培養發酵劑不僅連續傳代活力不穩定,而且易發生雜菌污染或共生菌群失衡,產品的質量不穩定,從而使傳統開菲爾飲品難以實現工業化生產[4]。而開菲爾粒凍干粉的使用可以有效解決以上難題,因此,開菲爾粒的生產至關重要。
目前,許多研究從不同的角度分析了不同的因素對開菲爾粒增殖的影響[5-11],但仍需要不斷的探索和研究。本研究對開菲爾粒發酵過程中的物理因素、pH值、營養條件進行研究,從而找出最佳的開菲爾粒增值條件,擴大開菲爾粒凍干粉的生產,促進開菲爾產業的發展。
1 實驗
1.1 材料
純牛奶(市售),低脂牛奶(市售),脫脂牛奶(市售),開菲爾粒,胰蛋白胨LP0037,酵母提取物LP0021,蔗糖,乳糖,葡萄糖,氯化鈉。
1.2 培養基
MRS培養基:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,KH2PO4為2 g,檸檬二銨2 g,乙酸鈉5 g,葡萄糖20 g,吐溫80為1mL,MgSO4·7H2O為0.58 g,Mn-SO4·4H2O 為 0.25 g,蒸餾水1000 mL,pH值為6.2~6.4。
LB培養基:胰蛋白胨10 g,酵母提取物5 g,氯化鈉10 g,蒸餾水1 000 mL,pH值為7.4。
1.3 儀器
SW-CJ系列潔凈工作臺(蘇州安泰空氣技術有限公司),QYC 200全溫空氣搖床,pH計,BPMJ-250F型霉菌培養箱,手提式不銹鋼壓力蒸汽滅菌器,BSA124S-CW電子天平,LSHZ-300型低溫水浴培養箱。
1.4 方法
1.4.1 開菲爾粒的活化
將凍存的開菲爾粒取出,按2%的比例接種到滅菌乳中,在28℃,100 r/min條件下培養,每24 h,測發酵液的pH值,并將開菲爾粒重新接種到新鮮滅菌乳中。重復6 d。
1.4.2 開菲爾粒的增殖
1.4.2.1 物理因素對開菲爾粒增值的影響。
(1)清洗攪拌對開菲爾粒增值的影響。將4份滅菌乳放入三角瓶中,然后將開菲爾粒按2%的比例接種到滅菌乳中。①攪拌,100 r/min,28℃條件下,每24 h過濾出開菲爾粒,無菌水沖洗,用無菌濾紙吸干開菲爾粒表面水分稱重。②攪拌,100 r/min,28℃條件下,每24 h過濾出開菲爾粒,用無菌濾紙吸干開菲爾粒表面水分稱重。③不攪拌,28℃條件下,每24 h過濾出開菲爾粒,無菌水沖洗,用無菌濾紙吸干開菲爾粒表面水分稱重。④不攪拌,28℃條件下,每24 h過濾出開菲爾粒,用無菌濾紙吸干開菲爾粒表面水分稱重,最后再次接種到新鮮的滅菌乳中。如此重復6 d。
(2)開菲爾粒的大小對開菲爾粒增殖的影響。將直徑為大于1 cm、0.5~1 cm和小于0.5 cm的開菲爾粒按2%的比例分別接種到滅菌乳中,100 r/min,28℃條件下培養,每24小時過濾出開菲爾粒,用無菌濾紙吸干開菲爾粒表面水分稱重。如此重復6 d。
(3)不同的發酵條件對開菲爾粒增殖的影響。以發酵溫度、接種量、攪拌速度、發酵時間為因素設計正交實驗(表1),到時間后,用無菌濾紙吸干開菲爾粒表面水分后稱重,然后再次接種到新鮮的滅菌乳中。如此重復6 d。
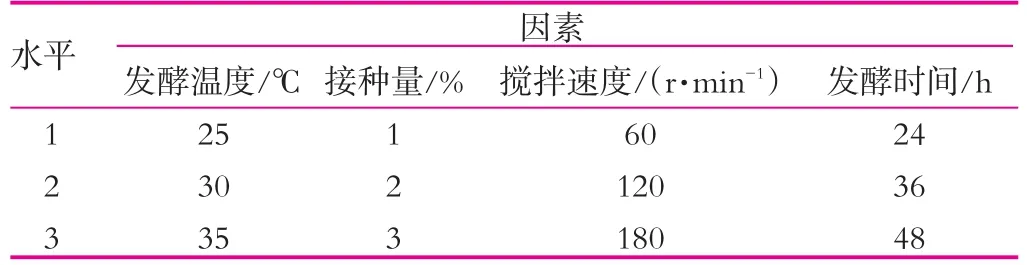
表1 正交實驗(I)
1.4.2.2 pH值對開菲爾粒增殖的影響。
準備3份活化的開菲爾粒,分別做以下處理:①取一份接種到滅菌乳中,連續培養3 d不作處理,3 d后取出測定開菲爾粒的質量。②取一份接種到滅菌乳中,每天用濃度為0.1 mol/L氫氧化鈉溶液調節發酵液的pH值至6.45,連續培養3 d,3 d后取出測定開菲爾粒的質量。③取一份接種到滅菌乳中,每天更換培養基,測定開菲爾粒的質量,其中培養條件均為30℃,120 r/min。
1.4.2.3 營養成分對開菲爾粒增殖的影響。
(1)不同的培養基質對開菲爾粒增殖的影響。將開菲爾粒按2%的比例接種到相同體積的滅菌乳,MRS培養液,LB培養液中攪拌培養,30℃(120 r/min)條件下培養,每24 h過濾出開菲爾粒,用無菌濾紙吸干開菲爾粒表面水分稱重,如此重復6 d。
(2)不同碳源對開菲爾粒增值的影響。在滅菌乳中分別加入質量分數為1%的乳糖、葡萄糖、蔗糖,然后接種開菲爾粒,在最佳的條件下培養,30℃(120 r/min)條件下培養,每24 h過濾出開菲爾粒,無菌濾紙吸干開菲爾粒表面水分后稱重,然后再次接種到新鮮的滅菌乳中,如此重復6 d。
(3)不同氮源對開菲爾粒增殖的影響。在滅菌乳中分別加入質量分數為1%的胰蛋白胨、酵母粉,然后接種開菲爾粒,在最佳的條件下培養,30℃(120 r/min)條件下培養,每24 h過濾出開菲爾粒,無菌濾紙吸干開菲爾粒表面水分后稱重,然后再次接種到新鮮的滅菌乳中,如此重復6 d。
(4)正交實驗。在上述實驗得到的最佳的條件基礎上,然后以碳源、氮源、脂肪和氯化鈉為因素設計正交實驗(表2),30℃(120 r/min)條件下培養,每24h過濾出開菲爾粒,無菌濾紙吸干開菲爾粒表面水分后稱重,然后再次接種到相應的新鮮的滅菌乳中,如此重復6 d。
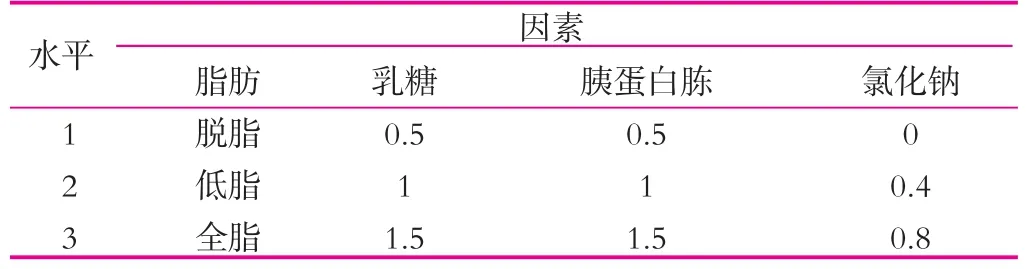
表2 正交實驗(II) %
2 結果與分析
2.1 開菲爾粒的活化
開菲爾粒低溫保存時,開菲爾粒中菌種活性保持很低的水平,在活化的過程中,菌種的活性逐漸達到最佳狀態。由圖1可以看出,隨著活化的進行,發酵液的pH值逐漸降低,當開菲爾粒活化4次后,發酵液pH值在3.9左右波動,這說明開菲爾粒的活化狀態已達到最佳狀態。
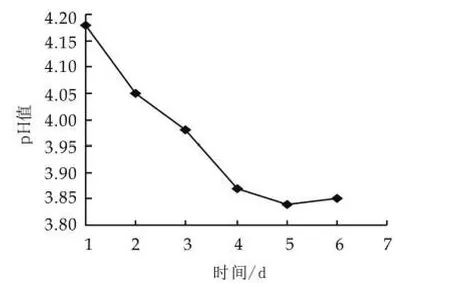
圖1 開菲爾粒的活化
2.2 開菲爾粒的增殖
2.2.1 物理因素對開菲爾粒增殖的影響
(1)清洗攪拌對開菲爾粒增值的影響。開菲爾粒表面的清洗可以有效地避免開菲爾粒表面雜菌的污染,而攪拌也可以防止霉菌在開菲爾的表面生長[5]。雖然清洗和攪拌在防止污染方面起到一定的作用,但阻礙了開菲爾粒的增殖。由圖2可以看出,攪拌有利于開菲爾粒的增殖,而清洗不利于開菲爾粒的增殖。
這是由于在攪拌的過程中,加大了發酵液中的氧氣質量分數以及有利于營養成分分布均勻,從而加快了開菲爾粒中的酵母菌、乳酸菌和醋酸菌的生長,因此攪拌有利于開菲爾粒的增殖[12]。另外,開菲爾粒在增殖的過程中會在開菲爾粒的表面形成一層多糖物質,即為開菲爾粒的組成成分,而在清洗的過程中,這種多糖物質會被破壞,從而影響開菲爾粒的增殖。所以攪拌不清洗的效果是最好的,七天的培養使開菲爾粒的增殖率達到106%,增加了一倍。
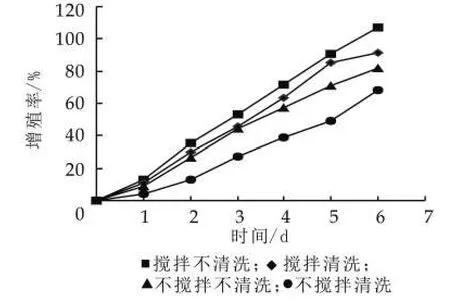
圖2 攪拌清洗對開菲爾粒增殖的影響
(2)開菲爾粒的大小對開菲爾粒增殖的影響。開菲爾粒是由多糖物質、蛋白質和各種菌種組成的粒狀發酵劑,而菌種在開菲爾粒的表面和內部都有分布[12-15]。開菲爾粒的增殖過程其實就是一個菌種的增殖和多糖物質的合成過程,而這個過程需要開菲爾粒內外菌種的共同作用來完成。開菲爾粒的表面積越大,越有利于開菲爾粒內部與外部營養物質的交流和產物的合成。從而加速菌種的繁殖和多糖物質的合成。另外,相同質量的開菲爾粒粒徑越小,開菲爾粒的表面積就越大,相反開菲爾粒的表面積就越小。
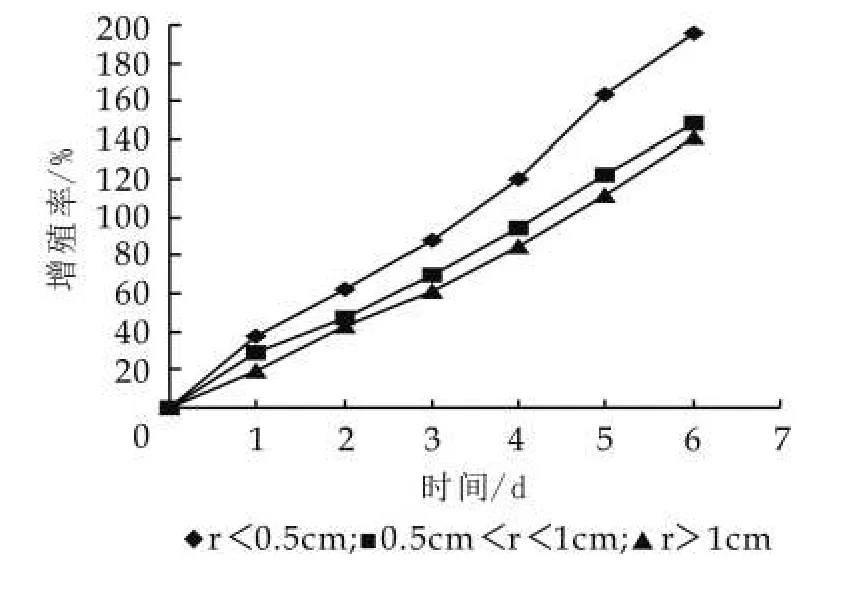
圖3 粒徑大小對其增殖的影響
由圖3可以看出,開菲爾粒越小開菲爾粒的生長速度越快。當開菲爾粒的粒徑小于0.5 cm時,連續培養7 d開菲爾粒增長率達到195.3%,而粒徑超過1 cm的開菲爾粒的增長率只是141.4%。因此,開菲爾粒的大小對開菲爾粒增殖是有影響的,開菲爾粒越小越有利于開菲爾粒的增殖,越大越不利于開菲爾粒的增殖。當然也不是越小越好,要符合現實情況。
(3)不同發酵條件對開菲爾粒增殖的影響。在已得最佳條件下,進行發酵溫度、發酵時間、攪拌速度和接種量正交實驗,結果如表3所示。
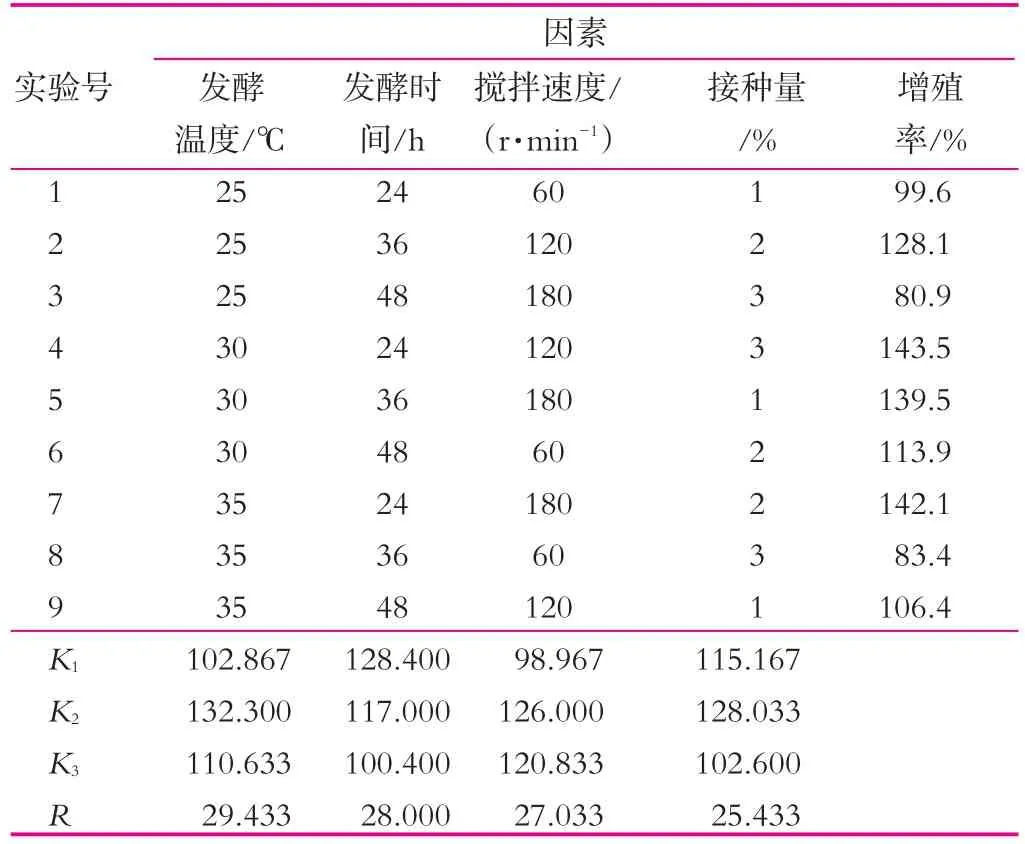
表3 各因素和接種量正交實驗結果
由表3可以看出,4種不同的因素對開菲爾粒增殖的影響大小不同,其影響主次順序是發酵溫度>發酵時間>攪拌速度>接種量。通過表3中的極差分析可得出,開菲爾粒的最佳的增殖條件是發酵溫度30℃,發酵時間24 h,攪拌速度為120 r/min,接種量2%。
2.2.2 pH值對開菲爾粒增殖的影響
開菲爾粒發酵前期,發酵液中營養成分充足,生長環境適宜,開菲爾粒中的菌種代謝旺盛,而隨著發酵的進行,生長環境逐漸變的惡劣,減緩了菌種的增殖,同時因為酸性的增強,抑制了產粘細菌代謝產生粘性多糖,從而阻礙了開菲爾粒的增殖。由表4可以看出,相同條件下,3處理比1處理的增長率高30.3%,而2和3增長率相差僅6.5%。所以,pH值的變化也是影響開菲爾粒增殖的一個重要因素。
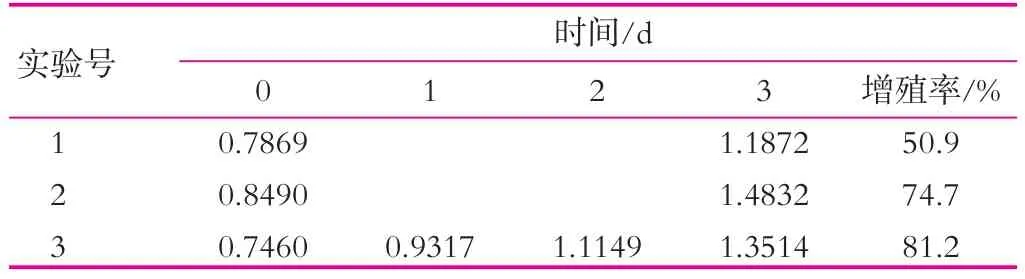
表4 pH值對開菲爾粒增殖的
2.2.3 營養成分對開菲爾粒增殖的影響
(1)不同培養基質對開菲爾粒增殖的影響。由圖4可以看出,不同培養基影響開菲爾粒的增殖。其中滅菌乳是開菲爾粒增殖的最佳培養基,相同培養條件下,在滅菌乳中開菲爾粒的增殖率達到85%,MRS次之,LB培養基最差。這是由于開菲爾粒中主要包括乳酸菌和酵母菌,LB培養基雖然是基本培養基,但它不是最佳培養基,它只是為微生物提供基本的生存保證,在里面微生物得不到快速繁殖,而MRS培養基是乳酸菌培養基,它有利于乳酸菌的快速增殖,但是它不利于開菲爾粒中酵母菌的增殖,所以開菲爾粒的增殖速度雖然比在LB培養基中高,但還是不能滿足要求。滅菌乳中各種營養成分充足,而且并不對某種菌進行選擇性抑制,這使得乳酸菌和酵母菌都能在滅菌乳中進行快速繁殖,從而加速開菲爾粒的增殖。因此,在滅菌乳中,開菲爾粒的增殖率最高。
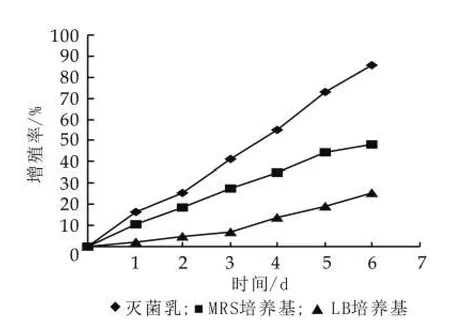
圖4 培養基質對開菲爾粒增殖的影響
(2)不同碳源對開菲爾粒增殖的影響。開菲爾粒中菌種的組成是多樣的,而不同的菌種對碳源需求是不同的,本試驗取了三種基本的糖(乳糖、葡萄糖、蔗糖),研究不同的糖對開菲爾粒增殖的影響。由圖5可以看出,不是所有的糖對開菲爾粒的增殖有促進作用,相同條件培養,乳糖對開菲爾粒增殖有明顯的促進作用,葡萄糖對開菲爾粒的增殖的也有促進作用,但效果不如乳糖,而蔗糖對開菲爾粒增殖的作用最小,在一定程度上會抑制開菲爾粒的增殖。
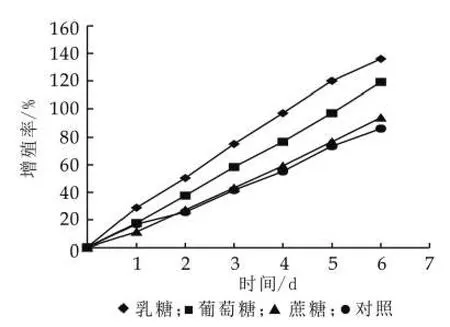
圖5 不同碳源對開菲爾粒增殖的影響

圖6 不同碳源對開菲爾粒增殖的影響
(3)不同氮源對開菲爾粒增殖的影響。在培養初期,開菲爾粒中的乳酸菌利用乳中氨基酸和蛋白質,快速反應,產生大量的酸,從而導致了發酵液中氨基酸和蛋白質的不足,抑制了產粘菌種的繁殖和代謝,進而影響了開菲爾粒的增殖[5]。本文以胰蛋白胨和酵母提取物為兩種氮源物質,以期選出一種對開菲爾粒增殖最佳的氮源。由圖6可以看出,酵母提取物和胰蛋白胨對開菲爾粒都有促進作用,而添加胰蛋白胨的效果比添加酵母提取物的效果要好。這符合Anine Schoevers等的研究成果,他們發現在促進開菲爾粒增殖方面,胰蛋白胨的效果優于酵母提取物[6]。
(4)正交實驗。在已得最佳條件下,進行脂肪質量分數、乳糖質量分數、胰蛋白胨質量分數和氯化鈉質量分數的正交實驗,結果如表5所示。
由表5可以看出,4種不同的因素對開菲爾粒增殖的影響大小不同,其影響主次順序是脂肪質量分數>氯化鈉質量分數>胰蛋白胨質量分數>乳糖質量分數。通過表5中的極差分析可得出,開菲爾粒的最佳的增殖條件是脫脂牛奶、乳糖0.5%,胰蛋白胨0.5%和氯化鈉0.8%(均為質量分數)。由此可知,乳糖和胰蛋白胨的添加量并不是越多越好。按正交實驗的最優水平進行實驗,結果如圖7所示。由圖7可以看出,開菲爾粒的增殖率最低增加了31.08%,因此可知,正交實驗結果準確。
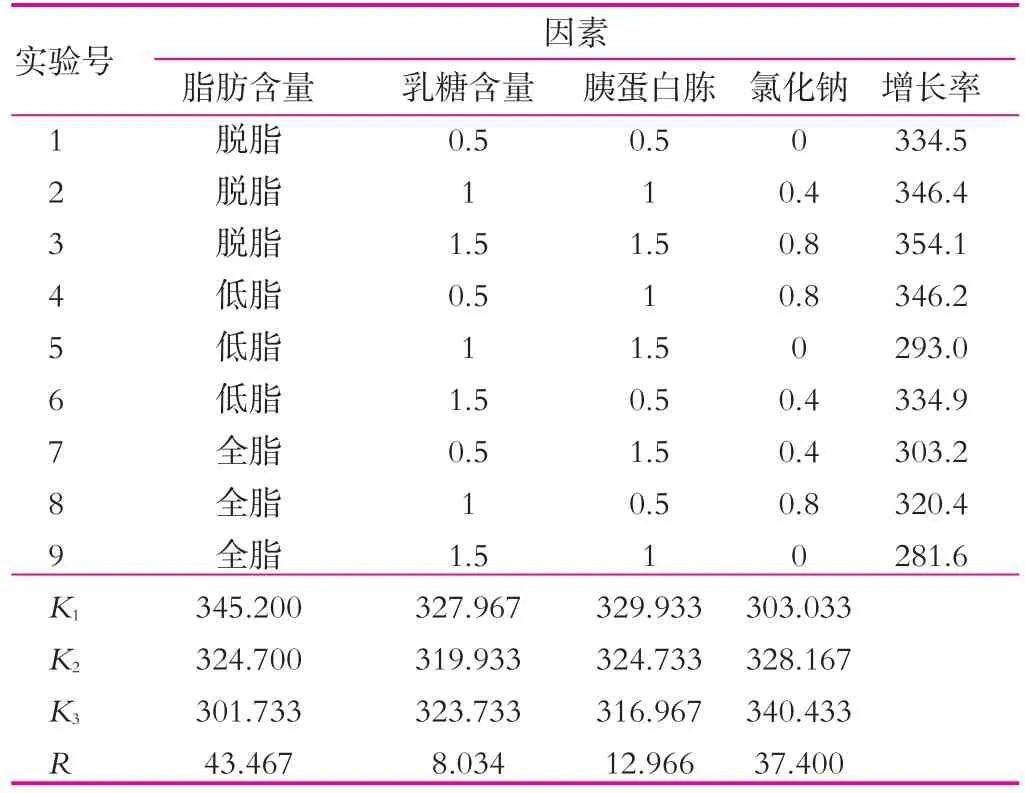
表5 脂肪、乳糖、胰蛋白胨和氯化鈉正交實驗結果 %
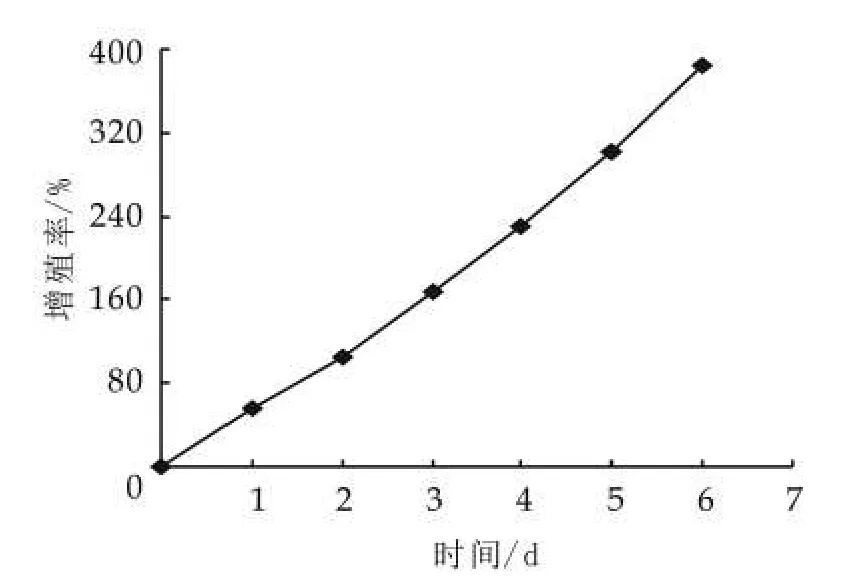
圖7 最佳條件下開菲爾粒的增長
3 結論
本研究發現,開菲爾粒在連續接種培養3天時達到最高的活性狀態,發酵液的pH值穩定在3.9左右。另外,通過對增殖工藝(清洗攪拌,粒徑大小)和增殖條件(培養溫度、培養時間、接種量、攪拌速度)進行單因素和正交試驗得出,清洗減緩了開菲爾粒的增殖速度,攪拌有利于開菲爾粒的增殖;當粒徑小于0.5 cm時開菲爾粒的增殖速度最快;而且還得出當發酵溫度為30℃,發酵時間是24 h,攪拌速度為120 r/min和接種量為2%時,開菲爾粒的增殖速度最大。
另外,研究發現,相同條件下培養,調節發酵液pH值的變化可使開菲爾粒的增長率比不做處理的開菲爾粒的增長率高出23.8%,而這比更換培養基的對照組僅僅低了6.5%。由此可得出,連續3 d發酵的過程中,營養成分的變化并不是主要的因素,pH值的變化才是影響開菲爾粒增殖的主要因素。
關于營養成分對開菲爾粒增殖的影響。通過單因素試驗得出,牛奶是開菲爾粒增殖的最佳營養基質;胰蛋白胨的效果比酵母粉的效果好;乳糖對促進開菲爾粒增殖的效果最好,葡萄糖次之,而添加葡糖糖的效果不明顯,甚至在一定程度上削弱了開菲爾粒的增殖速度。另外,通過正交試驗得出,當使用脫脂牛奶,胰蛋白胨添加量為0.5%,乳糖添加量為0.5%以及氯化鈉添加量為0.8%時,開菲爾粒的增殖率最高,接近普通牛奶發酵增殖率的2倍。
最后,利用所得最佳條件進行開菲爾粒的增殖實驗,結果顯示,開菲爾粒的增殖率比實驗過程中的最佳水平高出31個百分點,增殖效果明顯。
[1]WITTHUHN R C,SCHOEMAN T,BRITZ T J.Characterisation of the microbial population at different stages of Kefir production and Kefir grain mass cultivation[J].International Dairy Journal,2005,15(4):383-389.
[2]金世琳.古老而新型的酒精性發酵乳飲料[J].飲料工業,1999,2(1):16-21.
[3]張列兵,劉鵬,周偉明,等.開菲爾粒基質和產生開菲爾基質的微生物[J].中國乳品工業,1996,24(6):42-44.
[4]張列兵,劉鵬,程濤,等.酸牛奶酒(Kefir)工藝學研究進展評論[J].中國乳品工業,1996,24(2):20-22.
[5]任雅麗,李博,籍保平,等.培養條件及營養元素對開菲爾粒增殖的影響[J].食品科學,2007,27(12):512-517.
[6]SCHOEVERS A,BRITZ T J.Influence of different culturing conditions on kefir grain increase[J].International journal of dairy technology,2003,56(3):183-187.
[7]GORSEK A,TRAMSEK M.Kefir grains production—An approach for volume optimization of two-stage bioreactor system[J].Biochemical Engineering Journal,2008,42(2):153-158.
[8]王蕊,高翔,孔令偉.影響開菲爾粒(Kefir grains)增殖因素的研究[J].食品科技,2009(6):12-16.
[9]HABIBI N,SOLEIMANIAN-ZAD S,ZEINODDIN M S.Optimization of kefir grains production by using taguchi technique and mini-fermentation[J].World Applied Sciences Journal,2011,12(5):613-618.
[10]GHASEMLOU M,KHODAIYAN F,GHARIBZAHEDI S M T.Enhanced production of Iranian kefir grain biomass by optimization and empirical modeling of fermentation conditions using response surface methodology[J].Food and Bioprocess Technology,2012,5(8):3230-3235.
[11]GAO J,GU F,RUAN H,et al.Culture Conditions Optimization of Tibetan Kefir Grains by Response Surface Methodology[J].Procedia Engineering,2012,37:132-136.
[12]高莉莉,葛春美,韓俊華,等.Kefir奶的制作工藝及標準[J].中國乳品工業,2003,31(3):22-25.
[13]趙琦,陸蘇丹.波蘭的Kefir生產[J].上海奶牛,1992(2):34-35.
[14]GARROTE G L,ABRAHAM A G,DE ANTONI G L.Chemical and microbiological characterisation of kefir grains[J].Journal of Dairy Research,2001,68(04):639-652.
[15]張列兵,苑伍申.開菲爾粒表面超微結構及微生物在開菲爾粒表面分布的研究[J].中國乳品工業,1998,26(1):14-15.

