術中高場強磁共振聯合錐體束導航在丘腦膠質瘤切除手術中的應用
吳東東,陳曉雷,耿杰峰,張 猛,白少聰,王 群,馬曉東,許百男
解放軍總醫院 神經外科,北京 100853
術中高場強磁共振聯合錐體束導航在丘腦膠質瘤切除手術中的應用
吳東東,陳曉雷,耿杰峰,張 猛,白少聰,王 群,馬曉東,許百男
解放軍總醫院 神經外科,北京 100853
目的 探討術中高場強磁共振聯合錐體束導航在丘腦膠質瘤切除手術中的應用價值。方法 回顧性研究2009年3月- 2014年4月本院神經外科收治的28例接受1.5 T高場強術中磁共振聯合錐體束導航輔助顯微切除手術的丘腦膠質瘤患者臨床資料,分析評估了所有患者的腫瘤切除程度、術前術后行為狀態評分(Karnofsky performance scale,KPS)和肌力。結果 28例患者中有22例術中掃描后發現腫瘤殘留,其中15例患者的殘留腫瘤得以進一步切除,提高了腫瘤切除程度。術后3周,22例神經功能改善或同術前,6例神經功能下降,但是功能下降者KPS均> 60,即生活均可自理。結論 術中高場強磁共振聯合錐體束導航有助于提高丘腦膠質瘤切除程度,減少術后運動功能障礙的發生率。
術中磁共振;錐體束導航;丘腦膠質瘤
網絡出版時間:2015-04-14 10:36 網絡出版地址:http://www.cnki.net/kcms/detail/11.3275.R.20150414.1036.005.html
丘腦膠質瘤占顱內腫瘤的1% ~ 5%,而目前外科手術切除是膠質瘤治療的核心環節之一,膠質瘤的切除程度是決定患者生存期及預后的主要因素[1-4]。然而丘腦膠質瘤位于大腦深部,毗鄰內囊、下丘腦、第三腦室等重要結構,手術難度大,手術致死率及致殘率高,其治療一直是神經外科的難題之一[5]。神經功能導航在原來解剖導航的基礎上融入重要的功能皮質、功能傳導束和血管結構,進而盡量避免損傷這些重要的功能結構,但是單純的神經功能導航存在腦漂移等問題。而術中磁共振能夠在術中發現殘余腫瘤,實時反饋腫瘤切除程度,同時糾正術中腦漂移,提高導航的準確率[6-8]。我中心自2009年2月應用1.5 T高場強術中磁共振系統以來,借助該系統聯合神經導航手術切除28例丘腦膠質瘤,取得了相對滿意的療效。
資料和方法
1 資料 2009年3月- 2014年4月,本院神經外科應用術中高場強磁共振聯合錐體束導航進行了28例丘腦膠質瘤患者的顯微切除手術,所有患者均入選本研究,其中男性16例,女性12例,年齡11~73歲,平均年齡39.8歲,患者的基本情況見表1。
2 術前磁共振影像數據的獲取 所有患者均于術前1~3 d于術中磁共振單元的診斷室接受1.5 T高場強磁體(Siemens Espree,Erlangen,Germany)掃描。掃描序列包括平掃的T1加權像、T2加權像、T2水抑制像、彌散張量成像和增強的T1加權像。掃描序列說明:1)平掃和增強的T1加權像均采用相同參數的三維磁化強度預備梯度回波序列(掃描參數:TE 3.02 ms,TR 1 650 ms,矩陣大小256×256,FOV 250 mm×250 mm,體素1 mm×1 mm×1 mm,層厚1 mm,層數179),在本研究中兩者均可用作導航計劃時其他序列融合的基本解剖序列,對于高級別膠質瘤常用增強的T1加權像進行腫瘤描繪;2)T2加權像和T2水抑制像在本研究中主要用于低級別膠質瘤的腫瘤描繪;3)彌散張量成像(diffusion tensor imaging,DTI)采用單次投射彌散加權自旋回波序列(掃描參數:TE 147 ms,TR 9 400 ms,矩陣大小128×128,FOV 251 mm×251 mm,體素1.9 mm×1.9 mm×3 mm,層厚3 mm,層數40,帶寬1 502 Hz/px,彌散權重高b值1 000 s/mm2,彌散方向12個,低b值0 s/mm2,重復掃描5次以提高信噪比,總掃描時間7 min 49 s),在本研究中主要用于錐體束的重建。
3 導航計劃制訂 將術前掃描獲得的影像數據通過局域網傳輸到導航計劃工作站iPlan 2.6(Brainlab,Feldirchen,Germany),首先應用“Image fusion”模塊將各掃描序列以平掃和增強的T1加權像為基本序列進行圖像融合,然后應用“Object creation”模塊描繪腫瘤范圍,最后應用“Fiber tracking”模塊進行錐體束的重建,具體方法參考Nimsky等[9]的研究。為盡量不損傷或不加重患者的運動功能損傷,本研究選取的FA閾值為0.1[10],同時在錐體束外加一層厚度為5 mm的“保護殼”,用于在術中提示錐體束的邊界。
4 術前準備 術前1 d,術者根據腫瘤的影像學特點、個人經驗及導航計劃,在制訂包括手術入路在內的手術方案時,不僅需考慮避開錐體束,還需考慮避開視覺傳導束以及語言皮質及傳導束等重要結構。手術當天,將制訂好的導航計劃導入術中導航系統(Vector Vision Sky,BrainLab,Feldkirchen,Germany),對于仰臥位或側臥位的病人根據面部特征采用激光采樣表面輪廓注冊技術進行導航注冊,對于俯臥位的病人采用人工標記點注冊法進行導航注冊。上述注冊成功后,再將導航系統與手術顯微鏡(OPMI Pentero,Carl Zeiss,Germany)連接,進行顯微鏡注冊以實現鏡下導航,可使導航計劃中描繪的腫瘤范圍和錐體束等內容實時投射到顯微鏡下視野內,指導術者進行手術切口的設計和術中腫瘤的切除。
5 手術過程 腫瘤切除時,根據導航計劃提示,定位腫瘤所在部位,丘腦膠質瘤常呈魚肉狀、果凍樣改變,通過質地及色澤可與正常丘腦鑒別,同時避開腦深部血管神經結構,原則上先切除遠離錐體束的部分,再切除靠近錐體束的部分,同時注意保護丘紋靜脈等大腦深部靜脈系統。靠近腦室系統時,應盡量保持腦室壁的完整,避免腦脊液的大量流失和血液流入腦室系統,造成導航準確性的下降和術后腦積水。當出現以下任一情況時停止手術:1)鏡下導航提示手術操作區域已十分接近錐體束的“保護殼”;2)因腦脊液大量流失造成嚴重的腦漂移,導航準確性下降;3)術者認為腫瘤已切除干凈。手術停止后,瘤腔止血,無菌材料覆蓋術區進行術中磁共振掃描。
6 術中掃描及導航計劃更新 術中掃描序列及其參數、數據的傳輸和錐體束的重建方法與術前相同。如果術中掃描發現腫瘤切除滿意或因殘留腫瘤與錐體束距離過于接近而無法進一步切除則常規關顱,結束手術;如果術中掃描發現殘余腫瘤可以進一步切除,則融合術中與術前影像重新描繪殘余腫瘤,重建錐體束,并將更新的導航計劃導入術中導航系統。重新開啟導航,保留原有注冊信息,連接鏡下導航。如此反復,可行多次術中掃描及導航,直至腫瘤切除滿意。
7 腫瘤切除程度及神經功能評估 腫瘤的切除程度由一名具有高級職稱的神經外科醫師根據患者術前及術后復查的影像學資料計算,且該高級職稱醫師不知曉患者的病史和手術情況。腫瘤切除程度的計算方法:(術前腫瘤體積-術后腫瘤體積)/術前腫瘤體積。神經功能評估采用術前術后行為狀態評分(Karnofsky performance scale,KPS)和肌力兩項指標,分別由兩名高年資主治醫師在術前1 d、術后3周及術后3個月完成評估,分別記錄為Kpre、Kpost3w、Kpost3m、肌力pre、肌力post3w、肌力post3m,兩名主治醫師不知曉患者的影像學資料和手術情況。
8 統計學分析 統計分析應用SPSS 19.0(SPSS Inc.,Chicago,USA)完成。腫瘤的最初與最終切除程度(分別記為EORinitial與EORfinal)、Kpre與Kpost3w、Kpre與Kpost3m的差異性均采用配對t檢驗,檢驗水準α=0.05。肌力pre、肌力post3w、肌力post3m的差異性采用χ2檢驗,檢驗水準α=0.05。
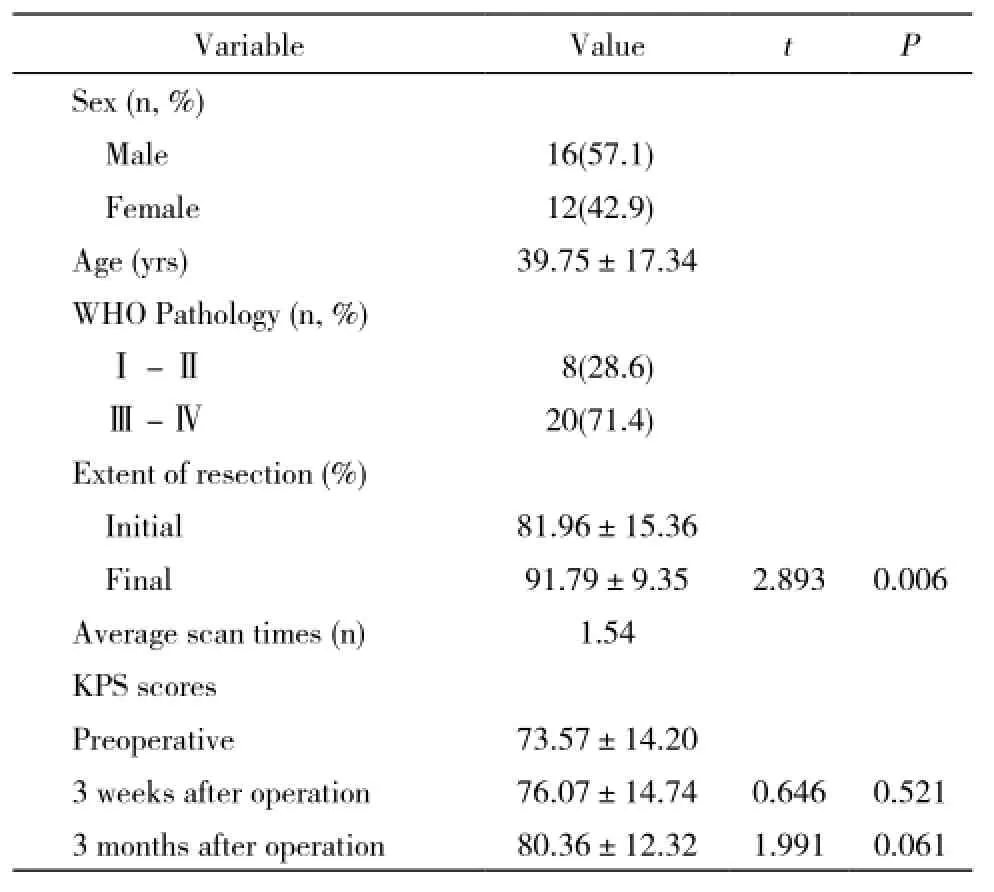
表1 28例丘腦膠質瘤患者基本資料Tab. 1 Basic characteristics of 28 patients with thalamic glioma
結 果
1 手術情況及病理 本組28例均在術中高場強磁共振聯合神經功能導航下完成手術,手術過程順利,無術中磁共振掃描及導航相關不良事件發生。其中兒童5例,成人23例。男女比例4:3。術后病理分級:WHOⅠ級3例,WHOⅡ級5例,WHOⅢ級12例,WHOⅣ級8例。見表1。
2 術中磁共振對腫瘤切除程度的影響 28例均在術中進行至少1次磁共振掃描。術中第1次掃描證實,術者準確判斷腫瘤切除程度20例,誤判8例。28例中,僅13例第1次術中掃描證實腫瘤切除滿意,其余15例第1次掃描時發現距離錐體束安全范圍內不同程度腫瘤殘留,進一步進行腫瘤切除。最終28例中,全切除13例,次全切除12例,部分切除3例。EORinitial(81.96%±15.36%)與EORfinal(91.79%±9.35%)差異有統計學意義(P <0.05)。術中磁共振發現原位血腫2例,術中及時行血腫清除術,術腔嚴格止血,術后患者均清醒且無新發神經功能障礙。

圖 1 典型病例術前、術中及術后影像資料A:術前磁共振提示右側丘腦病變; B:三維重建術前導航計劃。綠色為腫瘤,紫色為錐體束,紅色為感覺傳導束,藍色為靜脈; C:第1次術中掃描發現殘余腫瘤; D:更新導航計劃,術中顯微鏡下殘余腫瘤術區投影; E:第2次掃描提示腫瘤全切; F:術區顯微鏡下錐體束投影提示錐體束保留完好Fig. 1 Preoperative, intraoperative and postoperative image data of typical case A: Preoperative MRI revealed a right thalamic lesion; B: 3 dimensional reconstructed preoperative navigation plan. The green part was tumor, the purple part was pyramidal tract, the red part was sensory tract, the blue part was vein;C: First intraoperative scan revealed residual tumor; D: The navigation plan was updated and the residual tumor was projected into operative area through microscope; E: Second intraoperative scan confirmed total resection of tumor;F: Pyramidal tract was projected into operative area through microscope which suggested that pyramidal tract was well preserved
3 術中磁共振聯合錐體束導航對術后神經功能的影響 Kpre(73.57±14.20)與Kpost3w(76.07±14.74)及Kpost3m(80.36±12.32)的差異均無統計學意義(P >0.05)。術后3周時與術前相比,神經功能改善13例,無變化9例,下降6例(6例患者神經功能雖然有下降,但KPS評分均> 60,生活能夠自理)。術后3個月時與術前相比,神經功能改善19例,無變化7例,下降2例(2例患者神經功能雖然有下降,但KPS評分均> 60,生活能夠自理)。肌力pre、肌力post3w、肌力post3m之間的差異無統計學意義(P >0.05)。見表2。
4 典型病例 女性,45歲,因肢體感覺異常1個月,行頭顱MRI提示右側丘腦病變。術前重建導航計劃提示腫瘤貼近錐體束和感覺傳導束,同時將上述結構向前外側推擠。選擇高枕入路切除腫瘤。手術在術中磁共振聯合錐體束導航下進行,術中第1次掃描提示腫瘤在安全范圍內有殘余,于是更新導航計劃,重新連接顯微鏡下導航,重新定位殘余腫瘤,繼續切除。第2次掃描提示腫瘤全切除,同時錐體束及感覺傳導束保存完好。術后患者恢復良好,無新發神經功能損害。術后病理報告為彌漫性星形細胞瘤,WHOⅡ級。見圖1。
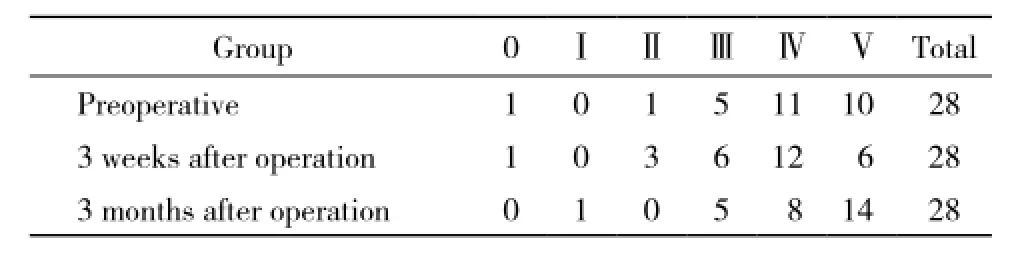
表2 28例患者術前術后肌力比較Tab. 2 Preoperative and postoperative myodynamia of 28 patients
討 論
丘腦膠質瘤占顱內腫瘤的1% ~ 5%,而膠質瘤常呈浸潤性生長,手術難以全切且易復發。丘腦膠質瘤毗鄰諸多重要結構,患者常伴有不同程度的運動障礙,激進性的切除常造成較高的致死率和致殘率,因此,過去一段時間針對丘腦膠質瘤的治療主要是立體定向穿刺活檢結合放療。隨著電生理監測、影像技術及顯微外科的發展,手術切除腫瘤能夠取得較好的效果[1,11-12]。但對于丘腦腫瘤鄰近運動傳導束所在的內囊后肢,一味地切除腫瘤勢必造成功能障礙,如何在腫瘤切除與功能保留之間權衡是困擾神經外科醫生的難題。目前,對于功能區的膠質瘤的手術切除理念,保護神經功能比激進性地切除病灶更重要[13]。隨著術中影像技術及神經導航的發展,使得顱內重要結構的術中可視化成為可能。術中影像結合錐體束導航可在提高腫瘤切除率的同時保證手術的安全性。
我科于2009年2月引進高場強術中磁共振系統,應用于丘腦膠質瘤切除手術,取得相對滿意的效果。而目前應用該系統聯合神經導航切除丘腦膠質瘤的研究較為罕見。本組患者的全切率由第1次掃描時的81.96%提高到最終的91.79%,略高于有關報道的丘腦膠質瘤手術全切率[5]。即使經驗豐富的術者,術中對于腫瘤切除程度的誤判率也相當高,如果沒有術中磁共振系統提供實時的影像學證據,及時發現殘余腫瘤,勢必會造成腫瘤切除率的下降。本組研究中,有超過50%的患者術中掃描發現安全范圍內殘余腫瘤,進一步實行手術切除,切除率均在原來基礎上得到提高,其中6例因為術中掃描實現全切除。Nimsky等[14]報道47例膠質瘤患者借助1.5 T術中磁共振系統施行手術,7例全切除獲益于術中掃描。一組包含137例膠質瘤患者的大樣本研究中,41%的術中掃描發現殘余腫瘤并行進步一切除,最終使得32%的病例實現全切[15]。國內外學者的研究均提示,術中磁共振聯合錐體束導航能夠有效提高膠質瘤的切除程度。
目前的膠質瘤治療理念提倡在保留功能的基礎上最大程度地切除腫瘤,因此保留神經功能是膠質瘤治療的目的。術中磁共振聯合神經導航在保留神經功能方面的優勢:1)優選手術入路。丘腦腫瘤位置深,成功手術的關鍵因素之一是客觀認識腫瘤與內囊后肢及正常丘腦在立體空間中的相對位置關系并選擇最佳的手術入路[16]。術前導航計劃可重建腫瘤、錐體束等重要機構,術者可在術前通過閱讀術前導航計劃,了解相關因素,從而選擇科學合理的手術入路,并在術中操作中做到心中有數。2)提高手術安全性。術中鏡下錐體束投影由虛線變為實線時提示操作已接近錐體束,應停止操作,進行術中掃描,明確腫瘤切除的情況,并根據術中影像的提示,如果在安全范圍內仍有殘留腫瘤,則更新導航,糾正腦漂移,根據導航提示繼續手術,從而提高手術安全性。3)可及時發現殘留腫瘤甚至新發血腫,及時處理,避免術后再出血、二次手術造成的神經功能損害。本組有2例術中掃描時發現原位血腫,術中行原位血腫清除及殘余腫瘤切除,術后患者意識清醒,無新發神經功能損害。另外,本中心曾有1例遠隔部位血腫,立即行血腫清除術后,患者如期清醒拔管,無新發神經功能障礙。由于以上優勢,本組術前術后神經功能評分無明顯差異,且術后無新發神經功能障礙病例。28例中22例神經功能改善或同術前,6例神經功能下降,神經功能下降者,生活均可自理。本組患者神經功能下降比例高于國外相關文獻報道[5,17],考慮可能與隨訪時間、本組成人較多、病理級別相對較高等因素有關。
本研究的不足之處在于缺乏隨機、對照、樣本量小及長期隨訪資料不夠等,有待于今后進一步完善。目前,臨床療效證實了術中磁共振聯合神經導航能夠為手術提供實時的術中影像和鏡下導航,在充分保留神經功能的同時,提高了腫瘤的切除率,反映了精準神經外科的新理念[18]。
1 Claus EB, Horlacher A, Hsu L, et al. Survival rates in patients with low-grade glioma after intraoperative magnetic resonance image guidance[J]. Cancer, 2005, 103(6): 1227-1233.
2 Albright AL. Feasibility and advisability of resections of thalamic tumors in pediatric patients[J]. J Neurosurg, 2004, 100(5 Suppl Pediatrics): 468-472.
3 Barone DG, Lawrie TA, Hart MG. Image guided surgery for the resection of brain tumours[J/OL]. http://dx.doi. org/10.1002/14651858.CD009685.pub2.
4 Schwake M, Stummer W, Suero Molina EJ, et al. Simultaneous fluorescein sodium and 5-ALA in fluorescence-guided glioma surgery[J/OL]. http://link.springer.com/article/10.1007%2Fs00701-015-2401-0.
5 Sai Kiran NA, Thakar S, Dadlani R, et al. Surgical management of thalamic gliomas: case selection, technical considerations, and review of literature[J]. Neurosurg Rev, 2013, 36(3): 383-393.
6 Tamura M, Hayashi M, Konishi Y, et al. Advanced image coregistration within the leksell workstation for the planning of glioma surgery: initial experience[J]. J Neurol Surg Rep, 2013, 74(2):118-122.
7 Kis D, Máté A, Kincses ZT, et al. The role of probabilistic tractography in the surgical treatment of thalamic gliomas[J]. Neurosurgery, 2014, 10(Suppl 2): 262-272.
8 Ozawa N, Muragaki Y, Nakamura R, et al. Shift of the pyramidal tract during resection of the intraaxial brain tumors estimated by intraoperative Diffusion-Weighted imaging[J]. Neurol Med Chir(Tokyo), 2009, 49(2): 51-56.
9 Nimsky C, Ganslandt O, Hastreiter P, et al. Preoperative and intraoperative diffusion tensor imaging-based fiber tracking in glioma surgery[J]. Neurosurgery, 2005, 56(1): 130-137.
10 Stadlbauer A, Nimsky C, Gruber S, et al. Changes in fiber integrity, diffusivity, and metabolism of the pyramidal tract adjacent to gliomas: a quantitative diffusion tensor fiber tracking and Mr spectroscopic imaging study[J]. AJNR Am J Neuroradiol, 2007,28(3): 462-469.
11 Ozawa N, Muragaki Y, Nakamura R, et al. Identification of the pyramidal tract by neuronavigation based on intraoperative diffusionweighted imaging combined with subcortical stimulation[J]. Stereotact Funct Neurosurg, 2009, 87(1): 18-24.
12 Muragaki Y, Iseki H, Maruyama T, et al. Information-guided surgical management of gliomas using low-field-strength intraoperative MRI[J]. Acta Neurochir Suppl, 2011, 109:67-72. 13 Mcgirt MJ, Mukherjee D, Chaichana KL, et al. Association of surgically acquired motor and language deficits on overall survival after resection of glioblastoma multiforme[J]. Neurosurgery, 2009,65(3): 463-469.
14 Nimsky C, Fujita A, Ganslandt O, et al. Volumetric assessment of glioma removal by intraoperative high-field magnetic resonance imaging[J]. Neurosurgery, 2004, 55(2): 358-370.
15 Nimsky C, Ganslandt O, Buchfelder M, et al. Intraoperative visualization for resection of gliomas: the role of functional neuronavigation and intraoperative 1.5 T MRI[J]. Neurol Res,2006, 28(5): 482-487.
16 Moshel YA, Elliott RE, Monoky DJ, et al. Role of diffusion tensor imaging in resection of thalamic juvenile pilocytic astrocytoma[J]. J Neurosurg Pediatr, 2009, 4(6): 495-505.
17 Ozek MM, Türe U. Surgical approach to thalamic tumors[J]. Childs Nerv Syst, 2002, 18(8):450-456.
18 Xu BN, Chen XL. Precise and accurate neurosurgery: new concept of minimal invasive neurosurgery[J]. Zhonghua Wai Ke Za Zhi,2011, 49(8):676-678.
Intraoperative high field magnetic resonance imaging combined with pyramidal tract navigation for resection of thalamic gliomas
WU Dongdong, CHEN Xiaolei, GENG Jiefeng, ZHANG Meng, BAI Shaocong, WANG Qun, MA Xiaodong, XU Bainan
Department of Neurosurgery, Chinese PLA General Hospital, Beijing 100853, China
Corresponding author: XU Bainan. Email: shjwkk@sina.com; MA Xiaodong. Email: maxiaodong301@126.com
Objective To explore the clinical value of high field iMRI combined with pyramidal tract navigation on the resection of thalamic gliomas. Methods Clinical data about 28 patients with thalamic gliomas admitted to our hospital from March 2009 to April 2014 were retrospectively analyzed. All patients underwent microsurgery aided by iMRI combined pyramidal tract navigation. The extent of resection (EOR) of tumors, pre- and post-operative Karnofsky performance scale (KPS) and myodynamia were evaluated. Results iMRI scanning revealed residual tumors in 22 of 28 patients, and 15 patients received further resection which increased EOR. Three weeks after surgery, neurological functions improved or kept no change in 22 cases, and 6 cases experienced neurological function decline, however, the KPS score of these 6 patients were higher than 60, which suggested that the patients could take care of themselves. Conclusion iMRI combined with pyramidal tract navigation is helpful to maximize the resection of thalamic gliomas and decrease incidence of the neurologic deficits.
intraoperative magnetic resonance; pyramidal tract navigation; thalamic glioma
R 651.1
A
2095-5227(2015)07-0694-05
10.3969/j.issn.2095-5227.2015.07.015
2015-01-14
國家自然科學基金項目(3080049)
Supported by the National Natural Science Foundation of China(3080049)
吳東東,男,在讀碩士。研究方向:神經導航技術。Email: 769605008@qq.com
許百男,男,主任醫師,教授,博士生導師。Email: sh jwkk@sina.com;馬曉東,男,主任醫師,教授,博士生導師。Email: maxiaodong301@126.com

