骨成形蛋白9在結直腸癌發生發展中的表達及臨床意義
樊銀杰,王 魏,孫宏治
遼寧醫學院,遼寧錦州 121001
綜述
骨成形蛋白9在結直腸癌發生發展中的表達及臨床意義
樊銀杰,王 魏,孫宏治
遼寧醫學院,遼寧錦州 121001
目的 探討骨成形蛋白9(bone morphogenetic protein-9,BMP-9)在結直腸癌演變過程中的表達及其與臨床病理特征的關系。方法 收集遼寧醫學院附屬第一醫院病理科2012年5月- 2014年10月收治的65例伴有腺瘤的結直腸癌患者的腺瘤組織、癌組織及對應的正常腸黏膜組織各65塊作為研究對象,運用免疫組化方法分析BMP-9和細胞增殖因子Ki-67在這些組織中的表達情況。結果 在正常結直腸黏膜、腺瘤及癌組織中,BMP-9的陽性率分別為68%(44/65)、91%(59/65)和95%(62/65),BMP-9在結直腸癌組織中的表達水平高于腺瘤組織(P<0.05),腺瘤組織中的表達水平高于正常腸黏膜組織(P<0.05);結直腸癌組織中BMP-9的表達水平與腫瘤位置、腫瘤大體類型、腫瘤組織的分化程度、組織學類型、WHO組織學分級、脈管內癌栓情況、TNM分期和血清腫瘤標記物CEA、CA19-9水平均無相關性(P>0.05);結直腸組織中BMP-9表達水平與Ki-67表達水平無顯著相關性(P>0.05),與腺瘤的臨床病理學指標均無顯著相關性(P>0.05)。結論 BMP-9在正常結直腸黏膜、腺瘤和癌組織中的表達呈遞增趨勢,說明BMP-9對于結直腸腫瘤的發生、發展可能起一定的促進作用。
骨成形蛋白9;Ki-67;結直腸腫瘤;腺瘤
網絡出版時間:2015-04-14 09:52 網絡出版地址:http://www.cnki.net/kcms/detail/11.3275.R.20150414.0952.001.html
結直腸癌是世界第3大惡性腫瘤,也是國內腫瘤死亡的第5大主要原因[1-2]。從腺瘤到腺癌的連續發展過程體現了大多數結直腸腫瘤患者正常腸上皮發生惡性轉變的生物學行為[3-4]。因此,清楚結直腸癌發生、發展和轉移的生物學行為顯得尤為重要。這就需要一種新的結直腸組織表達的分子標記物來預測結直腸腫瘤發生、發展的風險,其將會在腫瘤患者個體化診療及改善結腸癌患者預后等方面有很大的指導意義[5-6]。骨成形蛋白9(bone morphogenetic protein-9,BMP-9)是TGF-β超家族的成員之一,也叫做生長分化因子2(growth differentiation factor-2,GDF-2)[7]。BMP-9通過調控各種不同的細胞生長過程如增殖、分化、侵襲、存活及凋亡在體內發揮著各種生理作用[8-10],包括骨形成、肝網狀內皮系統功能、造血功能、神經分化功能、體內血糖穩態、體內鐵離子平衡和新生血管形成[11-17]。大量實驗研究證實,BMP-9也參與了腫瘤發生、發展過程[18-26]。與BMP-9相關的腫瘤研究已有很多,但對于BMP-9在結直腸癌發生、發展、侵襲和轉移方面的研究目前還沒有。因此,在本實驗中,我們通過對臨床結直腸正常黏膜、結直腸腺瘤和結直腸癌病理切片進行BMP-9和Ki-67免疫組化染色,比較BMP-9在正常結直腸黏膜、結直腸腺瘤和結直腸癌組織中表達情況,并分析BMP-9在結直腸癌組織中的表達情況與臨床病理學指標的相關性,探討BMP-9在結直腸癌發生、發展過程中的作用及臨床病理意義。
材料和方法
1 標本采集 收集本院病理科2012年5月- 2014年10月被診斷為伴有腺瘤的結直腸癌患者病理組織標本65例,取其腺瘤組織、癌組織及對應的正常黏膜組織蠟塊共195塊,常規做成4μm的病理切片。本院血清腫瘤標記物CEA和CA19-9水平檢測標準:CEA 0 ~ 3.4 ng/ml為正常,CA19-9 0 ~27 U/ml為正常。標本相關信息見表1。
2 主要病理學指標 腫瘤組織分期依據美國AJCC癌癥分期手冊(第7版)中的TNM分期標準[27]。腫瘤組織分級按照WHO分級標準將高分化(管狀)腺癌、乳頭狀腺癌及中分化(管狀)腺癌歸為低級別,將低分化(管狀)腺癌、黏液腺癌、印戒細胞癌、未分化癌及髓樣癌歸為高級別。
3 主要實驗試劑 BMP-9抗體(Abcam,ab35088)和Ki-67抗體(Abcam,ab15580)均購自美國Abcam公司,免疫組化二步增強液(PV-9000)和DAB染色試劑盒均購自北京中山金橋生物公司,胎牛血清(BSA,A1933)和蘇木素(MHS16)購自美國Sigma公司,中性樹膠購自英國AGTC(HS-103-100ML)生物公司。
4 免疫組化檢測 石蠟病理組織切片首先進行烤片并置于二甲苯中進行脫蠟處理,然后過梯度乙醇水化。在用純水洗過后,進行抗原修復,BMP-9為pH 6.0檸檬酸鈉抗原修復液高壓修復,Ki-67為pH 6.0檸檬酸鈉抗原修復液煮沸修復。完成后,使其緩慢恢復室溫。然后用1%胎牛血清封閉1 h。分別用濃度為1∶100的BMP-9抗體和1∶250的Ki67抗體4℃過夜。然后,用二步染色增強試劑盒及DAB染色試劑盒進行染色,用蘇木素復染后,進行中性樹膠封片處理。每次染色均設有用封閉液(1% BSA)代替一抗的陰性對照。
5 免疫組化染色半定量評判標準 1)BMP-9根據染色強度分為4個等級:0級(無著色)評0分,1級(淡黃色)評1分,2級(黃色)評2分,3級(棕黃色)評3分。根據陽性細胞比例分為5個等級:0級(<5%)評0分,1級(5% ~ 25%)評1分,2級(25% ~ 50%)評2分,3級(50% ~ 75%)評3分,4級(>75%)評4分。最終評分根據兩者乘積,總分為0 ~ 12分,分為4級:0分為陰性(-),1 ~3分為弱陽性(+),4 ~ 7分為中等陽性(++),8 ~ 12分為強陽性(+++)。2)Ki-67免疫組化染色結果根據陽性細胞比例評估:陽性細胞數所占比例<10%為陰性(-),10% ~ 25%為弱陽性(+),25% ~ 50%為中度陽性(++),>50%為強陽性(+++)。
6 統計學分析 采用SPSS20.0統計學軟件。χ2檢驗進行組間率的比較,相關分析采用Spearman等級相關方法。P<0.05為差異有統計學意義。
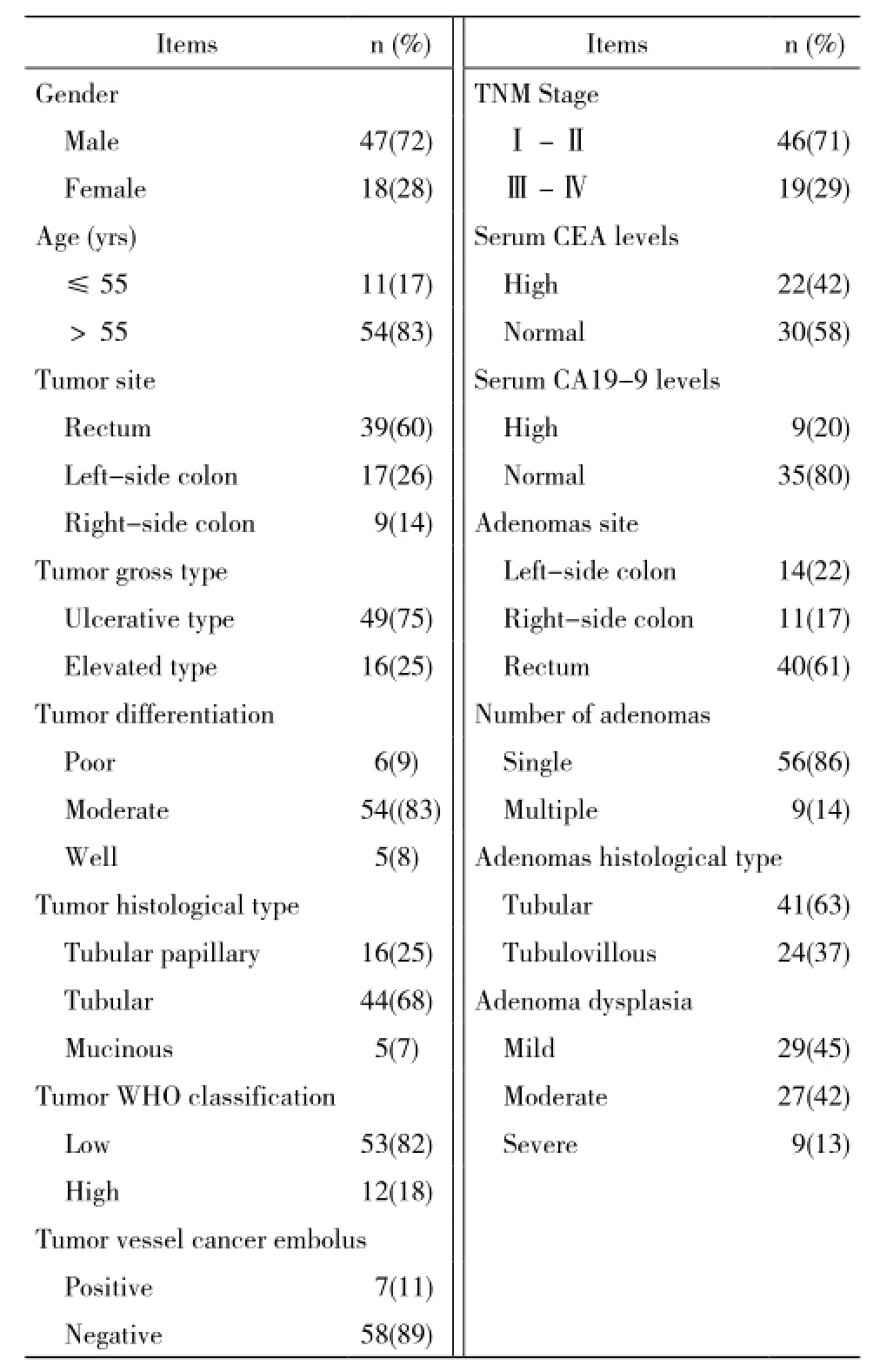
表1 臨床標本的主要信息Tab. 1 Main information of clinical specimen
結 果
1 BMP-9在正常結直腸黏膜、腺瘤及癌組織中的表達 BMP-9陽性染色主要定位于細胞質和細胞膜上,細胞核著色很弱或者幾乎不著色。在正常結直腸黏膜、腺瘤及癌組織中,BMP-9的陽性率分別為68%(44/65)、91%(59/65)和95%(62/65)。Spearman等級相關分析,在正常腸黏膜、腺瘤和腺癌組織中BMP-9的表達水平有統計學差異(P<0.05)。進一步兩兩比較,BMP-9在結直腸癌組織中的表達水平高于腺瘤組織(r = 0.221,P<0.05),腺瘤組織中的表達水平高于正常腸黏膜組織(r = 0.572,P<0.05),提示BMP-9在結直腸癌組織中的表達較高,腺瘤組織次之,在正常腸黏膜中表達最低。見圖1、表2。
2 Ki-67在正常結直腸黏膜、腺瘤及癌組織中的表達 Ki-67陽性染色定位于細胞核,細胞質和細胞膜不著色。在正常結直腸黏膜、腺瘤及癌組織中,Ki-67的陽性率分別為82%(53/65)、100%(65/65)和98%(64/65)。Spearman等級相關分析,在正常腸黏膜、腺瘤和腺癌組織中Ki-67的表達水平有統計學差異(r = 0.711,P<0.05)。進一步兩兩比較,Ki-67在結直腸癌組織中的表達水平高于腺瘤組織(r = 0.506,P<0.05),腺瘤組織中的表達水平高于正常腸黏膜組織(r = 0.546,P<0.05),提示BMP-9在結直腸癌組織中的表達較高,腺瘤組織次之,在正常腸黏膜中表達最低。見圖1、表2。
3 結直腸腺瘤組織中BMP-9的表達水平與病理學指標的相關性 結直腸腺瘤組織中BMP-9的陽性表達與腺瘤的位置、腺瘤的單、多發性、腺瘤的組織學類型及腺瘤的不典型增生均無相關性(P>0.05) (表3)。其中,在腺瘤上皮的不典型增生分度中,BMP-9表達陽性率在輕度不典型增生中為86%(25/29),在中度不典型增生中為96%(26/27),在重度不典型增生中為89%(8/9)。
4 癌組織中BMP-9的表達與臨床病理學指標的相關性 結直腸癌組織中BMP-9的陽性表達與癌腫位置、腫瘤大體類型、腫瘤組織的分化程度、組織學類型、WHO組織學分級、脈管內癌栓情況、TNM分期和血清腫瘤標記物CEA、CA19-9水平均無相關性(P>0.05)。見表3。
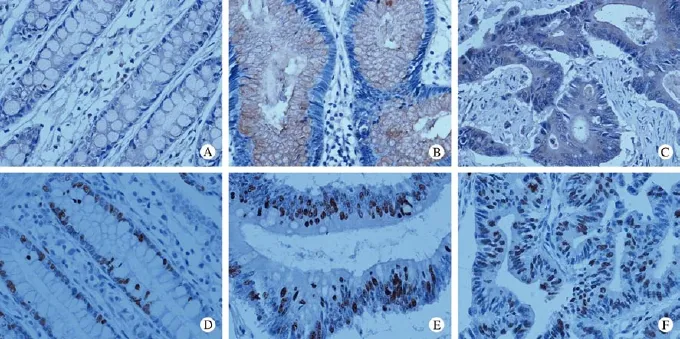
圖 1 BMP-9和Ki-67在正常結直腸黏膜、腺瘤及癌組織中的表達情況(400×)A: BMP-9在正常腸黏膜組織中的表達; B: BMP-9在腺瘤組織中的表達; C: BMP-9在結直腸癌組織中的表達; D: Ki-67在正常腸黏膜組織中的表達; E: Ki-67在腺瘤組織的表達; F: Ki-67在結直腸癌組織中的表達Fig. 1 Expressions of BMP-9 and Ki-67 in colorectal carcinoma, adenoma and normal mucosa (original magnification: 400×)A: expression of BMP-9 in normal colorectal mucosa; B: expression of BMP-9 in colorectal adenoma; C: expression of BMP-9 in colorectal carcinoma; D: expression of Ki-67 in normal colorectal mucosa; E: expression of Ki-67 in colorectal adenoma; F: expression of Ki-67 in colorectal carcinoma
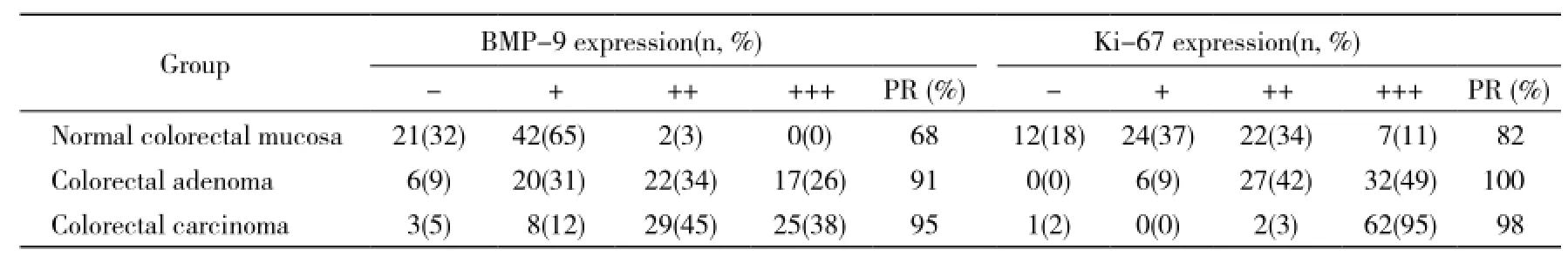
表2 BMP-9和Ki-67在正常結直腸黏膜、腺瘤及癌組織中的表達Tab. 2 Expressions of BMP-9 and Ki-67 in specimens of colorectal carcinoma, adenoma and normal mucosa
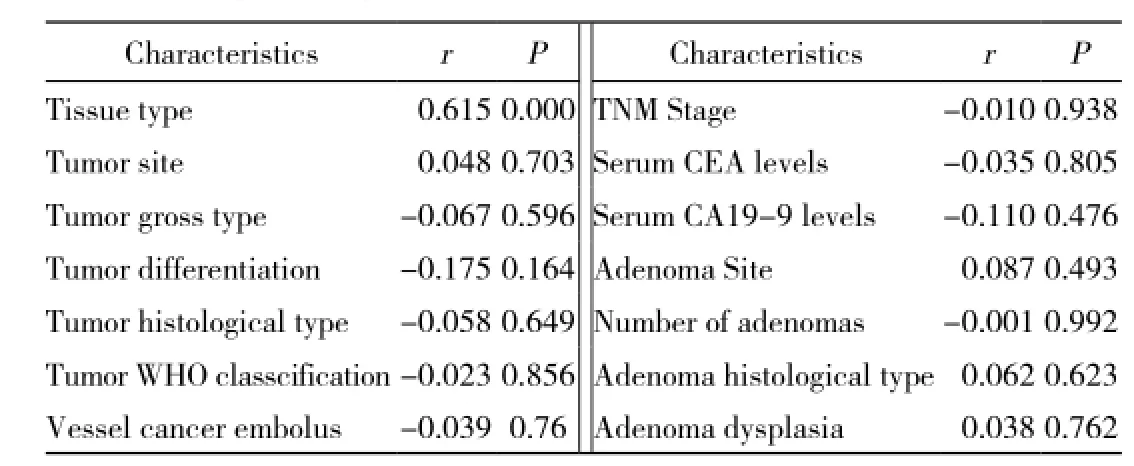
表3 BMP-9的表達水平與臨床病理學指標的關系Tab. 3 Relationship between expressions of BMP-9 and clinicopathological characteristics of colorectal adenoma
5 癌組織中BMP-9的表達與Ki-67表達的相關性 Spearman等級相關分析結果顯示,結直腸組織中BMP-9表達與Ki-67表達無顯著相關性(r = -0.024,P>0.05)。
討 論
早在20世紀50年代,Jackman和Mayo將Dukes最先提出的結直腸腫瘤的發生大部分是由良性的腺瘤發展而來的理論正式定義為“正常腸黏膜—腸腺瘤—腺癌”順序[28]。在形態學上,也可以發現結直腸上皮增生、腺瘤再到癌變各個階段的發生以及相應染色體的改變。這也體現了結直腸癌的發生、發展是一個多步驟、多階段及多基因參與的生物學事件。這一多步驟的復雜過程就使得臨床上結直腸癌的診治變得異常困難,如早期結直腸癌微小病灶漏診率較高,治療過程中的藥物耐受等。因此,對結直腸腫瘤新的分子學標記物的發現對于臨床結直腸癌的診治意義重大。BMP-9參與人體內眾多的生理病理過程,其在腫瘤發生、發展方面的研究已有很多,研究總結發現,BMP-9在腫瘤組織中的表達和對腫瘤發生、發展、轉移的作用都具有種屬特異性,即在不同的腫瘤中表達和所發揮的作用不同。目前,BMP-9在甲狀腺癌、卵巢癌、乳腺癌、前列腺癌、肝細胞癌、骨肉瘤、骨髓瘤等多種腫瘤組織中已有相關研究,而對于結直腸癌的相關研究尚未見報道。因此,本實驗將首次研究BMP-9在結直腸癌發生、發展過程中的表達情況,免疫組化染色結果提示,BMP-9主要表達于細胞質,在細胞膜和細胞核中的表達較弱或者幾乎不表達;統計學結果表明,BMP-9在正常腸黏膜上皮、腺瘤和腺癌組織中的表達呈遞增趨勢。同時,我們也對腺瘤組織中BMP-9的表達和腺瘤的病理學特征進行了研究,發現在中、重度不典型增生的腺瘤上皮中BMP-9的陽性表達率高于輕度不典型增生。此外,我們在結直腸組織BMP-9的表達水平與臨床病理學指標的相關性研究中發現,BMP-9表達水平與臨床病理學指標均無明顯相關性。同時,我們也對細胞增殖因子Ki-67和BMP-9表達情況進行了相關性分析,并未發現在結直腸正常腸黏膜上皮、腺瘤和腺癌組織中BMP-9的表達水平與增殖指標存在相關性,提示BMP-9在結直腸癌發生、發展過程中所發揮的作用可能與細胞增殖作用不大。
本研究首次對BMP-9在結直腸發生、發展過程中不同組織中的表達情況進行了研究,旨在探索在結直腸癌發生、發展過程中BMP-9所起的作用。也分析了結直腸腺瘤和腺癌中BMP-9的表達與臨床病理學指標的相關性,這對結直腸癌的臨床診療有極其重要的作用。本實驗所選病例為伴發腺瘤的結直腸癌患者,所取的正常腸黏膜組織亦屬于相應的同一患者,這一自身對照大大減少了個體組織差異性所帶來的影響;同時,用于BMP-9和Ki-67的免疫組化染色切片也是出自于同一個組織蠟塊,這也為分析BMP-9和Ki-67的相關性時提供了較好的對比性,在實驗設計上具有一定的創新性。但是由于存在納入研究條件的限制和病源受限的問題,致使納入研究的病例數不足,尚不能得出較為可靠的結論;在染色條件方面,Miyamoto等[29]、Pecina-Slaus等[30]、楊其昌[31]、樊祥山[32]實驗中所用的組織芯片實驗效率高、實驗對比度好,能夠極大地降低染色實驗條件前后不一致所帶來的影響,而本實驗中涉及的免疫組化切片數量多,在分批染色時雖然固定了統一的染色步驟和染色時間,但也會存在一定的前后染色條件差異,如所用試劑批次不一、染色環境溫度的差異等,都會對實驗結果產生一定的影響;此外,在進行免疫組化染色結果評判方面,雖然采用了國內外公認的半定量免疫組化評判標準(見上述免疫組化染色評判標準),但切片質量和抗原修復的影響(比如切片組織的折疊、脫落等)、組織表達蛋白強弱的個體差異性和主觀因素會對染色結果的評判產生一定影響,而Guo等[33]用Image-Pro Plus圖像分析軟件對免疫組化結果進行較為客觀的定量評估,這在一定程度上避免了本實驗中染色結果評判過程中的多種干擾因素。
本實驗通過對正常腸黏膜上皮組織、結直腸腺瘤組織和結直腸癌組織進行BMP-9和增殖指標蛋白Ki-67的免疫組化染色,發現BMP-9在正常腸黏膜上皮、腺瘤及腺癌這3種不同組織中的表達水平呈現逐步遞增趨勢。這在一定程度上說明了在“正常腸黏膜—腸腺瘤—腺癌”的經典結直腸癌演變序列中,BMP-9可能起著促進結直腸腫瘤發生、發展的作用。這一研究結果不僅發現了BMP-9在結直腸腫瘤這一新領域所發揮的作用,使我們對BMP-9的生理病理作用有更為深刻的了解;更重要的是,也確定了BMP-9這一新的結直腸癌分子生物學標記物,更加完善了結直腸癌發生、發展的作用機制。這一結論的確立,對于臨床上檢測結直腸癌早期進展情況和預測腫瘤預后有極其重要的指導意義。對于結直腸腫瘤的高危人群,我們可以對其定期進行正常腸黏膜活檢,病理檢測腸黏膜中BMP-9的表達水平,來預測結直腸腫瘤發生的風險;對于臨床上結直腸腺瘤切除或者活檢的患者,病理檢測腺瘤組織中BMP-9的表達情況,進而推測腺瘤惡變的可能性。BMP-9的表達水平可以作為正常腸上皮和腺瘤惡變程度的一個判定指標,在臨床上可以結合其他病理學特征,對結直腸癌的高危人群的預后做出一個綜合的判定。若BMP-9表達水平較高,我們可以考慮預防性給予抗腫瘤干預治療,來削弱或阻斷“正常腸黏膜—腸腺瘤—腺癌”這一發展過程,提前預防結直腸腫瘤的發生。上述措施在結直腸癌早期發現和降低結直腸癌的發生率方面都有著非常重要的臨床指導意義。
我們的實驗通過免疫組化實驗證實了BMP-9在“正常腸黏膜—腸腺瘤—腺癌”這一結直腸癌發生、發展過程中的遞增趨勢,但BMP-9與Ki-67的表達水平對腺瘤、腺癌的大部分臨床病理學指標的影響差異均無統計學意義,考慮可能是納入研究的病例數不足、染色條件前后一致性不好和免疫組化染色結果評判偏差等多方面的原因。因此,在以后的實驗研究中,我們可以考慮適當擴大樣本量,使用組織芯片和運用Image-Pro Plus或其他圖像分析軟件對免疫組化結果進行定量評估等實驗設計,使BMP-9在結直腸癌發生、發展過程中呈遞增趨勢這一結論更具說服力,同時進一步研究確定BMP-9表達水平與腺瘤、腺癌的臨床病理學指標的相關性。另外,在實驗中,我們也發現了BMP-9在正常腸上皮黏膜組織的細胞核中有一定的表達,在細胞質中表達極弱的現象;同時也發現了在腺瘤和腺癌組織中,BMP-9在細胞核中不表達,而在細胞質和(或)細胞膜中存在著一定表達的現象。這一現象也就是在“正常腸黏膜—腸腺瘤—腺癌”組織演變過程中,BMP-9出現了核/質減少情況。但由于免疫組化實驗的蛋白表達定位局限性,這一BMP-9的核-質轉變的結論也存在著較大的爭議。因此,在以后的研究中,可以考慮結合組織免疫熒光共染技術,更明確地定位BMP-9的表達;同時可考慮分別提取正常腸黏膜、腺瘤和結直腸癌的組織和(或)細胞中的核蛋白,細胞質蛋白和膜蛋白,通過Western blot實驗對BMP-9的表達進行定量分析,進一步鞏固BMP-9在結直腸癌發生、發展過程中呈遞增趨勢這一結論,同時探索BMP-9在“正常腸黏膜—腸腺瘤—腺癌”演變過程中的核-質轉化情況,為進一步研究BMP-9在結直腸癌發生、發展過程中的作用機制提供線索。本研究僅對BMP-9在正常腸黏膜上皮組織、腺瘤組織和結直腸癌組織中的表達情況做了相關研究,得出了BMP-9有促進結直腸腫瘤發生、發展的作用,但并未進行相關機制的研究。Herrera等[19]研究發現,在卵巢癌中BMP-9可以通過其受體活化素類似物激酶(activin like kinase,ALK)Ⅱ型受體-Smad1-Smad4途徑促進卵巢癌細胞增殖,Li等[20]和Herrera等[21]實驗證實,BMP-9能誘發肝細胞癌的EMT,進而影響肝細胞癌的侵襲、轉移過程,Yoshimatsu等研究發現,BMP-9能通過ALK1抑制腫瘤進展過程中淋巴管形成,進而抑制腫瘤的侵襲、轉移過程。因此,在以后的關于結直腸癌BMP-9研究中,可以逐步探索BMP-9影響結直腸癌發生、發展、侵襲、轉移的相關機制。這一機制一旦明確,對臨床上更好地制訂結直腸癌患者個體化診療方案、評估腫瘤進展情況及結直腸癌患者臨床預后等方面都會產生較為重大的意義。
1 Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
2 Lech G, Slotwinski R, Krasnodebski IW. The role of tumour markers and biomarkers in colorectal cancer[J]. Neoplasma, 2014, 61(1):1-8.
3 Lundberg IV, Burstrom AL, Edin S, et al. SOX2 expression is regulated by BRAF and contributes to poor patient prognosis in colorectal cancer[J]. PLoS One, 2014, 9(7): e101957.
4 Fearon E, Vogelstein B. A genetic model for colorectal tumorigenesis[J]. Cell, 1990, 61(5): 759-767.
5 Ahmed FE. Development of novel diagnostic and prognostic molecular markers for sporadic colon cancer[J]. Expert Rev Mol Diagn,2005, 5(3): 337-352.
6 Jankowski JA, Odze RD. Biomarkers in gastroenterology: between hope and hype comes histopathology[J]. Am J Gastroenterol,2009, 104(5): 1093-1096.
7 Riethdorf S, Wikman H, Pantel K. Review: biological relevance of disseminated tumor cells in cancer patients[J]. Int J Cancer,2008, 123(9): 1991-2006.
8 Wagner DO, Sieber C, Bhushan RA, et al. BMPs: from bone to body morphogenetic proteins[J]. Sci Signal, 2010, 3(17): mr1.
9 Plouhinec JL, Zakin L, De Robertis EM. Systems control of BMP morphogen flow in vertebrate embryos[J]. Curr Opin Genet Dev,2011, 21(6):696-703.
10 Reddi AH, Reddi A. Bone morphogenetic proteins (BMPs): From morphogens to metabologens[J]. Cytokine Growth Factor Rev,2009, 20(5/6): 341-342.
11 Celeste A, Cox K, Rosen V, et al.. Bone morphogenetic protein-9,a new member of the TGF-β superfamily[J]. J Bone Miner Res,1994, 9(S1): 136.
12 Ploemacher RE, Engels LJ, Mayen AE, et al. Bone morphogenetic protein 9 is a potent synergistic factor for murine hemopoietic progenitor cell Generation and colony formation in serum-free cultures[J]. Blood, 1997, 90(10, 1, 1): 2116.
13 Helm GA, Alden TD, Beres EJ, et al. Use of bone morphogenetic protein-9 gene therapy to induce spinal arthrodesis in the rodent[J]. J Neurosurg, 2000, 92(S2):191-196.
14 Lopez-Coviella I, Berse B, Krauss R, et al. Induction and maintenance of the neuronal cholinergic phenotype in the central nervous system by BMP-9[J]. Science, 2000, 289(5477):313-316.
15 Chen C, Grzegorzewski KJ, Barash S, et al. An integrated functional genomics screening program reveals a role for BMP-9 in glucose homeostasis[J]. Nat Biotechnol, 2003, 21(3):294-301.
16 Truksa J, Peng HF, Lee P, et al. Bone morphogenetic proteins 2, 4,and 9 stimulate murine hepcidin 1 expression independently of Hfe,transferrin receptor 2 (Tfr2), and IL-6[J]. Proc Natl Acad Sci U S A, 2006, 103(27): 10289-10293.
17 David L, Mallet C, Mazerbourg S, et al. Identification of BMP9 and BMP10 as functional activators of the orphan activin receptor-like kinase 1 (ALK1) in endothelial cells[J]. Blood, 2007, 109(5):1953-1961.
18 Na KY, Kim HS, Lee SK, et al. Papillary thyroid carcinoma with bone formation[J]. Pathol Res Pract, 2013, 209(1): 14-18.
19 Herrera B, Van Dinther M, Ten Dijke P, et al. Autocrine bone morphogenetic protein-9 signals through activin receptor-like kinase-2/Smad1/Smad4 to promote ovarian cancer cell proliferation[J]. Cancer Res, 2009, 69(24): 9254-9262.
20 Li Q, Gu X, Weng HL, et al. Bone morphogenetic protein-9 induces epithelial to mesenchymal transition in hepatocellular carcinoma cells[J]. Cancer Sci, 2013, 104(3): 398-408.
21 Herrera B, Garcia-Alvaro M, Cruz S, et al. BMP9 is a proliferative and survival factor for human hepatocellular carcinoma cells[J]. PLoS One, 2013, 8(7): e69535.
22 Ye L, Kynaston H, Jiang WG. Bone morphogenetic protein-9 induces apoptosis in prostate cancer cells, the role of prostate apoptosis response-4[J]. Mol Cancer Res, 2008, 6(10): 1594-1606.
23 Wan SH, Liu YE, Weng YG, et al. BMP9 regulates cross-talk between breast cancer cells and bone marrow-derived mesenchymal stem cells[J]. Cell Oncol (Dordr), 2014, 37(5): 363-375.
24 Ren W, Liu YE, Wan SH, et al. BMP9 inhibits proliferation and metastasis of HER2-Positive SK-BR-3 breast cancer cells through ERK1/2 and PI3K/AKT pathways[J]. PLoS One, 2014, 9(5):e96816.
25 Ren W, Sun XX, Wang K, et al. BMP9 inhibits the bone metastasis of breast cancer cells by downregulating CCN2 (connective tissue growth factor, CTGF) expression[J]. Mol Biol Rep, 2014, 41(3):1373-1383.
26 Olsen OE, Wader KF, Misund K, et al. Bone morphogenetic protein-9 suppresses growth of myeloma cells by signaling through ALK2 but is inhibited by endoglin[J]. Blood Cancer J, 2014, 4:e196.
27 Edge SB, Byrd DR, Compton CC, et al. American joint committee on cancer staging manual[M]. 7th ed. New York: Springer, 2009:143-164.
28 Kopper L, Hajdú M. Tumor stem cells[J]. Pathol Oncol Res,2004, 10(2):69-73.
29 Miyamoto M, Takano M, Iwaya K, et al. High-temperature-required protein A2 as a predictive marker for response to chemotherapy and prognosis in patients with high-grade serous ovarian cancers[J]. Br J Cancer, 2015, 112(4):739-744.
30 Pecina-Slaus N, Gotovac K, Kafka A, et al. Genetic changes observed in a case of adult pilocytic astrocytoma revealed by array CGH analysis[J]. Mol Cytogenet, 2014, 7(1): 95.
31 楊其昌.Survivin,Caspase3在胃癌組織芯片中表達及意義的研究[D].蘇州:蘇州大學,2004.
32 樊祥山.Lgr5在結直腸癌發生和進展過程中的作用及其機制研究[D].南京:南京大學,2013.
33 Guo WL, Zhang Q, Wang J. Expression of beta-catenin and c-myc during human common bile duct development: a possible role in the morphogenesis of the common bile duct[J]. Braz J Med Biol Res,2014, 47(7): 594-599.
Expression of BMP-9 in development and progression of colorectal carcinoma and its clinical significance
FAN Yinjie, WANG Wei, SUN Hongzhi
Liaoning Medical University, Jinzhou 121001, Liaoning Province, China
Corresponding author: SUN Hongzhi. Email: cmushz@163.com
Objective To investigate the expression of BMP-9 (bone morphogenetic protein-9) in colorectal cancer (CRC) and the relationship between BMP-9 and clinicopathological characteristics of CRC. Methods The colorectal adenoma and carcinoma tissues and its corresponding normal colorectal mucosa from 65 patients with a pathologically proven diagnosis of colorectal adenoma and adenocarcinoma from the department of pathology in the First Affiliated Hospital of Liaoning Medical University from May 2012 to October 2014 were examined for BMP-9 and cell proliferative factor Ki-67 expressions using immunohistochemistry. Results The positive rate of BMP-9 expression in the normal colorectal mucosa, adenoma and colorectal carcinoma was 68% (44/65), 91%(59/65) and 95% (62/65), respectively. The expression of BMP-9 in colorectal carcinoma tissues was significantly higher than that in adenoma tissues (P<0.05), and the expression of BMP-9 in adenoma tissues was higher than that in normal mucosa (P<0.05). However, there was no correlation between expression of BMP-9 and tumor location and types, degree of differentiation, histological type, WHO histological classification, vessel cancer embolus, TNM stage and the level of tumor marker CEA and CA19-9 in the serum of CRC (P>0.05). The expression of BMP-9 was not correlated to the level of cell proliferative factor Ki-67 (P>0.05). There was no correlation between expression of BMP-9 and clinicopathological characteristics in colorectal adenoma (P>0.05). Conclusion The increasing level of BMP-9 in normal colorectal mucosa- adenoma- carcinoma tissues indicates that BMP-9 may promote the development and progression of colorectal carcinoma.
bone morphogenetic protein-9; Ki-67; colorectal neoplasms; adenoma
R 735.3
A
2095-5227(2015)07-0728-06
10.3969/j.issn.2095-5227.2015.07.024
2015-02-04
基金課題:吳階平醫學基金會臨床科研專項資助基金(320.6750.1393);遼寧省科學技術計劃項目(2013225305)
Supported by the special funds of Wu Jie-ping medical foundation of clinical research (320.6750.1393); Science and Technology Plan Projects of Liaoning Province (2013225305)
樊銀杰,男,在讀碩士。研究方向:消化道惡性腫瘤。Email: 979920276@qq.com
孫宏治,男,博士生導師,教授。Email: cmushz@163. com

