骨性關節炎患者膝關節軟骨及軟骨下骨中miR-214的表達
余曉明,袁雪凌,孟昊業,孫 振,尹合勇,郭全義,彭 江,汪愛媛,盧世璧解放軍總醫院 骨科研究所,北京 00853;南開大學,天津 30007
骨性關節炎(osteoarthritis,OA)是一種臨床上常見的退行性疾病,主要表現為關節軟骨及軟骨下骨的退行性改變、關節疼痛、活動困難、骨贅形成等癥狀,好發于中老年人[1-2]。MicroRNAs(miRNAs,miR)是一個龐大的內源性、非編碼核苷酸序列家族,長度21 ~ 25個核苷酸,主要在轉錄后信使RNA的功能上調控基因的表達[3-5]。近年來,越來越多的miRNAs被證明在骨科疾病中起著重要作用[6]。而miRNA-214被證明在骨質疏松的骨重塑過程中對破骨細胞的功能有調控作用[7]。為進一步研究miR-214的功能,本實驗旨在探究其在骨關節炎發展進程中的表達情況,以便了解miR-214作為骨性關節炎治療靶向標記物的潛在價值。
材料和方法
1 實驗標本 實驗用原發性膝關節骨性關節炎患者及截肢患者脛骨平臺標本,由本院關節外科行人工全膝關節置換術治療的30例OA患者及嚴重創傷需行截肢手術治療的10例患者自愿捐贈。均排除腫瘤、類風濕關節炎、感染及激素治療等因素。其中男性23例,女性17例,年齡31 ~ 82歲。患者術前均行雙膝關節負重位X線檢查,后依據Kellgren-Lawrence X線診斷標準將其分為Ⅰ級組(10例)、Ⅱ級組(10例)、Ⅲ級組(10例)、Ⅳ級組(10例),進行實驗檢測。
2 RNA提取 將收集的脛骨平臺分離軟骨和軟骨下骨,用陶瓷研缽分別將其在液氮下研碎。將分離的軟骨及軟骨下骨100 mg分別裝入1.5 ml EP管中,用TRIzol提取組織中的RNA,樣本經裂解、分層、RNA沉淀、洗滌和溶解后,使用分光光度計測定RNA濃度和純度,確保后續試驗準確度。
3 反轉錄合成cDNA 按照qPCR反轉錄試劑盒(SYBR Green ReverTra Ace qPCR RT Kit)說明書中要求,配置20μl反應體系,將測定濃度后的RNA樣本加入反應體系進行反轉錄反應。反應在熱循環儀上進行,配置反轉錄體系反應液的所有操作均在冰上進行。反轉錄反應體系成分:5×RT Buffer,4μl;RT Enzyme Mix,1μl;Primer Mix,1μl;RNA sample,2μl;Nuclear free water,加至20μl。反應條件 :37℃15 min,95℃5 min。
4 實時熒光定量PCR 檢測miR-214:按照qPCR擴增反應試劑盒(SYBR Green Realtime PCR Master Mix-Plus)說明書中要求,配置擴增反應混合液,并分別加入miR-214引物,U6為內參引物,最后加入反轉錄合成的cDNA,反應體系成分:SYBR Green RT-PCR Master Mix,10μl;Plus solution,2μl;上游引物,0.5μl;下游引物,0.5μl;cDNA,1μl;Nuclear free water,6μl。引物序列:miR-214,上游為GACAGCAGGCACAGACA,下游為GT GCAGGGTCCGAGG;U6上游為CTCGCTTCGGCAG CACA3,下游為AACGCTTCACGAATTTGCGT。擴增反應條件:95℃1 min,95℃15 s,60℃15 s,72℃45 s,中間兩步共40個循環。反應體系在實時熒光定量PCR機(Applied Biosystems Life Technologies,Foster City,CA,USA)中進行擴增反應。在結果分析中,miRNAs與U6的相對表達量用Delta Ct(ΔCt)表示,其最后表達倍數值用2-ΔΔCt值表示。
5 統計學分析 運用SPSS17.0統計學軟件分析,各組間作比較采用ANOVA方差分析,P<0.05為差異有統計學意義。
結 果
1 miR-214在OA軟骨組織中的表達水平 所有樣本中均有miR-214表達,Ⅳ級組中miR-214的表達水平最高,各組表達水平呈逐漸上調趨勢(圖1),各組間差異均有統計學意義(P<0.05)。OA發展嚴重程度與miR-214的表達水平呈正相關。
2 miR-214在OA軟骨下骨中的表達水平 Ⅲ級組中miR-214的表達水平明顯高于其他3組(P<0.05)。軟骨下骨中miR-214的表達水平差異不同于軟骨中表達水平。見圖2。
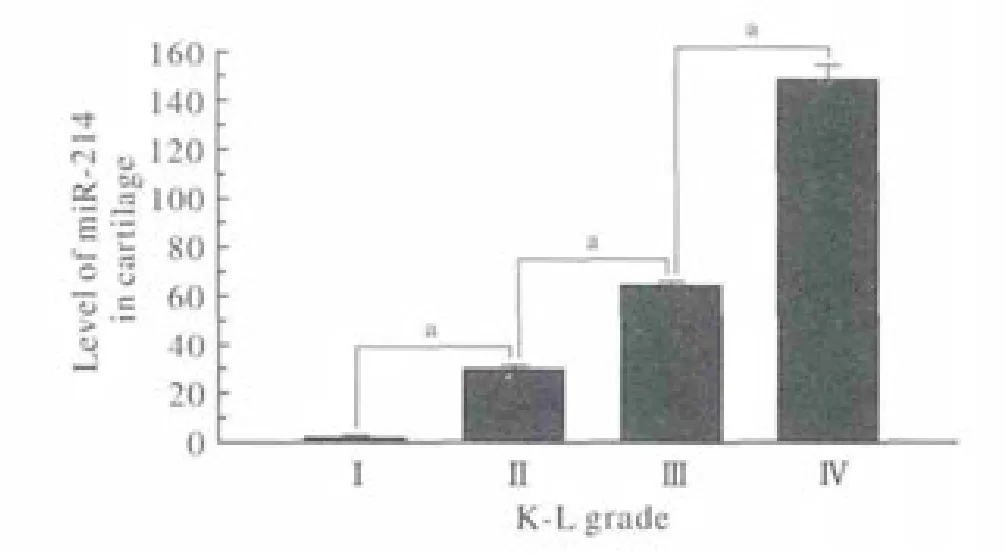
圖 1 不同OA分級組軟骨中miR-214的表達情況(aP<0.05)Fig. 1 Expression level of miR-214 in different grade of OA cartilage(aP<0.05)
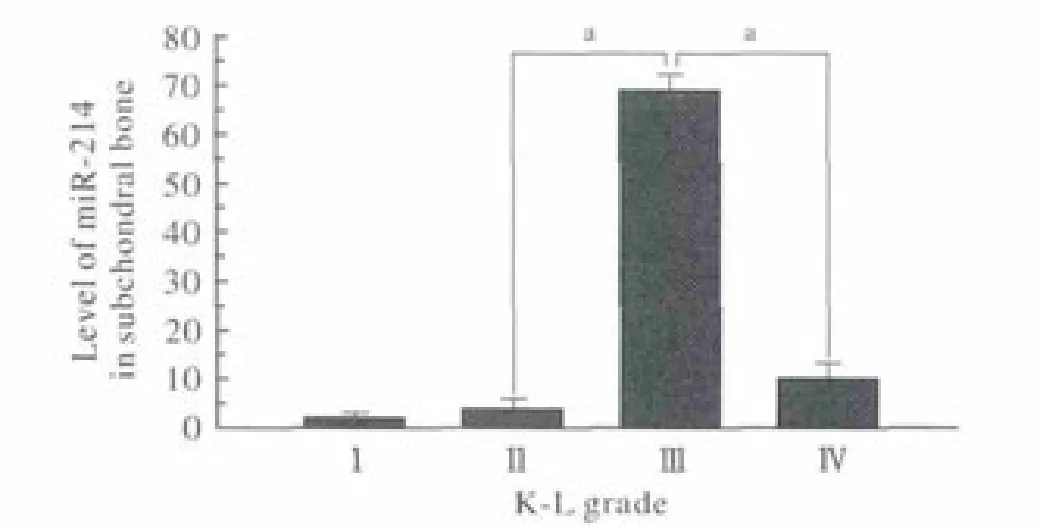
圖 2 不同OA分級組軟骨下骨中miR-214的表達情況(aP<0.05)Fig. 2 Expression level of miR-214 in different grade of OA subchondral bone (aP<0.05)
討 論
骨性關節炎主要以關節軟骨退變、軟骨下骨進行性改變、骨贅形成和滑膜炎癥反應為主要特征,嚴重影響著患者的日常生活質量,而目前為止,最有效的治療方法只是人工關節置換術[8-9]。雖然OA為中老年人最常見關節疾病,但發病機制復雜,至今尚未明確。如今,骨關節炎的發病機制已成為越來越多學者的研究熱點[10]。探索骨關節炎的更加有效的治療方法也成為分子生物領域的重點。
miRNAs主要起調控基因表達的作用,在關節疾病的發生發展中有很重要的作用[11]。miR-146a已被發現在OA軟骨中早期高表達,晚期低表達,并且其表達減少是由白介素-1β導致[12]。miR-140亦被證明在OA軟骨中被白介素-1β調控而表達降低,從而引起異常基因的表達,且miR-140還參與骨關節炎軟骨損傷的修復及骨發育等過程,對軟骨及骨的修復和發育具有關鍵作用[13-14]。基于miRNAs在骨和軟骨中復雜的功能,miRNAs被認為是一種新型、高效能的調節OA中基因表達的方法[15]。
在miRNAs在骨和軟骨組織中的調控功能的研究中,miR-214已被發現是一種新型的調控成骨轉化的因子,抑制了小鼠成肌細胞的成骨分化功能[16];而在成骨細胞中,miR-214通過靶向調控轉錄激活因子的表達,抑制成骨細胞的活性及基質礦化過程,從而促進骨質疏松的發生發展[7]。然而在骨性關節炎的機制研究中,miR-214的功能尚未明確。
通過本實驗,作者證實了miR-214在OA軟骨及軟骨下骨中的異常表達,并且發現,在軟骨中miR-214的表達水平隨著OA嚴重程度的增加而逐漸升高,由此可見,miR-214可能參與OA進程中軟骨損傷的過程,通過調控軟骨相關退化基因而加速軟骨的退化。而在OA的發展過程中,軟骨和軟骨下骨可以構成復合單元,在結構和功能上相互影響[2,17-19]。日常活動中,關節受到過度力學負荷而引發骨重塑,由早期的骨質吸收到晚期的骨質增生,再到最終的晚期骨質硬化和骨贅形成,整個OA病程中都存在骨重塑。而miR-214在軟骨下骨中的異常表達,說明miR-214可能在骨重塑中起重要作用,而在K-L分級的Ⅲ級組中表達最高,證明隨著骨質吸收的增加,miR-214的表達水平逐漸升高,而晚期骨質增生、骨贅形成,miR-214表達下降,由此表明,miR-214可能通過調控成破骨細胞活性而調節骨重塑過程。
綜上所述,本實驗證實miR-214在OA的發病過程中有重要作用,在軟骨退變及軟骨下骨改變中可能調控重要基因的表達,參與軟骨退化及骨重塑。為下一步對miR-214在OA中的調控機制的研究提供理論基礎。通過后期深入研究miR-214在軟骨退變中的調控機制,結合其在骨中的調控功能,將為OA的臨床診斷和治療提供一種新型、有效的思路和方式。
1 Loeser RF, Goldring SR, Scanzello CR, et al. Osteoarthritis: a disease of the joint as an organ[J]. Arthritis Rheum, 2012, 64(6):1697-1707.
2 Burr DB, Gallant MA. Bone remodelling in osteoarthritis[J]. Nat Rev Rheumatol, 2012, 8(11):665-673.
3 Lu J, Getz G, Miska EA, et al. MicroRNA expression profiles classify human cancers[J]. Nature, 2005, 435(743): 834-838.
4 Kosaka N, Iguchi H, Ochiya T. Circulating microRNA in body fluid:a new potential biomarker for cancer diagnosis and prognosis[J].Cancer Sci, 2010, 101(10): 2087-2092.
5 Kobayashi T, Lu J, Cobb BS, et al. Dicer-dependent pathways regulate chondrocyte proliferation and differentiation[J]. Proc Natl Acad Sci U S A, 2008, 105(6): 1949-1954.
6 吳國棟,馬寧,高旭.MicroRNA——關節炎治療的新靶點[J].中國生物化學與分子生物學報,2012,28(10):888-891.
7 Wang X, Guo B, Li Q, et al. miR-214 targets ATF4 to inhibit bone formation[J]. Nat Med, 2013, 19(1): 93-100.
8 Berenbaum F. Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!)[J]. Osteoarthritis Cartilage, 2013, 21(1):16-21.
9 安曉,張琦,龔科,等.骨性關節炎與類風濕關節炎患者單側膝關節置換術后圍術期效果比較[J].解放軍醫學院學報,2014,35(10):1022-1024.
10 周博,朱劍,李坤鵬,等.超聲下關節炎患者膝關節積液分布特點[J].解放軍醫學院學報,2013,34(7):719-721.
11 Nakasa T, Nagata Y, Yamasaki K, et al. A mini-review: microRNA in arthritis[J]. Physiol Genomics, 2011, 43(10):566-570.
12 Yamasaki K, Nakasa T, Miyaki S, et al. Expression of MicroRNA-146a in osteoarthritis cartilage[J]. Arthritis Rheum, 2009, 60(4):1035-1041.
13 Miyaki S, Nakasa T, Otsuki S, et al. MicroRNA-140 is expressed in differentiated human articular chondrocytes and modulates interleukin-1 responses[J]. Arthritis Rheum, 2009, 60(9):2723-2730.
14 趙振國.miRNA-140在骨性關節炎中的研究進展[J].安徽醫藥,2012,16(8):1053-1055.
15 Miyaki S, Asahara H. Macro view of microRNA function in osteoarthritis[J]. Nat Rev Rheumatol, 2012, 8(9): 543-552.
16 Shi K, Lu J, Zhao Y, et al. MicroRNA-214 suppresses osteogenic differentiation of C2C12 myoblast cells by targeting Osterix[J].Bone, 2013, 55(2): 487-494.
17 袁雪凌,孟昊業,王永成,等.膝關節原發性骨關節炎軟骨-軟骨下骨復合單元改變的實驗研究[J].中國矯形外科雜志,2014,22(9):819-825.
18 王永成,孟昊業,袁雪凌,等.兔骨軟骨缺損自發性修復模型中軟骨下骨重塑與軟骨再生的關系[J] .中國修復重建外科雜志,2014,28(6):681-686.
19 Lories RJ, Luyten FP. The bone-cartilage unit in osteoarthritis[J].Nat Rev Rheumatol, 2011, 7(1): 43-49.

