膽汁淤積性肝病診斷和治療共識(2015)
中華醫學會肝病學分會
中華醫學會消化病學分會
中華醫學會感染病學分會
?
·指南共識·
膽汁淤積性肝病診斷和治療共識(2015)
中華醫學會肝病學分會
中華醫學會消化病學分會
中華醫學會感染病學分會
一、概述
膽汁淤積(cholestasis)是指肝內外各種原因造成膽汁形成、分泌和排泄障礙,膽汁流不能正常流入十二指腸而進入血液的病理狀態,臨床可表現為瘙癢、乏力、尿色加深和黃疸等,早期常無癥狀僅表現為血清堿性磷酸酶(alkaline phosphatase,ALP)和γ谷氨酰轉肽酶(gamma-glutamyl transferase,GGT)水平升高,病情進展后可出現高膽紅素血癥,嚴重者可導致肝衰竭甚至死亡[1]。各種原因使肝臟病變導致膽汁淤積為主要表現的肝膽疾病統稱膽汁淤積性肝病,膽汁淤積本身也會進一步加重肝臟的損害。膽汁淤積性肝病按發生部位可分為肝內膽汁淤積和肝外膽汁淤積。如膽汁淤積持續超過6月,則稱為慢性膽汁淤積[2]。本共識主要介紹肝內膽汁淤積性肝病。
為幫助我國臨床醫生規范診治膽汁淤積性肝病和開展相關科研工作,中華醫學會肝病學分會、中華醫學會消化病學分會和中華醫學會感染病學分會組織國內有關專家對當前所認識的膽汁淤積性肝病定義、發生機制、臨床表現、診斷標準和治療原則及相關疾病進行了較全面描述,并根據循證醫學原則提出了建議,形成了《膽汁淤積性肝病診斷和治療共識》隨著我國膽汁淤積性肝病臨床資料的不斷積累和完善,本共識將適時更新。
本共識采用推薦意見分級的評估、制定和評價(GRADE)系統對循證醫學證據的質量(見表1)和推薦意見的級別(見表2)進行評估[3]。在形成推薦意見時,不僅考慮到證據的質量,還要權衡干預的利弊與負擔、患者偏好和價值觀的可變性,以及資源的合理利用、推薦措施的公平性與可實施性等。

表1 GRADE 系統證據質量及其定義

表2 GRADE系統推薦強度等級
二、流行病學
膽汁淤積性肝病的發生率目前尚無確切的數據,主要是其診斷標準未能統一,以致結果不甚一致。1992年Bortolini等[4]對初次診斷慢性肝病患者膽汁淤積的流行情況進行了多中心調查,膽汁淤積的診斷標準為在排除機械性膽道梗阻及膽道手術史的情況下,血清總膽紅素> 18 μmol/L、直接膽紅素> 4 μmol/L及ALP > 2 μkat/L(kat是酶的國際活性單位)。結果顯示,在2 520例初次診斷慢性肝病患者中882例(35%)出現膽汁淤積。膽汁淤積更容易出現在原發性膽汁性肝硬化(primary biliary cirrhosis,PBC)/原發性硬化性膽管炎(primary biliary cholangitis,PBC)、原發性硬化性膽管炎(primary sclerosing cholangitis,PSC)中,并發現黃疸比瘙癢在伴有膽汁淤積患者中更常見。我國1 000例慢性病毒性肝炎患者膽汁淤積橫斷面研究顯示,56%慢性病毒性肝炎患者出院時,肝內膽汁淤積主要指標ALP或GGT仍然高于正常值上限,且這些指標異常的患者中肝纖維化和肝硬化的發生風險和病情嚴重程度顯著增加[5]。近期曹旬旬等[6]基于上海市住院慢性肝病患者膽汁淤積患病率的調查進行了研究,以ALP水平高于1.5倍正常值上限(ULN),且GGT水平高于3倍ULN為診斷標準,對4 660例住院慢性肝病患者膽汁淤積發生率情況進行研究,結果顯示膽汁淤積總發生率為10.26%,慢性肝病患者膽汁淤積發生率隨年齡增加有上升趨勢。在不同慢性肝病中,膽汁淤積發生率較高為PSC(75%)、各種原因肝硬化(47.76%)、PBC(42.86%),其他依次為肝腫瘤(35.97%)、自身免疫性肝炎(30.77%)、藥物性肝病(28.31%)、酒精性肝炎(16.46%)、病毒性肝炎(5.22%)和非酒精性脂肪性肝病(2.70%)。
三、病因和分類
引起膽汁淤積原因較多,常見病因主要有病毒、細菌、寄生蟲、藥物和/或毒物、自身免疫、酒精、結石、腫瘤和遺傳代謝等,任何能引起肝細胞和膽管細胞損害及膽道系統梗阻因素均可導致膽汁淤積發生。根據發生部位可分為肝內和肝外膽汁淤積兩大類。肝細胞功能障礙或毛細膽管、細膽管( <15 μm, 亦稱閏管或Hering管)及小葉間膽管(15~100 μm)病變或阻塞所致膽汁淤積稱肝內膽汁淤積[2,7,8];間隔膽管(>100 μm)、區域膽管(300~400 μm)、節段膽管(400~800 μm)、左右肝管、膽總管至壺腹部的病變或阻塞所致膽汁淤積稱肝外膽汁淤積[2,8]。大多數膽汁淤積性疾病是肝內膽汁淤積,而PSC可累及小和大肝內膽管和/或肝外膽管,因此部份患者可同時有肝內和肝外部分病變[2,8]。
1.肝內膽汁淤積:根據細胞學損害的部位可分為肝細胞性和膽管細胞性[2]:①肝細胞性膽汁淤積主要病因有敗血癥和毒血癥、病毒性肝炎、酒精或非酒精性脂肪性肝炎、藥物或胃腸外營養、遺傳性疾病[如良性復發性肝內膽汁淤積(benign recurrent intrahepatic cholestasis,BRIC)、進行性家族性肝內膽汁淤積(progressive familial intrahepatic cholestasis,PFIC)]、妊娠肝內膽汁淤積(intrahepatic cholestasis of pregnancy,ICP)、紅細胞生成性原卟啉癥、惡性浸潤性疾病(如造血系統的霍奇金病及轉移性腫瘤)、良性浸潤性疾病(如淀粉樣變性、肉芽腫性肝炎和肉芽腫病)、管壁發育異常(如先天性肝纖維化)、血管性疾病(如布加綜合征和靜脈閉塞性疾病)、肝硬化(各種原因)。②膽管細胞性膽汁淤積主要疾病和病因有PBC、PSC及合并自身免疫性肝炎重疊綜合征、特發性成人肝內膽管缺失癥、管壁發育異常(如膽汁性錯構瘤和卡羅利綜合征)、囊性纖維化、藥物性膽管病、移植物抗宿主病和繼發性硬化性膽管炎,后者包括各種膽石病、缺血性膽管病(遺傳性出血性毛細血管擴張癥,結節性多動脈炎和其他類型的脈管炎)、艾滋病和其他類型的免疫抑制相關的感染性膽管炎等。肝細胞和膽管細胞均有損害的稱混合性膽汁淤積。
2.肝外膽汁淤積:主要疾病和病因有PSC、膽管結石、先天性肝外膽管閉鎖、膽總管/Oddi括約肌狹窄、膽管寄生蟲病、膽總管囊腫、腫瘤性疾病(膽總管癌、肝細胞癌侵及膽管、壺腹部癌、膽總管旁淋巴結轉移壓迫)、胰腺疾病(胰腺癌、胰腺囊腫和慢性胰腺炎)等。
四、臨床表現和實驗室檢查
除引起膽汁淤積原發疾病相關臨床癥狀外,肝臟膽汁淤積本身可引起相關臨床癥狀,以及因膽汁淤積而致的繼發性改變。患者早期可無不適癥狀,可有乏力、納差、惡心、上腹不適等非特異癥狀,膽汁淤積相關的臨床表現主要有黃疸、皮膚瘙癢、疲勞、脂肪瀉、黃色瘤和骨質疏松等。
膽汁淤積引起的黃疸以直接膽紅素升高為主,肝細胞損害引起的黃疸因為同時有攝取、結合、排泄的障礙,因此直接和間接膽紅素均可升高,但一般直接膽紅素升高比間接膽紅素升高的幅度大。血清ALP和GGT升高是膽汁淤積最具有特征性早期表現,兩者升高提示出現膽汁淤積。肝臟中ALP和GGT均表達于肝細胞血竇側和毛細膽管側及膽管細胞微絨毛上,經膽汁排入膽道系統。當膽汁排泄不暢,毛細膽管內壓增高,可誘發ALP產生增多,加之膽汁酸憑借其表面活性作用,將ALP從脂質膜上溶析下來,使血清ALP明顯增高[1,9]。
ALP活性增高除見于肝內外膽汁淤積相關疾病外,妊娠、兒童生長期、骨骼疾病及部分腫瘤時也可出現ALP升高。GGT增高比其他血清酶出現得更早,持續時間更長,在肝臟酶中敏感性最高,但其特異性卻比較低。血清GGT對膽汁淤積診斷靈敏性和特異性可能不低于甚至優于ALP。在排除酗酒等其他肝損傷因素的情況下,若ALP和GGT同時升高,可確認存在肝細胞和膽管細胞損傷。若GGT升高而ALP不升高,幾乎也可判定存在肝毛細膽管和膽管上皮細胞損傷。若GGT不高而ALP升高,則應考慮骨病等可能。在ALP升高病例,如果不合并有GGT升高,常可排除肝源性疾病。需要注意的是在一些特殊膽汁淤積性肝病如PFIC 1和2型及BRIC等,GGT可不增高。
膽汁酸在肝內合成及分泌,其血清升高是膽汁淤積敏感和早期肝特異性指標。正常人肝臟合成的膽汁酸有膽酸(cholic acid,CA)、鵝去氧膽酸(chenodeoxycholic acid,CDCA)和代謝中產生的脫氧膽酸(deoxycholic acid,DCA),還有少量石膽酸(lithocholic acid,LCA)和微量熊去氧膽酸(ursodeoxycholic acid,UDCA),合稱總膽汁酸(total bile acid,TBA)。血清膽汁酸的定量測定可作為檢測膽汁淤積的一種靈敏、特異的方法。發生膽汁淤積時,膽汁分泌下降,并迅速改變膽汁酸貯存量的分布,使得血清和尿液中的膽汁酸濃度顯著升高。血清膽汁酸對于診斷膽汁分泌受損較血清膽紅素敏感,但是對于大多數的膽汁淤積不如ALP敏感,而且許多肝病如肝硬化、急慢性肝炎均可有膽汁酸升高。正常膽汁酸值在空腹時為1.0~6.0 μmol/L,餐后2小時為6.0~9.0 μmol/L。膽汁淤積時膽汁酸值超過10 μmol/L。膽汁酸值在10~20 μmol/L為輕度增高,20~40 μmol/L為中度增高,40 μmol/L以上為重度增高[1]。此外,甘膽酸(一種甘氨酸結合型膽汁酸)檢測已經進入臨床應用,動態觀察有益于臨床發現膽汁淤積,特別對于ICP的判斷具有重要臨床意義,但由于目前檢測方法學缺乏標準化致其臨床價值受限。膽汁酸及甘膽酸雖然均是反映膽汁淤積的敏感指標,但檢測方法學缺乏標準化加上干擾因素多特異性欠佳等因素是目前國內外相關指南中未將其列入并細化判斷標準的重要原因。ALT和AST在膽汁淤積時一般不升高,僅當膽汁淤積引起肝細胞損害時才會出現ALT和AST升高。可伴有血清膽固醇和磷脂、三酰甘油均升高,血清脂蛋白也有異常。檢測血清中自身抗體如抗核抗體(ANA)、抗平滑肌抗體(ASMA)、抗肝腎微粒體抗體(LKM)、抗肝細胞胞漿抗原1型抗體(LC-1)、抗線粒體抗體(AMA)、抗Sp100抗體、抗可溶性肝抗原抗體(SLA/LP)等可幫助進一步明確膽汁淤積的病因。
五、影像學和內鏡檢查
腹部超聲檢查通常是用來了解肝內外膽管是否阻塞擴張的第一步。腹部CT對于膽道梗阻性病變有著一定的價值。磁共振胰膽管造影(magnetic resonance cholangiopancreatography,MRCP)是顯示膽道系統安全而又準確的檢查,對膽道系統梗阻診斷準確性接近經內鏡逆行胰膽管造影(endoscopic retrograde cholangio-pancreatography,ERCP)。超聲內鏡(endoscopicultrasonography,EUS)在檢測膽道結石及引起肝外膽道梗阻的病變方面與MRCP相當。診斷及治療肝外膽道梗阻的金標準是ERCP,但其為創傷性檢查。即使是有經驗的操作者,仍有較高的并發癥如手術相關胰腺炎、出血和膽管炎等。因此,在考慮肝外膽道梗阻且尚不確定是否需要內鏡干預時,應該首先行MRCP或EUS,以避免不必要的ERCP。如經過上述檢查尚不能做出明確診斷時需要進行肝活檢病理學檢查以進一步明確診斷。
六、病理學
膽汁淤積時大體標本呈黃綠色,穿刺標本呈散在綠色斑點或通體深綠色。根據膽汁淤積的部位,組織病理學分為肝內膽汁淤積和肝外阻塞性膽汁淤積兩類[7,10]。肝內膽汁淤積的基本病理變化是膽汁從肝小葉第三區肝細胞開始,表現為肝細胞內膽汁淤積,肝細胞呈羽毛狀變性,伴毛細膽管擴張膽栓形成。嚴重時以擴張含膽栓的毛細膽管為中心,肝細胞呈腺泡樣排列,形成膽汁花環,這是肝內膽汁淤積的特征性病理變化。可見肝竇內增生肥大的庫弗細胞吞噬膽汁,門管區小葉間膽管膽汁淤積伴膽栓形成。電鏡觀察顯示毛細膽管微絨毛水腫、變短,直至消失。肝外阻塞性膽汁淤積組織病理學特征為門管區周邊肝內膽汁湖伴膽汁肉芽腫形成,長期肝外阻塞可引起肝內繼發性膽汁淤積。膽汁淤積的后期可引起門管區纖維化,甚至膽汁性肝硬化。
七、診斷和鑒別診斷
1.膽汁淤積性肝病診斷標準:目前有關膽汁淤積性肝病的診斷標準和具體的指標尚未統一,以ALP和GGT作為診斷指標尚有一些爭議。2009年歐洲肝病學會(EASL)膽汁淤積性肝病處理臨床實踐指南專家診斷工作組建議[2]“ALP超過正常上限1.5倍,且GGT超過正常上限3倍”診斷膽汁淤積性肝病。鑒于現狀以及利于國際交流,本共識仍推薦2009年EASL膽汁淤積性肝病處理臨床實踐指南診斷標準作為膽汁淤積診斷標準,即ALP超過正常上限1.5倍,且GGT超過正常上限3倍。但需注意在一些特殊膽汁淤積性肝病如PFIC 1和2型及BRIC等,GGT可不高。
2.診斷步驟:膽汁淤積性肝病診斷分三個步驟。首先是確定膽汁淤積是否存在,可通過血清學方法確定;接著影像學和內鏡確定是阻塞性還是非阻塞性;最后綜合分析得出診斷[包括病因、肝組織病理學、ERCP和經皮肝穿刺膽管造影(percutaneous transhepatic cholangiography,PTC)以及基因檢測等]。
仔細病史詢問及體格檢查對于診斷很重要,包括職業史、藥物使用史、飲酒史及家族史等。部分膽汁淤積性疾病僅見于某些特殊情況如妊娠、兒童、肝移植、人類免疫缺陷病毒感染。腹部超聲檢查可用來了解有無肝內、外膽管擴張。膽總管顯示擴張表現及其內徑超過8 mm以上高度提示肝外梗阻。MRCP是顯示膽道系統的安全方法,顯示膽道系統梗阻準確性接近ERCP。ERCP是顯示膽道及治療肝外膽道梗阻的金標準,即使有經驗的操作者,仍有較高的并發癥發生率(3%~5% 發生胰腺炎;當行括約肌切開術時,2% 合并出血,1% 合并膽管炎,0.4% 發生操作相關的死亡)[11]。因此,在考慮肝外膽道梗阻且尚不確定是否需要內鏡干預時,應該首先行MRCP或EUS,然后再考慮ERCP[12]。
當排除肝外梗阻后,進一步的檢查是檢測血清肝炎病毒標志物、肝病相關的自身抗體如AMA。在高滴度AMA(≥1/40)及ALP均很高并在缺乏其他解釋時可診斷為PBC。對于原因不清膽汁淤積性肝病患者,如果AMA陰性,下一步可行MRCP,必要時ERCP。如果診斷仍不明確,可行肝活組織檢查。在進行組織學評估時,應特別注意膽管病變;對于AMA陰性及肝活組織檢查未能確診的患者,有條件者可考慮基因檢測,如檢測ABCB4等基因。膽汁淤積性肝病診斷流程見圖1[2]。
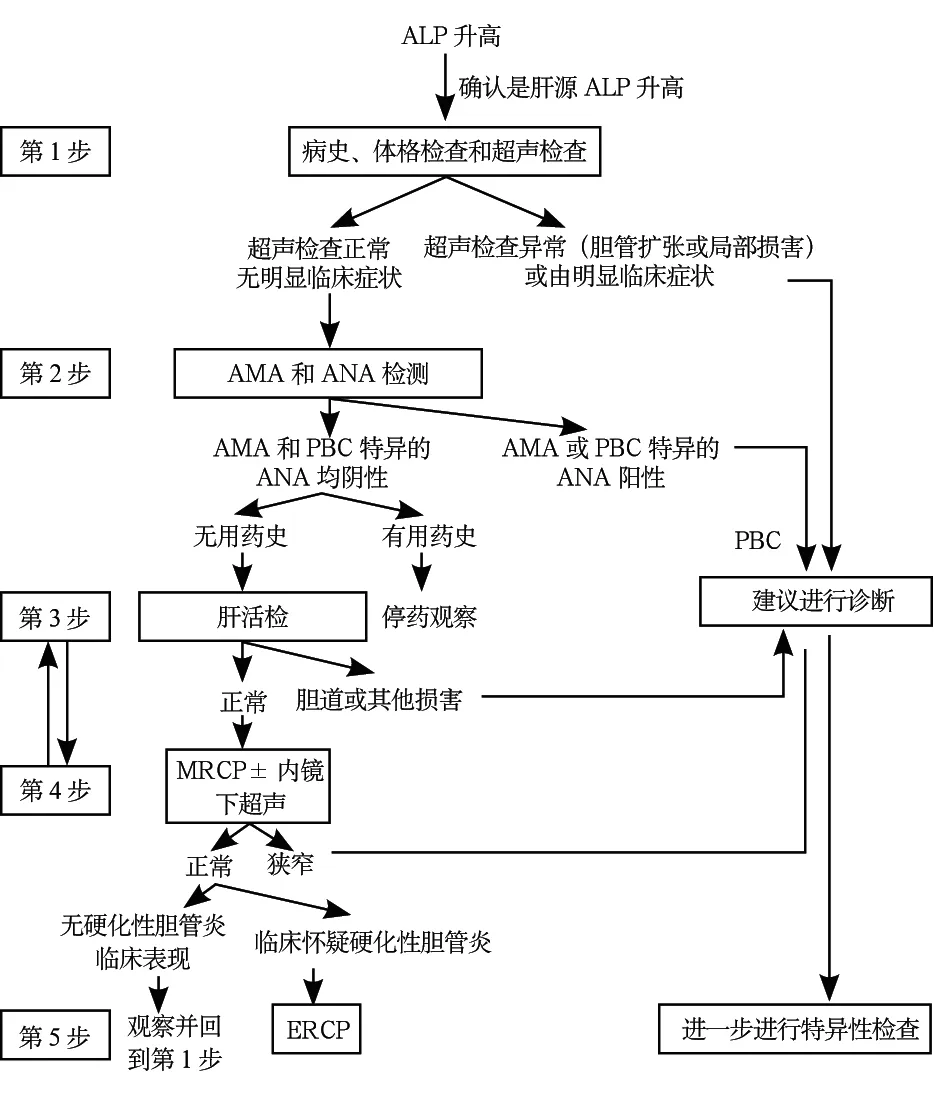
圖1 膽汁淤積性肝病診斷流程圖
3. 與黃疸區別和聯系:膽汁淤積和黃疸不完全等同,膽汁淤積包括膽紅素在內的全部膽汁成分淤積[1]。黃疸是血液膽紅素濃度增高,使鞏膜、皮膚等組織發生黃染的現象。有些疾病僅有膽紅素代謝障礙,而膽汁其他成分分泌和排泄正常,如遺傳性高膽紅素血癥(Gilbert綜合征、Crigler-Najjar綜合征、Dubin-Johnson綜合征和Rotor綜合征等)和溶血性疾病,這些患者僅有膽紅素升高,而ALP和GGT及膽汁酸并不升高。膽汁淤積早期,僅有ALP和GGT和膽汁酸升高,可不一定出現黃疸,通常只有當膽紅素超過34.2 μmol/L臨床上才顯現黃疸。因此黃疸者需排除遺傳性高膽紅素血癥和血液系統疾病。
推薦意見
1.肝臟生化檢查發現ALP超過正常上限1.5倍,且GGT超過正常上限3倍可診斷膽汁淤積性肝病(B1)。但在PFIC 1和2型及BRIC等,GGT可不高(B2)。
2.腹部超聲是區分肝內和肝外膽汁淤積首選影像學檢查方法,膽總管擴張且內徑超過8 mm以上提示肝外梗阻(C1)。當腹部超聲不能明確膽管擴張時,推薦行MRCP和/或超聲內鏡檢查,并檢測病毒性肝炎標志物和肝病相關自身抗體如AMA等(C1)。
3. MRCP或超聲內鏡不能明確診斷時可考慮進行ERCP(A1)。
4.對于無法解釋的肝內膽汁淤積且AMA陰性者應考慮肝活組織檢查(C1)。對于AMA陰性及肝活組織檢查未能確診患者,有條件者可考慮基因檢測(C1)。
5.膽汁淤積早期,僅有膽汁淤積相關酶學指標(ALP和GGT)和膽汁酸升高,可不出現黃疸。黃疸者需排除遺傳性高膽紅素血癥和血液系統疾病(B1)。
八、治療
(一)治療原則
治療原則是去除病因和對癥治療。最有效治療是病因治療,如手術或經內鏡取結石,手術切除腫瘤,對PBC和PSC可用UDCA,對藥物性和酒精性肝病及時停用有關藥和戒酒最為重要,乙型和丙型病毒性肝炎進行抗病毒治療,自身免疫性肝炎可用皮質激素取得緩解。
(二)藥物治療
藥物治療目的是改善由于膽汁淤積所致的臨床癥狀和肝臟損傷。主要的藥物有UDCA和S-腺苷蛋氨酸(S-adenosyl-L-methionine,SAMe)。UDCA可用于治療PBC、PSC、ICP、囊性纖維化、肝移植后淤膽、藥物性膽汁淤積、PFIC和Alagille綜合征等[2,13,14]。UDCA的一般劑量為10~15 mg·kg-1·d-1,Byler病和Alagille綜合征劑量可增至45 mg·kg-1·d-1,囊性肝纖維化劑量為20~25 mg·kg-1·d-1。SAMe可用于肝細胞性膽汁淤積、ICP和藥物性膽汁淤積。用法:初始治療,使用注射用SAMe,每日0.5~1.0 g,肌肉或靜脈注射,共2周。維持治療,使用SAMe片,每日1.0~2.0 g,口服[15,16]。有免疫機制介導的膽汁淤積者可考慮應用腎上腺糖皮質激素,凡擬應用者,需充分權衡治療收益和可能的不良反應。其他在研究且有前景的藥物有奧貝膽酸和非諾貝特類藥物[17,18]。
(三)其他治療
出現重度黃疸或嚴重瘙癢經積極內科治療無效時也可考慮應用非生物型人工肝方法治療,主要包括血漿置換(PE)、膽紅素吸附(PBA)、血漿濾過透析(PDF)和分子吸附再循環系統(MARS)等,這些治療方法需要有經驗的專科醫師操作指導,并且需患者及家屬知情同意;對于患者遠期生存的影響尚需進一步臨床研究。經藥物和上述治療方法無效且出現肝衰竭者可以考慮肝移植。有膽道狹窄或梗阻者可ERCP干預,如球囊擴張、內鏡下乳頭括約肌切開及支架置入。
推薦意見
6. UDCA和SAMe可用于治療多種肝病所致的膽汁淤積,治療劑量UDCA為10~15 mg·kg-1·d-1(A1)。SAMe初始治療使用注射用SAMe,每日0.5~1.0 g,肌肉或靜脈注射,共2周。維持治療,使用SAMe片,每日1.0~2.0 g(B1)。
7. 免疫機制介導的膽汁淤積需充分權衡治療收益和可能的不良反應,可試用腎上腺糖皮質激素(B1)。積極內科治療無效時也可考慮應用非生物型人工肝方法治療(C1),出現嚴重肝衰竭者可以考慮肝移植(A1)。
九、常見膽汁淤積性肝病診斷和治療
PBC、PSC、AIH和藥物性膽汁淤積見相關診治共識或指南,在此不再贅述。
(一) 病毒性肝炎合并膽汁淤積
1.診斷:各型病毒性肝炎均可引起膽汁淤積,可分為急性、慢性兩型。膽汁淤積型肝炎(或稱淤膽型肝炎)是病毒性肝炎的一個臨床類型,其臨床表現與肝外梗阻性黃疸相似,有些病例很難與之鑒別而造成誤診。該型肝炎起病時自覺癥狀常較輕,以戊型肝炎病毒感染多見,進而可有皮膚瘙癢和疲倦,常有明顯肝臟腫大,除了ALT、AST、GGT和ALP升高外,也可有膽紅素明顯升高,以結合膽紅素為主。慢性肝炎基礎上發生上述臨床表現者,可診斷為慢性淤膽型肝炎。急性淤膽型肝炎尚需與重型肝炎和妊娠急性脂肪肝進行鑒別。妊娠急性脂肪肝發生于妊娠晚期女性,尿膽紅素往往陰性,尿膽原陽性,超聲檢查為明顯脂肪肝,易與淤膽型肝炎區別。病毒性肝炎合并膽汁淤積者,若見“酶疸分離”現象,臨床上易誤為重型肝炎,但兩者的處理和轉歸各異。重型肝炎黃疸加深常與肝功能損害平行發展,消化道癥狀也較明顯,尤其是凝血酶原活動度進行性下降,可進行鑒別。診斷依據為病毒性肝炎血清標志物陽性,ALP和GGT升高,并排除其他原因所致者。
2.治療:首先強調病因治療,在此基礎上進行保肝、改善膽汁淤積治療。慢性乙型和丙型病毒性肝炎的治療關鍵是抗HBV和HCV,只要有適應證,且條件允許,就應進行規范的抗病毒治療[19,20]。抗HBV給予核苷(酸)類似物或干擾素治療,抗HCV給予干擾素聯合利巴韋林、直接抗病毒藥物(DAAs)蛋白酶抑制劑、聚合酶抑制劑等藥物治療。急性病毒性肝炎大多能自愈,無須特殊藥物治療。患者只需適當休息,平衡飲食。有些患者出現明顯肝功能異常甚至出現黃疸,可給予適當的藥物治療。膽汁淤積明顯者可選用UDCA和/或SAMe。
推薦意見
8.各型肝炎病毒感染均可引起膽汁淤積型肝炎,急性病毒性肝炎大多能自愈,無須特殊藥物治療。慢性乙型和丙型肝炎治療上首先選用抗HBV和HCV藥物,有膽汁淤積表現者可選用UDCA和/或SAMe(1B)。
(二)酒精性肝病合并膽汁淤積
1.診斷:酒精性肝病(alcoholic liver disease,ALD)是由長期大量飲酒導致的中毒性肝損傷,初期為酒精性脂肪肝,進而發展為酒精性肝炎、肝纖維化,最終導致肝硬化。各型酒精性肝病均可發生膽汁淤積。結合飲酒史(一般飲酒時間超過5年,乙醇攝入量男性≥40 g/d,女性≥20 g/d,或2周內有大量飲酒史,乙醇攝入量>80 g/d)、臨床表現、實驗室和影像學檢查常可明確酒精性肝病合并膽汁淤積的診斷[21]。肝組織活檢僅用于少數疑難病例,旨在探明病因、病變程度、判斷預后和指導治療。如果懷疑存在肝外膽道梗阻,則需進一步行MRCP、ERCP和(或)PTC等檢查。
2.治療:酒精性肝病的治療原則是戒酒和營養支持,減輕酒精性肝病的嚴重程度,改善已存在的繼發性營養不良和對癥治療酒精性肝硬化及其并發癥。戒酒是酒精性肝病最主要的治療措施,同時應重視營養支持治療。酒精性肝病中研究最廣泛的是激素使用,但要排除胰腺炎、消化道出血、腎衰竭或活動性感染患者。對于合并膽汁淤積的重癥病例,推薦使用腎上腺皮質激素治療,如果使用激素7 d內黃疸無消退,提示無應答,應停用激素,避免不良反應發生。美國肝病研究學會(AASLD)的酒精性肝病診療指南[22]中推薦的預后評估方法是Maddrey辨別函數(Maddrey discriminant function,MDF),MDF = 4.6×(患者凝血酶原時間-對照凝血酶原時間)+總膽紅素(mg/dl)。激素使用的閾值(MDF評分≥32定義為高風險病死率患者)可能存在一個最大限度,超過這個閾值,以減少炎癥級聯反應的內科治療可能弊大于利。當MDF評分>54的患者使用激素較非使用患者有更高的病死率。AASLD指南建議應用激素治療的劑量和療程40 mg/d,4周,后減量維持2~4周或停藥觀察。應用激素同時給予UDCA和/或SAMe治療。
推薦意見
9.酒精性肝病合并膽汁淤積提示預后不良,戒酒是酒精性肝病最主要的治療措施,同時應重視營養支持治療(B1)。合并膽汁淤積的重癥病例,如果MDF評分>32,且排除胃腸道出血、細菌感染等激素禁忌證,推薦使用腎上腺皮質激素治療,40 mg/d使用4周,然后減量維持2~4周或者停藥,并應用UDCA和/或SAMe(B1)。
(三)非酒精性脂肪性肝病合并膽汁淤積
1.診斷:非酒精性脂肪性肝病(nonalcoholic fatty liver diseases, NAFLD)可有臨床生化上的膽汁淤積表現以及組織學肝內膽管病變,但這不是NAFLD的特征性表現,更常見于一些繼發于特殊病因的NAFLD,如全胃腸外營養、藥物/毒物、丙型肝炎、空-回腸旁路減肥術后和肝豆狀核病變等[23]。膽汁淤積的出現與這些致病因素本身相關。NAFLD發展到肝硬化、肝功能衰竭等終末期肝病階段,或者是合并其他類型的肝病時也可有膽汁淤積表現。部分NAFLD在單純性脂肪肝和非酒精性脂肪性肝炎(NASH)階段也有血清GGT、ALP和總膽汁酸輕中度升高。伴有ALP和GGT顯著升高的NAFLD患者有肝組織學上肝細胞或膽管病變,NAFLD出現膽汁淤積可能提示肝損傷更嚴重。
2.治療:首先去除病因和誘因,治療原發基礎疾病或伴隨疾病,并改變生活方式,如節食、運動、禁酒、戒煙;發展至失代償期肝硬化和肝功能衰竭及其并發癥時肝移植可能是挽救生命唯一有效的治療選擇。伴有膽汁淤積者選用UDCA和/或SAMe。
推薦意見
10.首先去除病因和誘因,并以飲食、運動和行為糾正非藥物治療為主(C1)。同時根據患者的代謝紊亂特點進行個體化治療(包括改善胰島素抵抗、降血脂和減重等),可選用UDCA和/或SAMe(C1)。
(四)遺傳性膽汁淤積性肝病
1.囊性纖維化相關的肝病(cystic fibrosis-associated liver disease,CFALD):是一種常染色體隱性遺傳性疾病,第7染色體長臂上的跨膜轉導調節蛋白(CFTR)基因突變引起。表現為肝腫大、至少兩項肝功能實驗持續升高和超聲檢查異常,可伴有先天性膽汁淤積、肝脂肪變、局灶或多葉性肝硬化。CFALD并發癥是囊性纖維化相關死亡第二位最常見的原因[24]。(1)診斷:CFALD尚未有明確診斷標準。1/3患者有肝腫大,其可由CFALD或肺心病肝充血所致。ALP、ALT、AST、膽紅素和GGT持續異常超過1.5×ULN時應當進一步檢查以嚴格評估肝損害(凝血酶原時間、白蛋白)并排除其他原因的肝病(例如藥物、毒素、感染、膽道閉鎖、膽石癥、抗胰蛋白酶缺乏癥、自身免疫性肝炎、PSC或其他原因的膽道梗阻)。超聲檢查可發現CFALD的征象如肝腫大或膽道異常,肝臟內見數量及大小不一的無回聲占位病變。CT可顯示囊腫的大小及殘存多少正常肝組織。由于許多患者有局灶性纖維化、肝硬化的存在,肝活組織檢查意義不大[25]。(2)治療尚無證明對CFALD預后有益的治療藥物。推薦予以優化膽汁淤積患者的營養狀態以避免維生素缺乏和營養不良,但未被證明有效。予以20~30 mg·kg-1·d-1UDCA顯示可持續改善肝功能、刺激受損膽管膽汁的分泌、改善組織學指標(2年以上)和營養狀態[26,27]。該病患者一般壽命長,預后常取決于同時存在的腎囊腫病的嚴重程度,癌變極少。本病很少需要手術治療,有急性癥狀時可在超聲指導下穿刺抽液,但囊液可重新產生。當患者日常生活嚴重受限或者終末期患者可考慮肝移植[28]。
推薦意見
11.長期隨訪發現,CFALD可發生于1/3的囊性纖維化患者。肝腫大、肝功能異常及肝臟超聲檢出肝臟內見數量及大小不一的無回聲占位病變可診斷(C2)。未證實對CFALD有長期療效的治療方法(C2)。UDCA(20~30 mg·kg-1·d-1)可改善CFALD的肝功能和組織學指標(C1)。日常生活嚴重受限或者終末期患者考慮肝移植治療(B1)。
2.進行性家族性肝內膽汁淤積(PFIC):是一種以慢性膽汁淤積為特征的常染色體隱性遺傳疾病,毛細膽管轉運蛋白基因—ATP結合盒(ATP-binding cassette,ABC)轉運蛋白基因突變所致[29]。嬰兒期發病,通常在10年內進展至肝硬化[30]。(1)分類:PFIC包括3種類型,I型PFIC,既往稱作Byler病,主要是ATP8B1基因突變所致。肝病的典型癥狀和體征見于新生兒期。相較于血清轉氨酶、膽紅素和膽汁酸升高來說,其血清GGT較低(相較于膽道閉鎖和Alagille綜合征)。肝組織學提示纖維化但無膽管增生,大多數患者在12歲前進展至終末期肝病。腹瀉、胰腺炎、發育障礙和聽力缺失是ATP8B1基因突變的肝外表現。Ⅱ型PFIC既往稱作“Byler綜合征”,主要是ABCB11基因突變所致,ABCB11基因編碼膽汁酸鹽輸出泵蛋白(BSEP)。幼兒期臨床、生物化學和進展期肝病的癥狀類似于I型PFIC,低水平GGT。組織學檢查提示有門脈炎癥和巨細胞肝炎。電鏡檢查顯示PFIC1有粗顆粒膽汁而PFIC2有液狀膽汁。Ⅲ型PFIC由編碼毛細膽管磷脂轉運體-ABCB4-MDR3的ABCB4基因突變所引起,與PFIC1和PFIC2不同,PFIC3患者的GGT通常明顯升高,組織學檢查除發現門脈炎癥和纖維化/肝硬化外,尚有彌漫性膽管增生。PFIC3可伴發肝內膽石癥。(2)治療:無證據顯示有對PFIC長期預后有益的治療方法。對兒童患者,普遍推薦予以補充中鏈甘油三酯和脂溶性維生素。UDCA可改善50% PFIC3患者的生物化學指標,但對PFIC1和PFIC2不起作用[30]。利福平可緩解瘙癢。有報道部分膽道分流和回場曠置可改善PFIC1及PFIC2癥狀和體征[31]。對晚期PFIC,建議予肝移植治療。
推薦意見
12.1、2和3型PFIC均為少見的發生于幼兒和青少年期的慢性進展性膽汁淤積疾病。1型和2型PFIC以低GGT、嚴重瘙癢和各種肝外表現為特征。PFIC尚無有效的治療方法(C2)。UDCA可改善部分PFIC3患者的血清肝功能指標(C2)。部分膽汁分流對PFIC1和PFIC2的臨床和生化指標有益(C2)。晚期患者推薦予以肝移植(B1)。
3.良性復發性肝內膽汁淤積( BRIC):BRIC特征是反復發作的自限性嚴重瘙癢、膽汁淤積和黃疸,可持續數周至數月,常有數月或數年的無癥狀期。盡管每次BRIC發作可與嚴重的死亡率有關,但不會發生進行性肝損傷和肝硬化。肝組織學表現膽汁淤積伴膽管阻塞、匯管區擴張、單核細胞浸潤和某些肝細胞變性。緩解期肝組織學和肝功能正常。1型和2型BRIC為青少年和成人急性膽汁淤積性疾病,是PFIC1和PFIC2的良性表現形式,主要由ATP8B1和ABCB11基因的錯義突變引起[32]。BRIC1可伴有胰腺炎,而BRIC2可伴發膽石癥。BRIC的診斷標準[33]:①持續數月到數年的無癥狀間隔黃疸至少發作2次;②實驗室指標符合肝內膽汁淤積;③GGT正常或僅輕微升高;④繼發于膽汁淤積之后嚴重的瘙癢癥;⑤肝組織學證實小葉中心性膽汁淤積;⑥膽管造影術顯示肝內或肝外膽管正常;⑦沒有已知的其他導致膽汁淤積的因素(如藥物和妊娠等)。其關鍵要求是至少6個月的無癥狀間隔性多次黃疸發作,且無藥物或毒性物質接觸史或膽管疾病等誘因。因此BRIC與其他原因導致的慢性膽汁淤積和瘙癢的鑒別診斷相對直接明了。由于BRIC的病因不明,沒有預防和限制發作病程的特異性治療。治療的關鍵是緩解癥狀直到瘙癢和其他癥狀自然消退。膽汁淤積引發嚴重瘙癢的替代治療是酶誘導劑利福平,次選苯巴比妥。BRIC患者給予UDCA治療后增加了膽汁酸池,同時增加了UDCA在膽汁酸池中的比例,降低毒性疏水性膽汁酸在膽汁中的比例。治療PBC時,UDCA標準劑量是13~15 mg·kg-1·d-1,在治療其他膽汁淤積肝病時,甚至可用該劑量的2倍。治療BRIC的合適劑量尚不明。有些報道提示UDCA可改善BRIC患者的瘙癢癥狀,縮短發作病程,并預防再次發作。考慮到BRIC患者發作病程的變化和非癥狀間隔期,很難確定是UDCA還是其他治療方法有效。SAMe已被用于治療伴有妊娠、服用雌激素以及其他藥物所致的膽汁淤積,其作用機制還不明。遺憾的是,在一項單盲交叉研究中,BRIC患者靜脈注射SAMe并沒改善瘙癢癥狀也沒能減少生化指標異常[34]。有報道鼻膽管引流可緩解BRIC[35]。反復發作的BRIC有發展成PFIC可能。
推薦意見
13. BRIC特征是反復發作的自限性嚴重瘙癢、膽汁淤積和黃疸,可持續數周至數月,常有數月或數年的無癥狀期(C1)。尚無治療BRIC的有效方法,UDCA或鼻膽管引流治療尚處于試驗階段(C2)。
4. Alagille綜合征:Alagille綜合征主要發生于兒童及青少年,表現為輕重不等的膽汁淤積。臨床上表現為以膽汁淤積伴瘙癢和小葉間膽管減少及心血管系統、眼、骨骼、面部異常為特征的多系統損害,其他少見的臨床表現有腎損害、神經血管和胰腺的異常等。病因是JAG1或Notch2基因缺失,包括整基因缺失、蛋白截短、剪接和錯義突變。該基因編碼對細胞分化起重要作用的Notch信號通路的配體。病變缺陷可能位于第20號染色體短臂[36]。Alagille綜合征的診斷主要依據Alagille提出的標準[37],包括:①肝臟組織學檢查發現小葉間膽管減少;②在5大臨床特征(包括慢性膽汁淤積癥、心臟疾病、骨骼異常、眼睛異常和特征性的面部異常)中至少存在3項;其他系統表現少見,主要侵犯腎臟和神經血管系統。目前尚無有效的治療方法。有報道部分膽道分流可緩解其嚴重瘙癢[2]。
推薦意見
14. Alagille綜合征主要發生于兒童及青少年,由JAG1或Notch2基因缺失導致膽汁淤積伴瘙癢和小葉間膽管減少及心血管系統、眼、骨骼、面部異常為特征的多系統損害,尚無有效的治療方法,部分膽道分流可緩解其嚴重瘙癢(C2)。
(五)妊娠肝內膽汁淤積(ICP)
ICP的發病機理涉及多種因素,遺傳、激素和環境因素起到重要作用。患ICP后,經母體流向胎兒的膽汁酸增加,表現為膽汁酸在羊水、臍帶血和胎糞中升高。孿生妊娠時ICP發病率增高以及大劑量服用避孕藥和孕酮可誘發ICP支持激素在該病發生中起關鍵作用[38]。同一家族成員ICP發病率增加以及種族間的差異說明了遺傳因素的作用。最近遺傳學研究鑒定出毛細膽管轉運蛋白基因變異體[ATP-結合盒(ABC)轉運體B4 =磷脂酰膽堿轉移酶,ABC轉運體B11= 膽酸鹽輸出泵,ABC轉運體C2 =結合型有機離子轉運體,ATP8B1 = FIC1]和某些ICP患者調節物[膽酸鹽感受器法尼醇X受體(FXR)]。妊娠過程中,當激素和其他底物超過毛細膽管轉運體轉運能力時,毛細膽管轉運體輕度功能不全就能誘發膽汁淤積。目前,遺傳學檢測僅限于實驗研究,并不用于診斷或進行危險性分級。因此如產后膽汁淤積(伴有GGT水平升高)持續存在,可考慮進行ABCB4突變分析。
1.診斷:ICP是病因不明妊娠特發性可逆的膽汁淤積性疾病,出現于妊娠晚期,并在分娩后自發地迅速改善。其特征為:(1)妊娠期有嚴重瘙癢(多數起始于妊娠第二或第三階段);(2)血清ALT和空腹血清膽汁酸和甘膽酸升高;(3)產后(4~6周內)癥狀和體征自發緩解[38]。瘙癢導致孕婦不適和煩惱,ICP也增加早產和胎兒猝死風險。一般預后較好,但黃疸久者,因缺乏維生素K依賴性凝血因子Ⅱ、Ⅶ、Ⅹ,產時可發生大出血。本癥對胎兒影響較大,發生胎兒宮內窘迫、早產和死胎的危險性相對較高。膽汁酸是妊娠肝內膽汁淤積最敏感的指標,可先于其他血清肝功能試驗出現異常。確診ICP可根據臨床表現結合血清甘膽酸及總膽汁酸2個指標,血甘膽酸升高≥10.75 μmol/L或總膽汁酸升高≥10 μmol/L可診斷ICP[39]。妊娠期間膽汁酸水平≥40 μmol/L與胎兒并發癥增加相關。ABCB4變異的ICP患者GGT水平增高,否則GGT正常。10%~15%患者血清結合膽紅素中度升高出現輕度黃疸。ICP診斷要求排除其他疾病,包括皮膚疾病、肝膽系統疾病(肝炎病毒、EB病毒、巨細胞病毒和ABCB4缺陷癥等導致的肝損害,以及自身免疫性肝病),且通過產后訪視復查做出最后診斷。超聲檢查有助于排除其他嚴重肝病及肝膽系統結石,肝活檢通常是非必需的。
妊娠期血清肝功能試驗異常除ICP外,尚需考慮先兆子癇(HELLP綜合征)和妊娠急性脂肪肝[39]。HELLP綜合征(hemolysis,elevated liver enzymes and low plateletcount)以溶血、肝酶升高和血小板減少(常<50×109/L)為特點,是妊娠期高血壓疾病的嚴重并發癥,多數發生在產前,膽紅素多數<5 mg/dL(<85 μmol/L),影像學顯示肝壞死、血管瘤、肝破裂。妊娠急性脂肪肝是一種妊娠晚期的急性肝脂肪變,大多累及年輕初產婦,多在妊娠最后三個月內或產后早期發生,起病急驟,預后兇險,臨床表現如同急性重型肝炎,表現為急性肝功能衰竭,常伴有腎功能衰竭,影像學顯示肝臟脂肪變。產后出現持續性的異常應當考慮其他慢性肝病如PBC、PSC、ABCB4缺失的可能或慢性丙型肝炎。這些疾病可能在妊娠晚期出現瘙癢。
2.治療:對UDCA(10~2 mg·kg-1·d-1)進行隨機臨床試驗的結果表明其可作為治療ICP的一線藥物。UDCA可以改善67%~80% ICP患者的瘙癢和血清肝功能結果[40,41],但最近的實驗結果表明,由于胎兒并發癥的發病率低,應用UDCA和安慰劑治療的兩組患者,其并發癥降低的比率無差別。SAMe療效遜于UDCA,但可能有附加效果[15,16]。如果經數天UDCA標準治療后瘙癢無適當減輕,或可選擇SAMe或根據個體情況考慮使用利福平。局部搽劑是安全的,但效果不清楚。在藥物治療的同時,還需要注意產科情況。強調治療過程中加強胎兒監護,把握終止妊娠時機,對降低圍生兒死亡率具有重要意義。妊娠35周后,若出現病情進展、宮縮不能抑制、胎動異常、胎心率變異或應激試驗無反應、羊水胎糞污染等,應把握時機,積極終止妊娠[42,43]。
推薦意見
15. ICP診斷依據:(1)妊娠期瘙癢;(2)血清ALT水平以及空腹膽汁酸和甘膽酸水平升高;(3)除外其他原因的肝功能異常或瘙癢。產后肝功能完全正常后,可確診ICP(B2)。
16. ICP產婦自發性或醫源性早產率增加(B1)。UDCA和SAMe可用于妊娠第二或第三期有膽汁淤積且有癥狀的患者,可緩解瘙癢并能改善血清肝功能指標(B1),但缺乏有關胎兒保護和并發癥減少數據(C2)。凝血酶原時間延長時應補充維生素K(C2)。分娩時間應根據個體情況決定(C2)。
十、肝外表現及處理
(一)瘙癢
瘙癢是膽汁淤積的并發癥之一,是一種僅有皮膚不快感覺而無原發性皮膚損害的癥狀,這種感覺無論在性質、持續性及定位上均不同于觸覺和痛覺。膽汁淤積性瘙癢的發病機制尚不清楚[44],大多數的學者認為瘙癢可能與血清自分泌運動因子(autotaxin)活性增加和溶血磷脂酸形成有關。此外,膽汁酸鹽、內源性阿片肽、5-羥色胺、感覺神經元的過度興奮、雌激素和孕激素、肝腸瘙癢原改變、遺傳因素(如ICP)等也可能與瘙癢相關[45]。瘙癢的嚴重度評分有下列三種:(1)視覺模擬評分(visual analogue scale,VAS):瘙癢的嚴重性也可按皮膚抓痕分為:抓痕、斑塊、結節和/或疤痕,根據輕中重程度分別評分0~3(4)分,總分從0分無瘙癢到10分嚴重瘙癢[46]。(2)瘙癢嚴重程度量表(itch severity scale,ISS)包括頻率、睡眠、心情、性欲、性功能、李克特量表(Likert scale)評估瘙癢強度、瘙癢涉及的體表面積7項,總評分范圍可以從0分無瘙癢到21分即最嚴重的瘙癢[47]。(3)半定量評估瘙癢:根據瘙癢頻率分為4個階段:偶爾瘙癢、無臨床癥狀的每天間斷性瘙癢、出現臨床癥狀的每天間斷性瘙癢和持續性瘙癢[48]。
多個藥物可以單獨或者聯合應用治療膽汁淤積性肝病瘙癢,包括考來烯胺、抗組胺藥、孕烷X受體激動劑、阿片受體拮抗劑、5-HT受體拮抗劑,其具體治療仍無明確的理論基礎。考來烯胺(消膽胺)是一種具有降低血清膽固醇水平作用的不吸收陰離子交換樹脂,可減低膽汁酸腸肝循環,從而降低血清膽汁酸水平,減輕瘙癢。治療瘙癢推薦劑量是每日4 g,最大不超過16 g。考來烯胺有異味,并可引起消化道癥狀,如便秘、腹脹等,因而耐受性較差,長期用藥可加重脂肪瀉,致脂溶性維生素缺乏。UDCA和SAMe在治療膽汁淤積過程中對瘙癢癥狀也有改善作用。一項研究納入84例ICP瘙癢患者,隨機分組,分別使用UDCA、考來烯胺觀察病情改善情況。經過為期14 d的治療,UDCA治療瘙癢癥狀有效率達66.6%,遠遠超過考來烯胺有效率19.0%( < 0.05),且UDCA在瘙癢評分方面改善也遠遠超過考來烯胺[49]。對46例ICP患者分別給予UDCA、SAMe口服治療研究顯示,患者瘙癢評分均有不同程度的改善[16]。孕烷X受體激動劑利福平也可改善瘙癢,也可作為治療藥物[49,50]。利福平開始一般以150 mg/d單劑口服,有效后繼續服用。如無效,可隔周階梯增加劑量至600 mg/d。利福平可以改善繼發于PBC的膽汁淤積性瘙癢,其確切機制尚未闡明,但有研究表明,用利福平治療美沙酮(一種鎮痛藥)成癮患者時可引起阿片戒斷反應,因此利福平可能存在阿片拮抗作用,進而緩解膽汁淤積性瘙癢。值得注意的是,使用利福平后患者尿色變紅,還可出現中毒性腎損害、肝毒性,偶有溶血發生。同時,治療瘙癢劑量范圍內的利福平可有肝臟毒性,所以用藥期間必須隨訪肝功能。另外,利福平可通過干擾維生素D的吸收而加重骨質軟化;通過超敏反應引發膽汁淤積性肝炎,甚至發生膽汁淤積性瘙癢等并發癥。事實上,由于利福平潛在的副作用,對于其在膽汁淤積性肝病患者瘙癢治療上應慎用。口服阿片受體拮抗劑納曲酮25 mg/d可用于治療瘙癢,少數患者可有惡心、嘔吐、輕度疼痛等副作用。納曲酮有一定程度的肝臟毒性,使用時需監測肝功能。納曲酮的代謝產物可以在失代償性肝病患者體內積聚,因此這些患者使用此藥時需謹慎[50]。這類藥物應先小劑量使用,再逐漸提高劑量,以免引起類似麻醉藥的戒斷作用。如上述藥物均無效也可應用選擇性5-羥色胺再攝取抑制劑舍曲林治療,初始劑量一次50 mg/d,數周后增加至100 mg/d[51]。近年來,紫外照射、血漿置換和體外白蛋白透析、鼻膽管引流也用于改善膽汁淤積性瘙癢,并獲得較好的療效。肝移植可應用于藥物和其他方法療效不佳的患者。
推薦意見
17. 考來烯胺治療瘙癢的推薦劑量是每日4 g,最大劑量不超過16 g,與UDCA和其他藥物服用的間隔至少在4 h以上(B1)。
18. 口服阿片受體拮抗劑納曲酮治療瘙癢先小劑量口服25 mg/d,無效后再逐漸提高劑量至50 mg/d,以免引起類似麻醉藥的戒斷作用(C1)。選擇性5-羥色胺再攝取抑制劑舍曲林治療瘙癢初始劑量50 mg/d,數周后可增加至100 mg/d(C2)。
19. 利福平治療瘙癢開始一般以150 mg/d單劑口服,有效后繼續服用。如無效,可隔周階梯增加劑量至600 mg/d,用藥期間必須隨訪肝功能。由于利福平潛在的副作用,對于其在膽汁淤積性肝病患者瘙癢治療上應慎用(B2)。
20. 上述治療無效者可考慮選用紫外照射、血漿置換和體外白蛋白透析及鼻膽管引流等可改善膽汁淤積性瘙癢(C2)。藥物和其他方法療效不佳的患者可考慮肝移植(C2)。
(二)疲勞
膽汁淤積患者常常有疲勞癥狀,尤其是PBC。疲勞是一個復雜的癥狀,包括持續的衰竭感覺,正常工作能力缺失,心理和生理功能的下降。由于其是非特異性癥狀,且缺乏客觀的評估方法,所以直到現在仍然被大家所忽視。目前對疲勞的發病機制及其治療依舊不清楚[52]。當前尚無有效改善膽汁淤積性肝病患者疲勞癥狀的治療方法。需要注意的是治療前需排除患者的貧血、糖尿病、甲狀腺功能減退、腎和腎上腺功能不全及抑郁等表現。目前可能的治療方法和藥物有選擇性5-HT3受體拮抗劑如昂丹司瓊、阿片受體拮抗劑和中樞神經興奮藥莫達非尼等治療, 莫達非尼起始劑量100 mg根據患者耐受情況和對藥物的反應逐漸增加劑量到200 mg,但其療效有待進一步研究證實[53,54]。UDCA是PBC治療的有效藥物, 它可以延緩疾病的發展進程, 延長移植前的生存時間, 然而對伴隨的疲勞癥狀無明顯的改善作用。肝臟移植也不能降低疲勞的發生, 甚至在肝臟移植1年后, 疲勞仍是使患者痛苦的癥狀, 盡管疲勞程度減輕。避免刺激,提倡健康的生活方式, 包括足夠的睡眠、有規律的鍛煉、戒酒和戒咖啡等都有好處。抗抑郁藥可以部分減輕抑郁患者的疲勞。
推薦意見
21. 排除患者的貧血、糖尿病、甲狀腺功能減退、腎和腎上腺功能不全及抑郁等表現,足夠的睡眠、有規律的鍛煉、戒酒和晚上戒咖啡等對疲勞恢復有好處(C2)。
22. 選擇性5-HT 3受體拮抗劑如昂丹司瓊、阿片受體拮抗劑和中樞神經興奮藥莫達非尼(100~200 mg/d)等療效有待證實,抗抑郁藥可以部分減輕抑郁患者的疲勞(C2)。肝移植對疲勞改善無明顯作用(C1)。
(三)骨質疏松
骨質疏松以單位體積骨組織總量減少為特征,骨松質表現為骨小梁明顯減少、變薄,骨密質表現為骨皮質變簿、疏松。骨質疏松可引起骨折,尤易發生在椎體、髖骨和前臂。終末期肝病和重度膽汁淤積患者骨質疏松風險增加,發生率為9%~60%,可能與維生素D缺乏、營養不良等有關。骨質疏松治療包括健康的生活方式、補充鈣劑和維生素D以及藥物干預。堅持健康的生活方式包括攝人富含維生素D、鈣、低鹽和適量蛋白質的均衡膳食,避免嗜煙、酗酒,慎用影響骨代謝的藥物,進行適度的肌力鍛煉和康復治療。國外推薦劑量為元素鈣1 500 mg/d,維生素D800 IU/d。我國營養協會推薦成人每日鈣攝入量800 mg(元素鈣);絕經后婦女和老年人每日鈣攝入推薦量為1 000 mg。維生素D的成年人推薦劑量為200 IU/d;老年人因缺乏日照以及攝入和吸收障礙,故推薦劑量為 400~800 IU/d。維生素D用于治療骨質疏松時,劑量應該為800~1 200 IU/d。流行病學資料支持補鈣(1 000~1 200 mg/d)和增加維生素D(400~800 IU/d)攝入,這可減少或逆轉骨質自然丟失的速度,但無支持或反對的實驗證據。激素替代療法對絕經后的女性有效[55]。由于存在誘發肝細胞癌的風險,男性患者應避免使用睪酮。研究證據支持使用二膦酸鹽類如阿侖磷酸鈉(10 mg/d)治療骨質疏松[56],支持應用雷洛昔芬和氟化鈉數據有限[57]。骨礦密度測量可用于骨質疏松治療和隨訪[58]。
推薦意見
23. 建議患者補充鈣及維生素D預防骨質疏松。成人每日鈣攝入量800 mg;絕經后婦女和老年人每日鈣攝入推薦量為1 000 mg。維生素D的成年人推薦劑量為200 IU/d;老年人推薦劑量為400~800 IU/d(C1)。支持二膦酸鹽類如阿侖磷酸鈉(10 mg/d)治療骨質疏松,支持應用雷洛昔芬和氟化鈉數據有限(C2)。每年骨礦密度測量可用于骨質疏松治療和隨訪(C2)。
(四)脂溶性維生素缺乏
膽汁淤積時肝臟分泌膽汁到小腸障礙,腸內膽鹽減少,可出現脂溶性維生素缺乏和脂肪瀉,因此需要適當補充脂溶性維生素[2]。如凝血酶原時間延長,肌注維生素K(10 mg/d),直至正常。因維生素A所致的夜盲,口服維生素A 25 000~50 000 IU/d。維生素E缺乏少見,可口服予以補充。建議測定血液脂溶性維生素的水平以指導其補充的需要,但目前尚沒有得到普遍使用和推廣。
推薦意見
24. 凝血酶原時間延長,注射維生素K1(10 mg/d),直至正常。維生素A所致的夜盲,口服維生素A 25 000~50 000 IU/d。維生素E缺乏少見,可口服予以補充10~100 mg/d。維生素D補充 400~800 IU/d(C2)。
十一、待解決的問題
盡管近年來在膽汁淤積性肝病的診斷和治療方面有不少進展,但該領域仍面臨諸多問題和挑戰。有關膽汁淤積的發生機制尤其是其分子機制還有很多未闡明;膽汁酸轉運蛋白遺傳和變異對膽汁淤積性肝病發生和發展的影響;膽汁淤積中膽汁酸的成分及其對肝臟及全身的影響如何有待進一步研究;膽汁淤積性肝病診斷標志物及診斷標準需進一步完善和驗證;治療上尚需要更有效的藥物和方法等。
1 Kuntz K, Kuntz HD. Cholestasi[A]// Hepatology: principles and practice. 2nd edition. Springer Medizin Verlag Heidelberg, 2006:227-242.
2 European Association for the Study of the Liver. EASL clinical practice guidelines: management of cholestatic liver diseases. J Hepatol, 2009, 51: 237-267.
3 Guyatt GH, Oxman AD, Vist GE, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ, 2008, 336: 924-926.
4 Bortolini M, Almasio P, Bray G, et al. Multicentre survey of the prevalence of intrahepatic cholestasis in 2520 consecutive patients with newly diagnosed chronic liver disease. Drug Investigation, 1992, 4: 83-89.
5 Cheng J, Zhang WH, Wang JB, et al. A cross-sectional study on intrahepatic cholestasis indicators of viral hepatitis patients. 2015, EASL. P0592.
6 曹旬旬, 高月求, 張文宏, 等. 基于上海市住院慢性肝病患者膽汁淤積患病率的調查研究. 中華肝臟病雜志, 2015, 23: 569-573.
7 Burt A, Portmann B, Ferrell L. MacSween’s pathology of the liver. 6th edition. Elsevier Churchill Livingstone, 2012: 503-562.
8 Bacon BR, O’Grady JG, Di Bisceglie AM, et al. Comprehensive clinical hepatology. Second Edition. Elsevier, 2006: 87.
9 Siddique A, Kowdley KV. Approach to a patient with elevated serum alkaline phosphatase. Clin Liver Dis, 2012, 16: 199-229.
10 Geller S, Petovic LM. Evaluation of cholestasis//Biopsy interpretation of the liver. 2nd edition. Lippincott Williams & Wilkins, 2009: 404-416.
11 Freeman ML, Nelson DB, Sherman S, et al. Complications of endoscopic biliary sphincterotomy. N Engl J Med, 1996, 335: 909-918.
12 Heathcote EJ. Diagnosis and management of cholestatic liver disease. Clin Gastroenterol Hepatol, 2007, 5: 776-782.
13 Beuers U. Drug insight: mechanisms and sites of action of ursodeoxycholic acid in cholestasis. Nat Clin Pract Gastroenterol Hepatol, 2006, 3: 318-328.
14 Paumgartner G, Beuers U. Ursodeoxycholic acid in cholestatic liver disease: mechanisms of action and therapeutic use revisited. Hepatology, 2002, 36: 525-531.
15 Binder T, Salaj P, Zima T, et al. Randomized prospective comparative study of ursodeoxycholic acid and S-adenosyl-L-methionine in the treatment of intrahepatic cholestasis of pregnancy. J Perinat Med, 2006, 34: 383-391.
16 Roncaglia N, Locatelli A, Arreghini A, et al. A randomised controlled trial of ursodeoxycholic acid and S-adenosyl-l-methionine in the treatment of gestational cholestasis. BJOG, 2004, 111: 17-21.
17 Hirschfield GM, Mason A, Luketic V, et al. Efficacy of obeticholic acid in patients with primary biliary cirrhosis and inadequate response to ursodeoxycholic acid. Gastroenterology, 2015, 148: 751-761.e8.
18 Beuers U, Trauner M, Jansen P, et al. New paradigms in the treatment of hepatic cholestasis: from UDCA to FXR, PXR and beyond. J Hepatol, 2015, 62: S25-37.
19 中華醫學會肝病學分會, 中華醫學會感染病學分會. 慢性乙型肝炎防治指南(2010年版). 中華肝臟病雜志, 2011, 19: 13-24.
20 European Association for Study of Liver. EASL clinical practice guidelines: management of hepatitis C virus infection. J Hepatol, 2014, 60: 392-420.
21 中華醫學會肝病學分會脂肪肝和酒精性肝病學組. 酒精性肝病診療指南(2010年版). 中華肝臟病雜志, 2010, 18: 167-170.
22 O’Shea RS, Dasarathy S, McCullough AJ, et al. Practice parameters committee of the American College of Gastroenterology. Hepatology, 2010, 51: 307-328.
23 中華醫學會肝病學分會脂肪肝和酒精性肝病學組. 非酒精性脂肪性肝病診療指南(2010年版). 中華肝臟病雜志, 2010, 18: 163-166.
24 Colombo C, Battezzati PM, Crosignani A, et al. Liver disease in cystic fibrosis: A prospective study on incidence, risk factors, and outcome. Hepatology, 2002, 36: 1374-1382.
25 Sokol RJ, Durie PR. Recommendations for management of liver and biliary tract disease in cystic fibrosis. Cystic Fibrosis Foundation Hepatobiliary Disease Consensus Group. J Pediatr Gastroenterol Nutr, 1999, 28: S1-13.
26 Colombo C, Battezzati PM, Podda M, et al. Ursodeoxycholic acid for liver disease associated with cystic fibrosis: a double-blind multicenter trial. The Italian Group for the Study of Ursodeoxycholic Acid in Cystic Fibrosis. Hepatology, 1996, 23: 1484-1490.
27 van de Meeberg PC, Houwen RH, Sinaasappel M, et al. Low-dose versus high-dose ursodeoxycholic acid in cystic fibrosis-related cholestatic liver disease. Results of a randomized study with 1-year follow-up. Scand J Gastroenterol, 1997, 32: 369-373.
28 Swenson K, Seu P, Kinkhabwala M, et al. Liver transplantation for adult polycystic liver disease. Hepatology, 1998, 28: 412-415.
29 Jacquemin E. Progressive familial intrahepatic cholestasis. Clin Res Hepatol Gastroenterol, 2012, 36: S26-35.
30 Jacquemin E. Role of multidrug resistance 3 deficiency in pediatric and adult liver disease: one gene for three diseases. Semin Liver Dis, 2001, 21: 551-562.
31 Arnell H, Bergdahl S, Papadogiannakis N, et al. Preoperative observations and short-term outcome after partial external biliary diversion in 13 patients with progressive familial intrahepatic cholestasis. J Pediatr Surg, 2008, 43: 1312-1320.
32 Oude Elferink RP, Paulusma CC, Groen AK. Hepatocanalicular transport defects: pathophysiologic mechanisms of rare diseases. Gastroenterology, 2006, 130: 908-925.
33 Luketic VA, Shiffman ML. Benign recurrent intrahepatic cholestasis. Clin Liver Dis, 2004, 8: 133-149, vii.
34 Everson GT, Ahnen D, Harper PC, et al. Benign recurrent intrahepatic cholestasis: treatment with S-adenosylmethionine. Gastroenterology, 1989, 96(5 Pt 1): 1354-1357.
35 Stapelbroek JM, van Erpecum KJ, Klomp LW, et al. Nasobiliary drainage induces long-lasting remission in benign recurrent intrahepatic cholestasis. Hepatology, 2006, 43: 51-53.
36 Piccoli DA, Spinner NB. Alagille syndrome and the Jagged1 gene. Semin Liver Dis, 2001, 21: 525-534.
37 Alagille D. Alagille syndrome today. Clin Invest Med, 1996, 19: 325-330.
38 Lammert F, Marschall HU, Glantz A, et al. Intrahepatic cholestasis of pregnancy: molecular pathogenesis, diagnosis and management. J Hepatol, 2000, 33: 1012-1021.
39 Hay JE. Liver disease in pregnancy. Hepatology, 2008, 47: 1067-1076.
40 Palma J, Reyes H, Ribalta J, et al. Ursodeoxycholic acid in the treatment of cholestasis of pregnancy: a randomized, double-blind study controlled with placebo. J Hepatol, 1997, 27: 1022-1028.
41 Williamson C, Hems LM, Goulis DG, et al. Clinical outcome in a series of cases of obstetric cholestasis identified via a patient support group. BJOG, 2004, 111: 676-681.
42 Kenyon AP, Piercy CN, Girling J, et al. Obstetric cholestasis, outcome with active management: a series of 70 cases. BJOG, 2002, 109: 282-288.
43 Roncaglia N, Arreghini A, Locatelli A, et al. Obstetric cholestasis: outcome with active management. Eur J Obstet Gynecol Reprod Biol, 2002, 100: 167-170.
44 Kremer AE, Beuers U, Oude-Elferink RP, et al. Pathogenesis and treatment of pruritus in cholestasis. Drugs, 2008, 68: 2163-2182.
45 Bolier R, Oude Elferink RP, Beuers U. Advances in pathogenesis and treatment of pruritus. Clin Liver Dis, 2013,17: 319-329.
46 Kuiper EM, van Erpecum KJ, Beuers U, et al. The potent bile acid sequestrant colesevelam is not effective in cholestatic pruritus: results of a double-blind, randomized, placebo-controlled trial. Hepatology, 2010, 52: 1334-1340.
47 Krause K, Kessler B, Weller K, et al. German version of ItchyQoL: validation and initial clinical findings. Acta Derm Venereol, 2013, 93: 562-568.
48 Kondrackiene J, Beuers U, Kupcinskas L. Efficacy and safety of ursodeoxycholic acid versus cholestyramine in intrahepatic cholestasis of pregnancy. Gastroenterology, 2005, 129: 894-901.
49 Khurana S, Singh P. Rifampin is safe for treatment of pruritus due to chronic cholestasis: a meta-analysis of prospective randomized-controlled trials. Liver Int, 2006, 26: 943-948.
50 Tandon P, Rowe BH, Vandermeer B, et al. The efficacy and safety of bile Acid binding agents, opioid antagonists, or rifampin in the treatment of cholestasis-associated pruritus. Am J Gastroenterol, 2007, 102: 1528-1536.
51 Mayo MJ, Handem I, Saldana S, et al. Sertraline as a first-line treatment for cholestatic pruritus. Hepatology, 2007, 45: 666-674.
52 Jones DE. Fatigue in cholestatic liver disease: is it all in the mind. J Hepatol, 2007, 46: 992-994.
53 Abbas G, Jorgensen RA, Lindor KD. Fatigue in primary biliary cirrhosis. Nat Rev Gastroenterol Hepatol, 2010, 7: 313-319.
54 Jones DE, Newton JL. An open study of modafinil for the treatment of daytime somnolence and fatigue in primary biliary cirrhosis. Aliment Pharmacol Ther, 2007, 25: 471-476.
55 Boone RH, Cheung AM, Girlan LM, et al. Osteoporosis in primary biliary cirrhosis: a randomized trial of the efficacy and feasibility of estrogen/progestin. Dig Dis Sci, 2006, 51: 1103-1112.
57 Levy C, Harnois DM, Angulo P, et al. Raloxifene improves bone mass in osteopenic women with primary biliary cirrhosis: results of a pilot study. Liver Int, 2005, 25: 117-121.
58 Newton J, Francis R, Prince M, et al. Osteoporosis in primary biliary cirrhosis revisited. Gut, 2001, 49: 282-287.
(本文編輯:錢燕)
參加本共識撰寫和討論的專家人員名單
(排名不分先后,按姓氏漢語拼音為序)
陳成偉 成 軍 竇曉光 段鐘平 范建高 傅青春 高春芳 韓 濤 韓 英 侯金林 胡和平
胡錫琪 黃建榮 賈繼東 劉玉蘭 陸倫根 馬 雄 茅益民 南月敏 牛俊奇 邱德凱 任 紅
尚 佳 唐 紅 王貴強 王建設 王吉耀 王 磊 王宇明 魏 來 謝 青 謝渭芬 許建明
徐銘益 徐小元 楊長青 楊云生 尤 紅 曾民德 張文宏 張躍新 莊 輝 周新民 鄒曉平
陸倫根,200080 上海交通大學附屬第一人民醫院消化科,Email: lungenlu1965@163.com
2015-10-26)

