產纖溶酶海洋放線菌的篩選及初步鑒定
董 超,米 陽,原晉波,史延茂
(1.河北省科學院 生物研究所,河北 石家莊 050081;2.河北工業(yè)大學 化工學院,天津 300130)
血栓導致的心腦血管病一般表現(xiàn)為心梗和中風,現(xiàn)在臨床的治療方案以溶栓為主,溶栓藥物包括鏈激酶(streptokinase,SK)、尿激酶(urokinase,UK)、蚓激酶、葡激酶、組織型纖溶酶原激活劑(tissue-type plasminogen activator,t-PA)和瑞替普酶,還有目前研究較熱的納豆激酶等,它們在不同方面存在一定缺陷,如有免疫反應、對血液纖維蛋白專一性差、半衰期短或價格昂貴等[1]。納豆激酶雖然無上述缺點,但是由于出血傾向未有定論,目前還沒有藥品注冊登記[2]。尿激酶由于來源特殊,價格與成本差距較小,近年來已經逐步退出市場。蚓激酶和蛇毒溶栓酶來自動物,容易受養(yǎng)殖成本的影響。由于微生物發(fā)酵具有周期短、規(guī)模易擴大、提取工藝可控等優(yōu)點,所以微生物發(fā)酵生產臨床的纖溶酶逐漸成為主流。陸地微生物中一些產纖溶酶的菌株包括:枯草芽孢桿菌(納豆芽孢桿菌)、假單胞菌、鏈霉菌、根霉、曲霉和蛹蟲草真菌等[3-4]。
海洋蘊藏著豐富的微生物資源,絕大多數的海洋微生物還沒被人類認識和培養(yǎng)。由于海洋的高鹽、低溫、低營養(yǎng)等特殊環(huán)境,海洋微生物的代謝途徑與陸地微生物差異較大,可以產生特殊結構的次級代謝產物[5]。本研究采用加入抑制劑和誘導劑的篩選方法,從秦皇島海域和天津海濱的海水和海泥樣本中,獲得了分布特征差異較大的菌株,并且得到了一株產纖溶酶的鏈霉菌菌株,對該菌株進行了初步的鑒定。針對海洋微生物產物的多樣性和新型溶栓藥物的開發(fā)進行了探索。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品及化學試劑
牛纖維蛋白原:美國Sigma公司;凝血酶:石家莊市華瑞創(chuàng)新生物科技開發(fā)中心;注射用尿激酶:遼寧衛(wèi)星制藥廠有限責任公司;K2Cr2O7(分析純):天津市永大化學試劑有限公司;青霉素、桿菌肽:華北制藥集團股份有限公司;四環(huán)素:北京賽孚制藥股份有限公司;環(huán)丙沙星、慶大霉素:新鄉(xiāng)市常樂制藥責任有限公司。海水取自渤海灣,取樣參數見表1。海泥取自天津濱海新區(qū)海灣,取樣參數見表2。

表1 渤海灣海水樣本取樣參數Table 1 Seawater sampling parameters in Bohai Bay
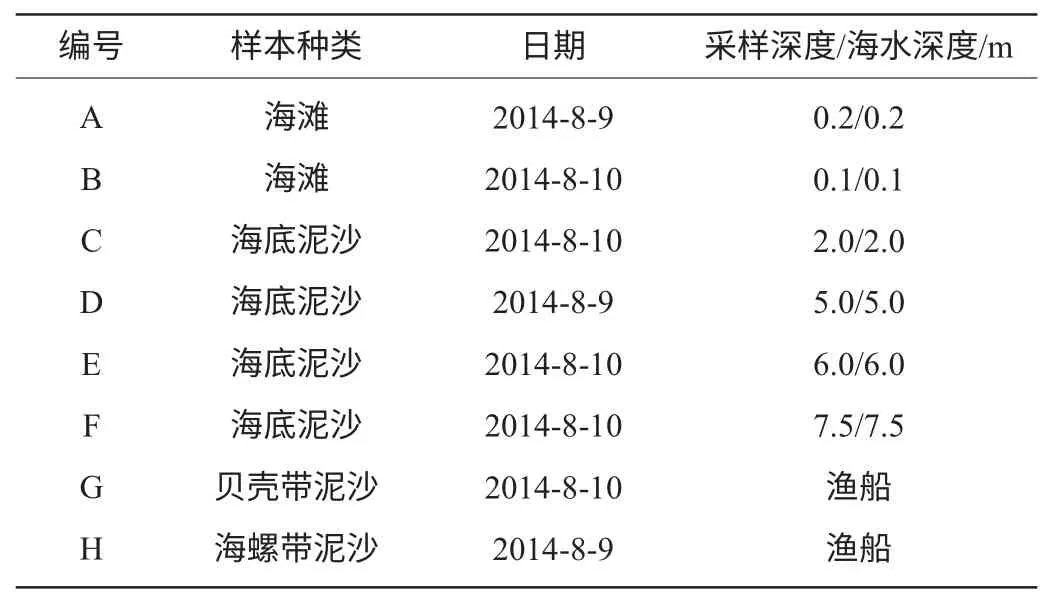
表2 天津濱海新區(qū)海灣海泥樣本取樣參數Table 2 Seamud sampling parameters in Tianjin Binhai New District Bay
1.1.2 培養(yǎng)基
Luria-Bertani(LB)海水培養(yǎng)基:蛋白胨10 g/L,酵母浸粉5 g/L,pH 7.0~7.2,用模擬海水配制,固體需要加瓊脂1.5%。
PB培養(yǎng)基:蛋白胨10 g/L,酵母膏5 g/L,NaCl 5 g/L,pH 7.0~7.2,固體需要加瓊脂1.5%。
高氏1號海水培養(yǎng)基:淀粉硝酸鹽培養(yǎng)基用模擬海水配制。
蛋白酶篩選培養(yǎng)基:LB固體培養(yǎng)基加入0.5%的滅菌奶粉。
纖溶酶篩選培養(yǎng)基:纖維蛋白原80 mg溶于75 mL 0.2 mol/L磷酸緩沖鹽溶液(phosphate buffered saline,PBS)中,凝血酶4 mg溶于5 mL同樣緩沖液中。將100 mL LB培養(yǎng)基化開,冷卻到50 ℃,先將纖維蛋白原溶液加入,攪拌,然后加入凝血酶,攪拌均勻。迅速倒平板,備用。
目標菌株的搖床培養(yǎng):海水LB培養(yǎng)液裝量50 mL/250 mL,培養(yǎng)溫度24 ℃,轉速150 r/min,培養(yǎng)3 d,得發(fā)酵液。
模擬海水配方:NaCl 26.73 g/L,MgCl22.26 g/L,MgSO43.24 g/L,CaCl21.15 g/L,NaHCO30.20 g/L,KCl 0.72 g/L,NaBr 0.06 g/L,H3BO30.05 g/L,LiNO30.0013 g/L。
1.2 儀器與設備
PW/10-002臺式保溫培養(yǎng)箱:重慶實驗設備廠;BX41顯微鏡:日本Olympus公司;SKY2102C搖床:上海蘇坤設備有限公司;MyCycler PCR儀:美國伯樂公司;DYCP-31C電泳儀:北京六一儀器廠。
1.3 試驗方法
1.3.1 海水和海泥樣本的保存
海水取樣每瓶200 mL,先冷藏,然后每瓶分裝到50 mL滅菌離心管,取一瓶進行實驗,其余液氮保存,以備重復或進一步篩查。
1.3.2 樣本的預處理
從不同瓶的海水樣本中分別吸取1 mL,每10個瓶取10 mL,合并混勻,備用;海泥樣本或動物帶泥沙分別稱質量約10 g混合,再與模擬海水以質量比1∶5混合,搖床振蕩30 min,備用。
1.3.3 樣本初篩
取海水樣本直接涂平板,取海泥樣本中加入0.1%吐溫-80,在25 ℃條件下培養(yǎng)。將各培養(yǎng)平板的菌株進行初步分類(外觀、鏡檢)。
1.3.4 抑制細菌和真菌的樣本篩選[6]
取海水、海泥樣本分別加入滅菌的K2Cr2O7溶液使質量濃度達到50 μg/mL、100 μg/mL、500 μg/mL、1 000 μg/mL、1 500 μg/mL、2 000 μg/mL、3 000 μg/mL,在25 ℃條件下振蕩8 h,涂平板,與1.3.3比較菌落數量的變化。
1.3.5 纖維蛋白的制備
在培養(yǎng)液中添加一定量的誘導底物,以利于目標菌株的篩選。纖維蛋白的制備方法采用抗凝血漿凍融法[7]。
1.3.6 纖溶酶酶活的測定方法
纖溶酶活性測定方法參照改進型瓊脂糖纖維蛋白平板法進行測定[8]。
1.3.7 產蛋白酶的菌株條件篩選
將800 μg/mL K2Cr2O7處理的海泥樣本涂布于蛋白酶篩選培養(yǎng)基,25 ℃條件下培養(yǎng)2~5 d,觀察菌落透明圈。
1.3.8 產纖溶酶的菌株初篩
將纖維蛋白原220 mg和凝血酶11 mg加入模擬海水中配制成500 mL,加入1.3.7處理樣本的上清液5 mL,在25 ℃條件下?lián)u床培養(yǎng)7~10 d,取0.1 mL涂布于纖溶酶篩選培養(yǎng)基的平板,觀察菌落透明圈。
1.3.9 產蛋白酶菌株復篩
將1.3.7篩選得到有透明圈的菌落分別劃線接種到纖溶酶篩選培養(yǎng)基中,觀察菌落透明圈。
1.3.10 產纖溶酶菌株的菌落特征
將復篩所得的產纖溶酶菌株接入LB培養(yǎng)液中,25 ℃、140 r/min,培養(yǎng)15~18 h;同時接入LB固體培養(yǎng)基內,25 ℃,培養(yǎng)1~5 d,鏡檢。分別在顯微鏡下觀察液體內菌絲和固體培養(yǎng)的菌株生長狀態(tài)。
1.3.11 菌株生理生化鑒定
參照《放線菌快速鑒定與系統(tǒng)分類》、《伯杰細菌鑒定手冊》鑒定方法進行生理生化鑒定。
1.3.12 菌株的16S rRNA鑒定
16S rRNA序列的測定由寶生物工程(大連)有限公司完成。將拼接好的序列于CNBI網站進行Blast對比得到相近菌株,根據同源性選取模式菌株通過MEGA 5.1用Neighbor-Joining法構建系統(tǒng)發(fā)育樹,Bootstrap檢測1 000次[9]。
1.3.13 目標菌株的抑菌實驗
MY0504的發(fā)酵液用0.45 μm濾膜過濾除菌,得到透明發(fā)酵濾液。采用3類菌株進行發(fā)酵濾液的抑菌試驗。致病菌:大腸桿菌、沙門氏菌、金黃色葡萄球菌;益生菌:納豆芽孢桿菌、酵母菌;霉菌:黃曲霉、木霉、黑曲霉。實驗方法按照牛津杯抑菌法[10]。
1.3.14 常用抗生素對目標菌株的抑制作用
將MY0504菌株的孢子用接種環(huán)挑取少部分在10 mL無菌水中稀釋,高速搖勻,備用。將100 mL PB培養(yǎng)基化開降溫到45 ℃左右,加入2 mL備用的孢子菌液,搖勻,鋪平板。配制青霉素、四環(huán)素、環(huán)丙沙星、慶大霉素、桿菌肽溶液,取10 μL點到上述平板上,24 ℃恒溫培養(yǎng)3 d,測定抑菌圈的大小。
2 結果與分析
2.1 樣本的直接涂布菌落特點
海水和海泥樣本的總體菌落分布和菌落特征如表3所示。海水的樣本直接涂布后,第2天可見芽孢類細菌,其生長速度快,菌落大,顏色分別是無色和棕紅色;第3天可見小的細菌菌落,菌落小而圓,透明,鏡檢為弧菌。再繼續(xù)培養(yǎng)到5~6 d,在細菌菌落外出現(xiàn)白色霉菌菌絲;未見到放線菌落。海泥的樣本菌落數在106稀釋涂布后,菌落以芽孢類細菌為主,可能由于稀釋倍數太高,所以沒發(fā)現(xiàn)其他細菌、霉菌和放線菌。
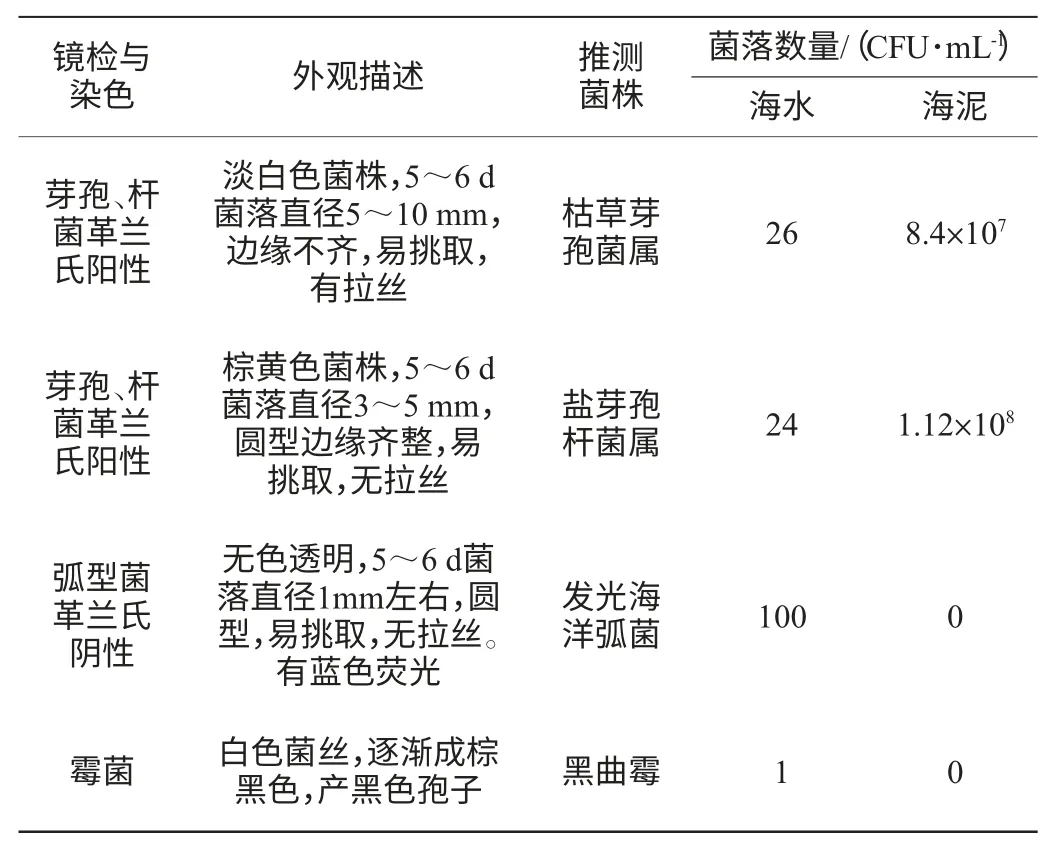
表3 海水和海泥樣本的直接涂布菌落分類情況Table 3 Colonies classification of seawater and seamud samples by direct spreading method
由表3可知,芽孢類細菌是海洋樣本中的主要菌群,這可能與采樣區(qū)域距海岸較近、并且水深在10多米左右有關,該菌群推測應該是陸地微生物的海洋水域延伸。霉菌由于對碳源挑剔,喜歡酸性環(huán)境,所以在海洋樣本中較少;放線菌類由于太少,在海水直接涂布情況下不能篩出。針對海洋微生物的篩選,首先要去除陸地微生物的延伸擴散影響,然后采取誘導或富集手段,才能得到目標微生物。海泥樣本的芽孢菌菌落數大約是海水的106~107倍。
2.2 海泥樣本加入抑制劑后的篩選結果
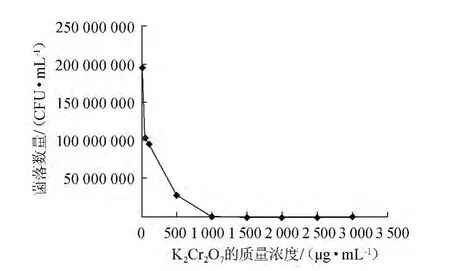
圖1 重鉻酸鉀對海泥菌落數量的抑制作用Fig.1 The suppression effect of potassium dichromate on the quantity of colony from sea mud
海泥樣本直接涂布數量太多,加入抑制劑K2Cr2O7后的菌落數量變化如圖1所示。由圖1可知,菌落數量隨著K2Cr2O7質量濃度增高,菌落數呈近似級數降低,在K2Cr2O7質量濃度500 μg/mL時菌落數量降至原來的25%左右。本實驗采取800 μg/mL K2Cr2O7的質量濃度來降低菌落數量,海泥樣本的菌落數可以降低到原來的5%左右。K2Cr2O7的抑菌效果與高氧化還原電位有關,文獻報道K2Cr2O7的含量達到2.5%時處理18 h,芽孢桿菌均可以被殺滅,但是對放線菌等的抑菌效果較小[11]。
2.3 產蛋白酶菌株的篩選結果
通過海泥樣本的蛋白酶平板篩選,發(fā)現(xiàn)3類菌株具有透明圈,通過鏡檢和外觀分辨,基本確定為表3中的兩種芽孢菌和弧形菌具有蛋白酶活性,結果見圖2。
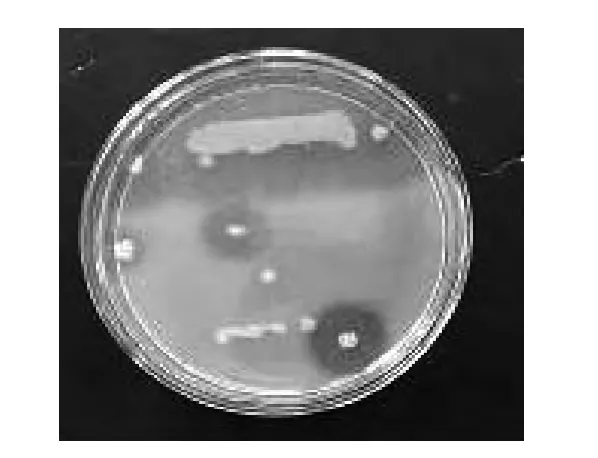
圖2 牛奶蛋白平板菌落的生長狀況Fig.2 The growth state of colonies in milk-protein plate
由圖2可知,將單菌落菌株在纖溶酶平板上劃線培養(yǎng),均沒有纖維蛋白溶解圈,這說明產蛋白酶的菌株均不能產纖溶酶。同時也從側面證明了酪蛋白篩選平板只能用作產蛋白酶菌株篩選,不能用于產纖溶酶菌株的篩選,而用纖維蛋白篩選平板比較合適。
2.4 產纖溶酶菌株的條件篩選
海泥樣本通過K2Cr2O7篩選后,芽孢桿菌數量大幅度減少,并在模擬海水的高鹽環(huán)境中長時間培養(yǎng)后,一些不耐高鹽環(huán)境的菌落被排除,這將有助于海洋菌株的篩選。纖維蛋白通常是相同二級結構的多肽鏈,不同動物之間的血纖肽可能氨基酸序列有差別,但是其支架結構的連接鍵大同小異,這也是纖溶酶的作用位點[12]。由于海水環(huán)境營養(yǎng)匱乏,采取加入纖維蛋白誘導物,可能會提高篩選得到分泌纖溶酶菌株的幾率。
結果顯示,在纖維平板培養(yǎng)4 d后長出了不同于先前菌落的似放線菌株,命名為MY0504,并且菌落邊緣有明顯的透明圈,結果見圖3(照片為培養(yǎng)平板的背部圖),上部為MY0504菌株的透明圈,下部棕紅色為棕紅色芽孢菌株,周邊無透明圈,說明不能產生纖溶酶。
目標菌株MY0504在LB培養(yǎng)基上生長旺盛,結果見圖4。該試驗證明采用添加抑制劑除去非目標菌株和附加纖維蛋白誘導目標菌株培養(yǎng)兩種方法相結合,從海泥樣本中可以篩選得到產纖溶酶的微生物菌株。目標菌株的篩選采用單一手段比較困難,一般都要采取兩種以上的附加方法,可以大大提高目標菌株的篩選幾率[13]。

圖3 纖維蛋白平板的菌落生長狀況Fig.3 The growth state of colonies in fibrin plate
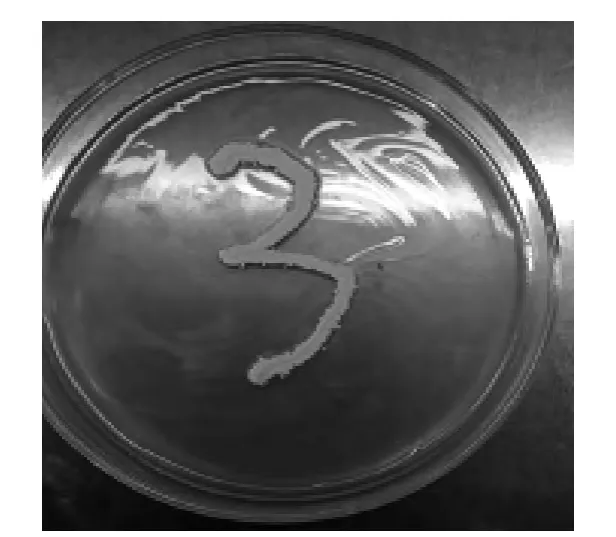
圖4 MY0504在LB培養(yǎng)基上的生長狀況Fig.4 The growth state of strain MY0504 in LB culture
2.5 生理生化實驗結果

表4 分離株MY0504的生理生化特性Table 4 Biochemical and physiological characteristics of isolated strain MY0504
通過系列實驗測定[14-15],該菌株培養(yǎng)條件為溫度15~40 ℃,pH 6~14,NaCl 1%~10%。其他生理生化指標見表4。由表4可知,該菌株基本不利用淀粉和纖維素等碳源,可以利用銨基做氮源,分解碳源的酶系較少,分解氮源的酶相對較多。
2.6 電鏡觀察
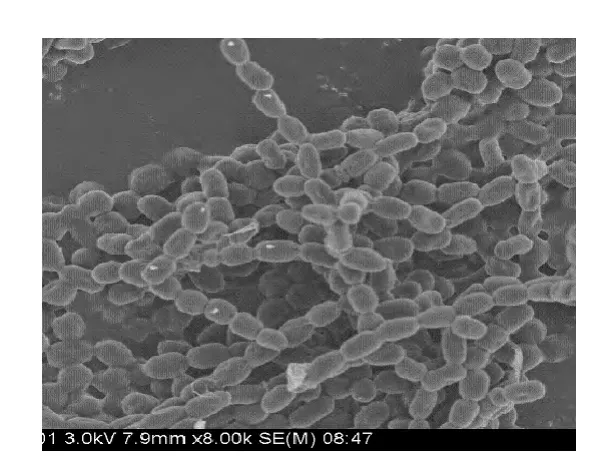
圖5 MY05054菌株孢子絲的電鏡圖Fig.5 Electron micrographs of strain MY0504 spores
目標菌株MY0504的孢子絲電鏡觀察結果如圖5所示。由圖5可知,目標菌株MY0504孢子表面光滑,無刺有褶皺;孢子絲無螺旋,但是有分支。由菌絲狀態(tài)可以確定該菌株不屬于諾卡氏菌屬、動孢菌屬、間孢囊菌屬和多形態(tài)放線菌屬,應該屬于鏈霉菌屬或北里孢菌屬[16]。
2.7 目標菌株的分子生物學鑒定
目標菌株MY0504的16S rDNA擴增結果電泳圖見圖6。由圖6可知,其基因序列包含1 406 bp。菌株菌株MY0504測序結果見圖7,序列在美國國家生物技術信息中心(national center of biotechnology information,NCBI)網站進行Blast,對比發(fā)現(xiàn)菌株MY0504與鏈霉菌屬(Streptomyces)菌株高度相關,認定該菌株屬于鏈霉菌屬(Streptomyces),該菌株與S.albusNBRC 13689、S.canescens、S.canescens1、S.coelicolor、S.albidoflavus、S.limosus有較近的親緣關系。
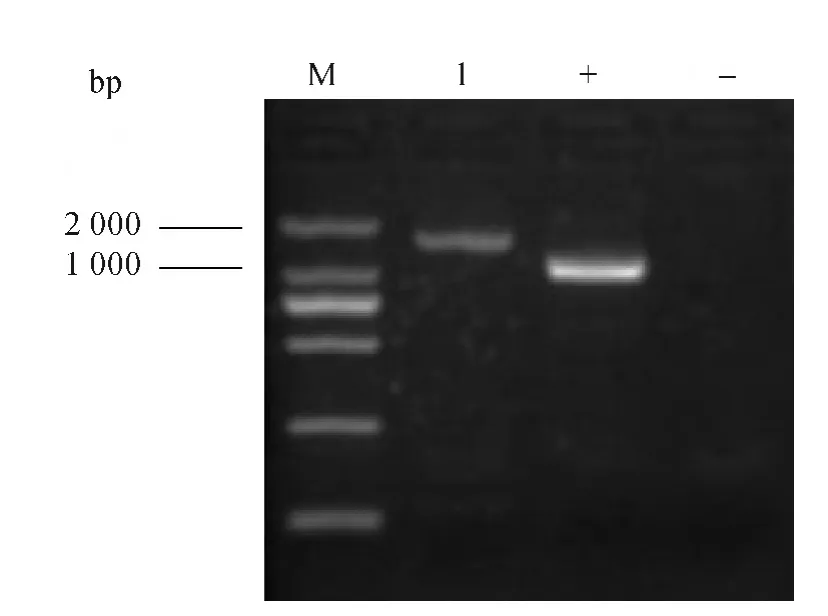
圖6 MY0504菌株PCR擴增結果Fig.6 PCR amplification results of strain MY0504
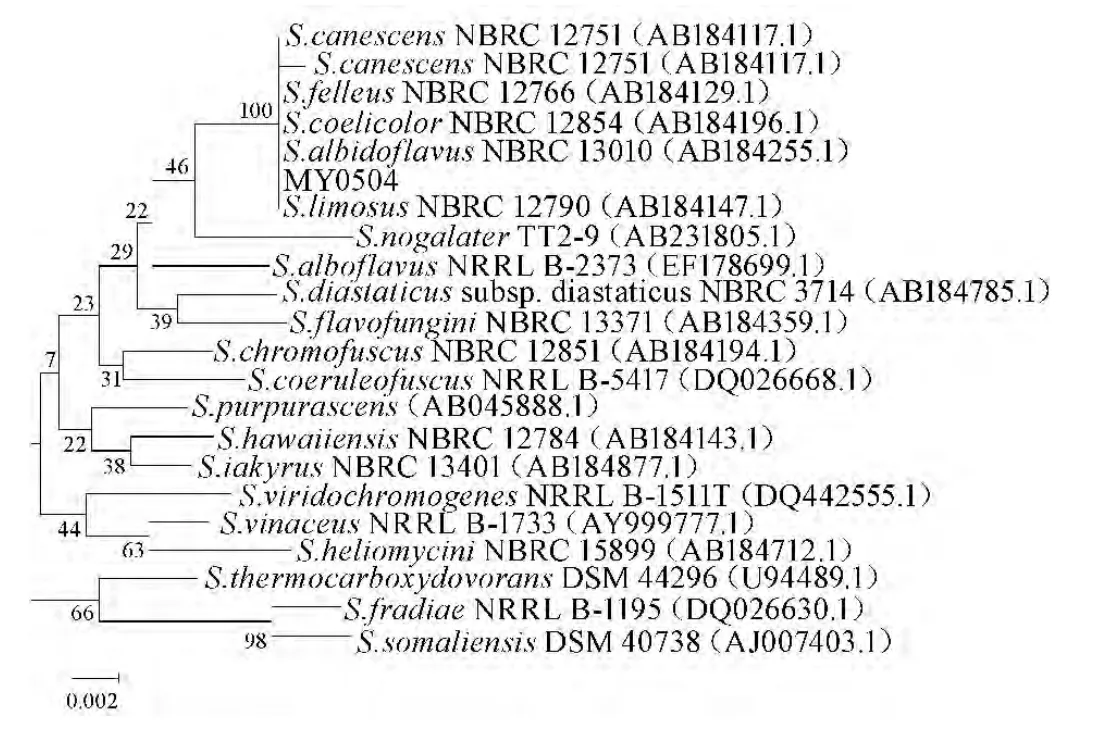
圖7 菌株16S rDNA 用NJ 法構建的系統(tǒng)進化樹Fig.7 Phylogenetic tree of 16S rDNA gene sequences from strain isolates using the Neighbor-Joining method
2.8 目標菌株的抑菌實驗結果
通過實驗發(fā)現(xiàn),3類菌都在牛津杯周圍正常生長,沒有任何抑菌圈出現(xiàn),說明MY0504基本不產抗生素。該菌株發(fā)酵產纖溶酶,如果發(fā)酵液中含有抗生素成分,會影響其藥物開發(fā)應用,所以該菌株不產抗生素成分利于菌株在纖溶酶方面的開發(fā)應用。
2.9 常用抗生素對目標菌株的抑制作用
抗生素周邊某一直徑的抑菌圈表示對藥物敏感,小于或沒有說明該菌株對抗生素有抗性。采用Kirby-Bauer的檢測方法,參照各抗生素的敏感直徑得出MY0504的敏感程度如表5所示。由表5可知,該菌株對這5種抗生素比較敏感,所以該菌株的實驗開發(fā)等是相對安全的,不會引起不可控制的感染等,這也利于該菌株的纖溶酶發(fā)酵應用。
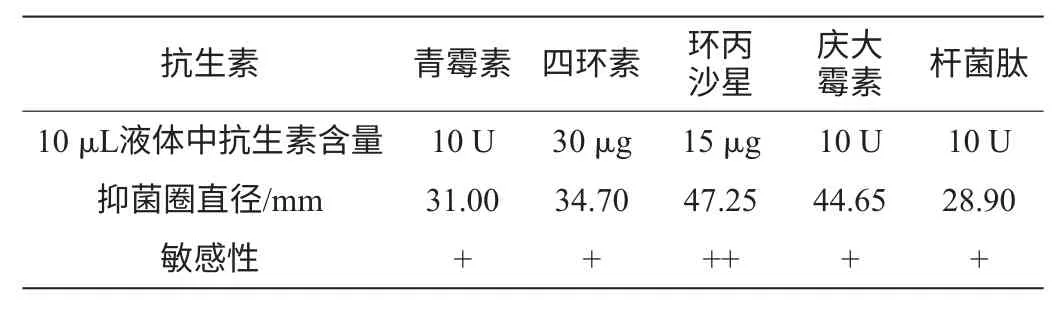
表5 菌株MY0504對常用抗生素的敏感程度Table 5 The sensitivity of strain MY0504 to general antibiotics
3 結論
本研究采用低營養(yǎng)、長時間的培養(yǎng),同時只提供纖維蛋白做為營養(yǎng)誘導物,篩選得到了產纖溶酶的鏈霉菌菌株MY0504。
通過16S rRNA鑒定、生理生化實驗和電鏡觀測,綜合鑒定MY0504屬于鏈霉菌屬(Streptomyces)菌株,該菌株與S.albusNBRC 13689、S.canescens、S.canescens1、S.coelicolor、S.albidoflavus、S.limosus有較近的親緣關系。
通過抗生素抑制法發(fā)現(xiàn),該菌株基本不產抗生素成分,同時對常用抗生素比較敏感,所以采用MY0504菌株開發(fā)纖溶酶是比較合適的。
[1]KUNAMNENI A,RAVURI B D,SAISHA V,et al.Urokinase-a very popular cardiovascular agent[J].Recent Pat Cardiovasc Drug Discov,2008,3(1):45-58.
[2]FUJITA M,NOMURA K,HONG K,et al.Purification and characterization of a strong fibrinolytic enzyme(nattokinase)in the vegetable cheese natto,a popular soybean fermented food in Japan[J].Biochem Bioph Res Co,1993,197(3):1340-1347.
[3]MITSUHIRO U,TOSHIHIRO K,KAZUTAKA M.Takumi nakamura purification and characterization of fibrinolytic alkaline protease fromFusariumsp.BLB[J].Appl Microbiol Biotechnol,2007,74(2):331-338.
[4]劉曉蘭,張雯舒,鄭喜群,等.蛹蟲草發(fā)酵產纖溶酶的分離純化[J].華南理工大學學報:自然科學版,2012,40(5):107-114.
[5]KNIGHT V,SANGLIER J J,DITULLIO D,et al.Diversifying microbial natural products for drug discovery[J].Appl Microbiol Biotechnol,2003,117(11):1-28.
[6]郭 亮,邢曉旭,鄭明學,等.重鉻酸鉀對細菌活性的影響[J].山東畜牧獸醫(yī),2009,30(3):4-7.
[7]李敏康,錢東明.凍融法提取豬血纖維蛋白原[J].分析實驗室,2007,26(4):65-68.
[8]楊 明,董 超,史延茂,等.纖維蛋白平板法測定納豆激酶方法的改進[J].中國釀造,2008,27(7):77-80.
[9]SAITOU N,NEI M.The neighbor-joining method:a new method for reconstructing phylogenetic trees[J].Mol Biol Evol,1987,249 (4):406-425.
[10]J.P.哈雷.圖解微生物實驗指南[M].北京:科學出版社,2012.
[11]陳菲菲,王 勇,王以光,等.海洋微生物來源的天然產物開發(fā)研究進展[J].應用與環(huán)境生物學報,2011,17(2):287-294.
[12]王鏡巖,朱圣庚,徐長法.生物化學[M].第三版.北京:高等教育出版社,2002.
[13]司美茹,薛泉宏,來航線.放線菌分離培養(yǎng)基篩選及雜菌抑制方法研究[J].微生物學通報,2004,31(2):61-65.
[14]東秀珠,蔡妙英.常見細菌系統(tǒng)鑒定手冊[M].北京:科學出版社,2001.
[15]S.A.瓦克斯曼.放線菌(第二卷,屬和種的分類、鑒定和描述)[M].北京:科學出版社,1974.
[16]阮繼生,黃 英.放線菌快速鑒定與系統(tǒng)分類[M].北京:科學出版社,2011.

