白蛋白發酵液大孔樹脂法脫色過程研究
李辰雨,戰偉超,單守水,林 劍,徐世艾*
(1.煙臺大學 化學化工學院,山東 煙臺 264005;2.煙臺大學 生命科學學院,山東 煙臺 264005)
人血清白蛋白(human serum albumin,HAS)是臨床應用較多的一種蛋白質,目前臨床使用的人血清白蛋白大多來自人類血漿[1]。80年代以來,人們通過基因工程技術使人血清白蛋白在細菌等宿主中得到表達[2-5],其中,畢赤酵母表達系統應用最廣,在白蛋白純化方面,目前多采用超濾法、離子交換法[6]等方法。由于分離純化過程中色素難以除去,為白蛋白分離純化增加難度,對于發酵液中色素除去的基礎理論方面的研究則鮮見報道。選用LS-305、LS-610B、SP-207、HP-20和DM-21五種大孔吸附樹脂,進行樹脂預選、靜態吸附試驗和動態吸附試驗。研究了發酵液中的色素在大孔樹脂上的靜態吸附動力學和動態吸附動力學行為,討論了發酵液中的色素在Langmuir方程和Freundlich方程擬合程度的熱力學過程,一階動力學模型、二階動力學模型和粒子內擴散模型對靜態吸附動力學過程的影響,及動態吸附過程的脫色率,并檢測整個吸附過程的蛋白質的損失率,為樹脂吸附法除去發酵液中的色素從而為從發酵液中分離純化白蛋白的工程應用提供依據。
1 材料與方法
1.1 材料與試劑
畢赤氏酵母(Pichia pastoris):山東大學;8萬u分子質量聚砜超濾膜:上海摩速科學器材有限公司;牛血清蛋白:北京索萊寶科技有限公司;LS-305樹脂、LS-610B樹脂:陜西藍深特種樹脂有限公司;SP-207、HP-20樹脂:日本三菱化學公司;DM-21樹脂:山東魯抗立科藥物化學有限公司;各樹脂的物理結構參數見表1。

表1 樹脂的物理結構參數Table 1 Physical structure parameters of resins
1.2 儀器與設備
YC-2層析實驗冷柜:北京博醫康實驗儀器有限公司;RO-NF-VF-40實驗室用膜分離設備:上海摩速科學器材有限公司;UV-5100紫外可見分光光度計:上海元析儀器有限公司;AR1530電子天平:奧豪斯儀器有限公司;SPH-2102B振蕩培養器:上海智械儀器制造有限公司;Anke TDL-5-4臺式離心機:上海安亭科學儀器廠。
1.3 實驗方法
1.3.1 發酵液的預處理
首先將發酵液離心處理20 min,轉速為5 000 r/min;然后將上清液超濾處理,將透過分子質量為8萬u膜的液體作為樹脂脫色的溶液。
1.3.2 樹脂的預處理
首先將樹脂用體積分數為95%的乙醇浸泡24 h,用去離子水洗幾次;然后將樹脂用1 mol/L氫氧化鈉浸泡5 h,用蒸餾水洗至中性;隨后將樹脂用1 mol/L鹽酸浸泡5 h;用蒸餾水洗至中性;最后用濾紙吸去樹脂表面的水,將這種處理的樹脂稱為濾紙片干(filter paper dried,FPD)樹脂。FPD樹脂經過80 ℃恒溫干燥12 h,樹脂質量恒定時稱為干樹脂。研究全部使用FPD樹脂的質量為基準,計算全部使用干樹脂的質量為基準。
1.3.3 發酵液中色素特征吸收波長的測定
首先將發酵液稀釋10倍,然后將稀釋后的發酵液在350~900 nm波長范圍內進行掃描,確定發酵液中色素的特征吸收波長λt。
1.3.4 蛋白質含量的測定
用考馬斯亮藍法作為蛋白質含量的測定方法。牛血清蛋白標準曲線的制備見參考文獻[7]。以牛血清蛋白質含量(x)為橫坐標,吸光度值(y)為縱坐標得標準曲線方程為:y=188.26x-1.647 3(R2=0.998 6),根據回歸方程計算樣品中蛋白質含量。
1.3.5 樹脂的預選
預先稱取5 種FPD 樹 脂LS-610B、LS-305、SP-207、HP-20、DM-21(5.35 g、5.45 g、4.85 g、4.35 g、4.27 g)(相當于1 g干樹脂)分別加入到具塞錐形瓶(300 mL)中,并加入初始濃度(以吸光度值計)相同(1.704)發酵液到錐形瓶中各100 mL,然后放入到振蕩培養器(20 ℃、220 r/min)進行吸附8 h,用紫外分光光度計測定發酵液中色素的吸光度值,并測定蛋白質的吸光度值(在595 nm波長條件下測定),評估其色素脫色率和蛋白質損失率。色素脫色率和蛋白質損失率計算公式如下:

式中:A0是發酵液脫色前的吸光度值;Aa發酵液脫色后的吸光度值。

式中:C0、C分別為脫色前后蛋白質含量,μg。
1.3.6 不同pH值對吸附性能的試驗
預先稱取2 種FPD 樹 脂LS-610B、LS-305(5.35 g、5.45 g),分別加入到具塞錐形瓶(300 mL)中,并加入100 mL不同pH值(2.0、4.0、6.0、8.0、10.0)初始濃度(0.276)相同的發酵液,然后放入到振蕩培養器(20 ℃、220 r/min)進行吸附8 h,用紫外分光光度計測定發酵液中色素的吸光度值,并測定蛋白質的吸光度值,評估其色素脫色率和蛋白質損失率。
1.3.7 靜態吸附等溫線試驗
預先稱取2 種FPD 樹 脂LS-610B、LS-305(5.35 g、5.54 g),分別取pH值為6.0不同初始濃度(0.732、1.303、1.643、1.911、2.201)的發酵液100 mL加入到具塞錐形瓶(300 mL)中。然后將錐形瓶放入到振蕩培養器(20 ℃、220 r/min)中,充分吸附8 h。用紫外分光光度法測吸光度值,并用以下公式計算色素吸附容量。

式中:qe是平衡時樹脂的吸附容量,△AV/g;C0是料液初始濃度(以吸光度值計);Ce是料液平衡濃度(以吸光度值計);V是料液的體積,mL;W是干樹脂質量,g。
1.3.8 靜態吸附動力學試驗
預先稱取2 種FPD 樹 脂LS-610B、LS-305(5.35 g、5.54 g),分別加入到具塞錐形瓶(300 mL)中,并加入pH值為6.0,初始濃度(1.704)相同發酵液各100 mL,然后將錐形瓶放入到振蕩培養器(20 ℃、220 r/min)中,在不同時間取樣,并用紫外分光光度法測定色素吸光度值,考馬斯亮藍法測定蛋白質含量,直至吸附平衡。樹脂吸附容量按以下公式計算:

式中:qt是時間t樹脂的吸附容量,△AV/g;C0是料液初始濃度(以吸光度值計);Ct是料液在時間t的濃度(以吸光度值計);V是料液的體積,mL;W是干樹脂質量,g。
1.3.9 動態吸附試驗
根據靜態試驗,樹脂LS-610B被選擇進行動態試驗。動態吸附試驗按以下方法:
預處理好的大孔樹脂被裝入到玻璃柱(20 cm×1.6 cm)中,為20 mL,然后用去離子水以3倍柱床體積(bed volumn,BV)洗脫大孔樹脂。然后上樣pH為6.0,用紫外分光光度計檢測發酵液色素吸光度值和蛋白質含量。
2 結果與分析
2.1 最大吸收波長的確定
發酵液中色素在350~900 nm 波長范圍內的掃描結果如圖1所示,圖1表明發酵液在波長380 nm處有特征吸收,故將波長380 nm作為測定發酵液中色素的吸光度的最佳波長。
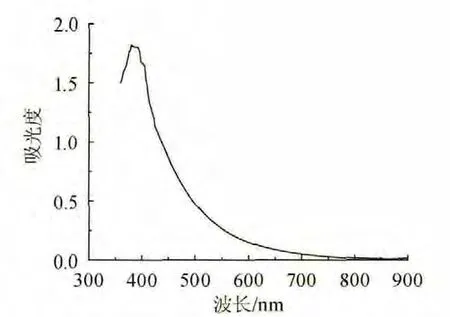
圖1 發酵液中色素紫外可見光吸收曲線Fig.1 UV absorption curve of pigment in the fermentation broth
2.2 樹脂的預選
5種FPD樹脂LS-610B、LS-305、SP-207、HP-20、DM-21吸附量及蛋白質損失率結果見表2。

表2 不同樹脂的吸附性質Table 2 Adsorption properties of different resins
由表2可以看出,LS-610B樹脂與LS-305樹脂吸附容量相對高于另外3種樹脂,且蛋白損失率相對較低,故選取LS-610B和LS-305作為發酵液靜態吸附脫色樹脂。
2.3 不同pH值對吸附性能的影響
不同pH值下LS-610B和LS-305樹脂的吸附容量與蛋白質損失率,結果見表3。由表3可知,2種樹脂pH 6.0時較其他pH值時,色素吸附效果好,蛋白損失率較低。故以LS-610B和LS-305樹脂脫色時,發酵液pH 6.0為宜。
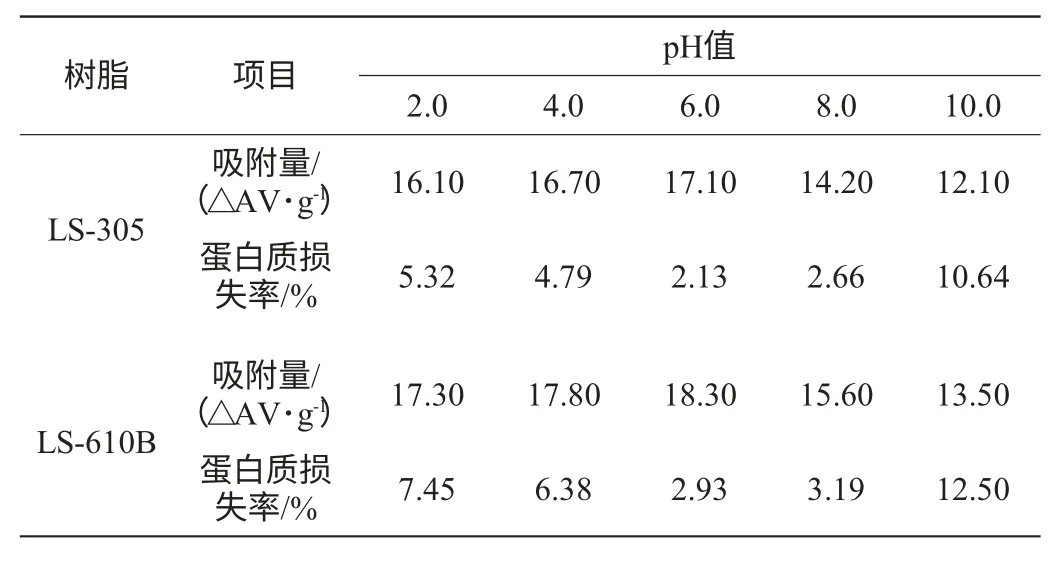
表3 不同pH值的大孔樹脂吸附參數Table 3 Adsorption parameters of macroporous resins with different pH
2.4 靜態吸附等溫線
兩種普遍的理論模型(Langmuir模型和Freundlich模型)被用來比較大孔樹脂的等溫吸附[8]。
Langmuir方程:

Freundlich模型:
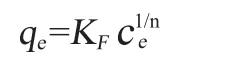
式中:qe是平衡吸附量,△AV/g;qmax是最大吸附容量,△AV/g;ce是平衡時發酵液中色素濃度(以吸光度值計);KL是Langmuir常數;KF和n 是Freundlich常數。
圖2表示兩種樹脂在20 ℃下發酵液中色素靜態吸附等溫線,Langmuir模型中的KL和qmax通過ce/qe和ce的線性關系擬合得到。Freundlich模型中的KF和n通過log(qe)和log(ce)的線性擬合得到。實驗數據的統計處理及相關系數R2的值見表4。
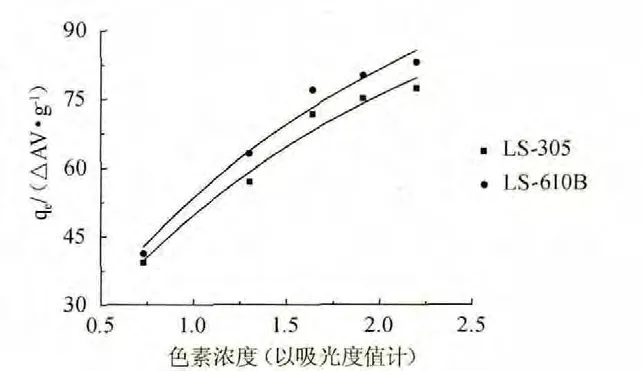
圖2 兩種樹脂在20℃下對發酵液中色素的靜態吸附等溫線Fig.2 Static adsorption isotherms of pigment in the fermentation broth by two kinds of resins at 20℃
由表4可知,比較相關系數R2,實驗數據較好符合Langmuir模型,比較最大吸附容量qmax(Langmuir模型)LS610B>LS305,原因可能是LS610B的比表面積大于LS305的比表面積。所以兩種樹脂的吸附等溫線更符合Langmuir模型,LS610B的最大吸附量計算值為123.00△AV/g。

表4 在20℃下Langmuir和Freundlich吸附等溫方程參數Table 4 The parameters of adsorption isothermal equation from Freundlich and Langmuir at 20℃
2.5 靜態吸附動力學性質
LS305和LS610B兩種樹脂在20 ℃下吸附容量(qt)隨時間(t)的變化趨勢,結果見圖3。由圖3可以看出,在8 h之內LS305和LS610B兩種樹脂達到吸附平衡。LS610B吸附容量比LS305的吸附容量高10△AV/g左右,LS610B在吸附過程中蛋白質的損失率比LS305吸附過程中蛋白質的損失率高0.5%左右。

圖3 兩種樹脂在20℃下對發酵液中色素的吸附動力學曲線及蛋白質損失率Fig.3 Kinetic curves of the pigment in the fermentation broth and the protein loss rate by two kinds of resins at 20℃
吸附容量與時間的數據按照一階動力學模型[9]、二階動力學模型[10]和顆粒內擴散模型[11]進行處理。
一階動力學模型:
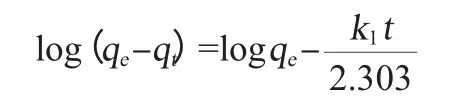
動力學參數計算結果見表5。由表5可知,從二階動力學模型中的相關系數(R2)略高于一階動力學模型中的相關系數(R2),而且二階動力學模型qe的計算值比一階動力學模型的計算值更接近與實驗數據值。結果表明,發酵液中的色素在這兩種樹脂中的吸附動力學更好的符合二階動力學模型,相似的結果已經被其他作者所報道[12-14]。
按照二階動力學模型的速率常數k2,兩種樹脂的吸附速率大小為:LS610B>LS305。
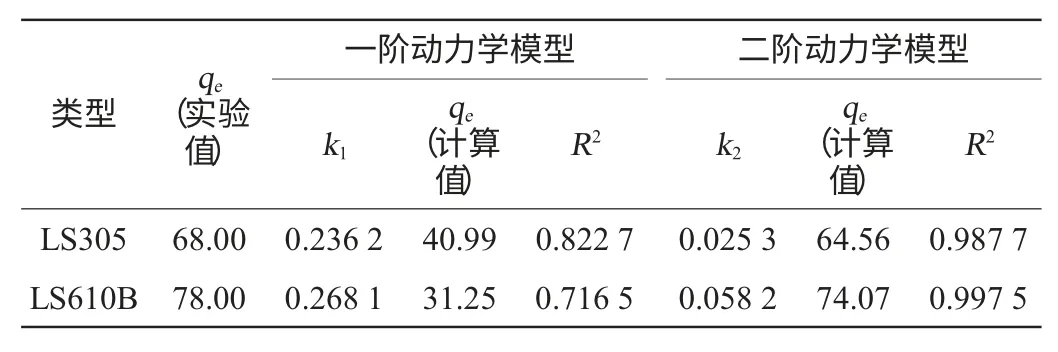
表5 在20℃下兩種樹脂動力學參數Table 5 Kinetic parameters from two resins at 20℃
一階動力學模型和二階動力學模型主要考慮粒子外膜擴散,內部擴散和吸附過程的相互作用。雖然粒子擴散動力學模型不能代表整個吸附過程,但可用來解釋一定的吸附原理,且在吸附過程中會造成一定量的蛋白質損失,但損失率相對較低,故選取LS-610B作為發酵液動態吸附脫色樹脂。
將吸附容量qt與時間t1/2進行擬合,結果見圖4。由圖4可知,顆粒內擴散是吸附速率的控制步驟,因為這條線如果經過原點,且為直線,說明該過程是單一的顆粒擴散速控步驟。由圖4可知,顆粒擴散圖形不經過原點,也不是直線,證明該過程不是唯一的顆粒擴散速控步驟,液膜擴散也在一定程度上影響吸附過程。吸附過程包括兩個階段,第一階段(0~2.5 h)屬于逐漸吸附階段,顆粒擴散速率很小;第二階段(2.5~8.0 h)被認為是最終的平衡吸附階段。因此,顆粒擴散與液膜擴散交互影響色素在LS305和LS610B樹脂上的吸附[15-16]。
二階動力學模型:
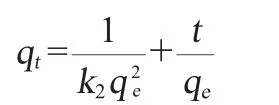
顆粒擴散動力學模型:
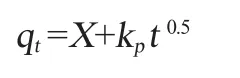
式中:qe和qt分別是平衡時的吸附容量和時間t的吸附容量,△AV/g;k1是一階動力學模型的速率常數,h-1;k2是二階動力學模型的速率常數,g/(△AV·h);kp是顆粒內擴散速率常數,△AV/(g·h1/2);X是常數。

圖4 兩種樹脂吸附發酵液中色素的顆粒擴散模型Fig.4 Particle diffusion model for adsorption of pigment in fermentation broth by two resins
2.6 動態吸附試驗
由圖5可以看出,4 BV/h的流速脫色率(進料10 BV時約為68%)小于2 BV/h的脫色率(進料10 BV時約為81.5%),原因可能是吸附物質沒有足夠的時間與發酵液中色素進行相互作用[17]。兩種流速的蛋白質損失率相對較低(進料4 BV時蛋白質損失率約為1%)。故LS-610B可以用于發酵液分離白蛋白的脫色預處理。

圖5 不同流速的脫色率及蛋白質損失率Fig.5 Decolourization ratio and protein loss rate at different flow rates
3 結論
通過預選5種大孔樹脂LS-305、LS-610B、SP-207、HP-20和DM-21,得到大孔樹脂LS305和LS610B吸附容量較大且蛋白損失率較低。又在不同pH值下對大孔樹脂LS305和LS610B進行靜態吸附試驗,得出發酵液在pH=6.0下脫色為宜。靜態吸附等溫線試驗表明,試驗數據在Langmuir 吸附等溫線模型有較高的相關系數,靜態吸附試驗表明,試驗數據在二階動力學模型有較高的相關系數。顆粒內擴散模型能較好的描述發酵液中色素在這兩種樹脂上的吸附動力學,說明顆粒內擴散不是唯一的控制步驟,吸附速率還受液膜擴散的影響。最后對大孔樹脂LS610B進行動態吸附試驗,試驗表明,在上柱液pH值為6.0,流速2 BV/h,進料體積10 BV條件下,發酵液脫色率約81.5%,蛋白質損失率約3%。因此,大孔樹脂LS610B可以用于白蛋白發酵液脫色處理。
[1]VERMEULEN J N,MEIJER D K,OVER J,et al.A phase I/IIa study with succinylated human serum albumin (Suc-HSA),a candidate HIV-1fusion inhibitor[J].Antivir Ther,2007,12(2):273-278.
[2]LAWN R M,ADELMAN J,BOCK S C,et al.The sequence of human serum albumin cDNA and its expression inE.coli[J].Nucleic Acids Res,1981,22(9):6103-6114.
[3]QUIRK A V,GEISOW M J,WOODROW J R,et al.Production of recombinant human serum albumin fromSaccharomyces cerevisiae[J].Biotechnol Appl Biochem,1989,11(3):273-287.
[4]張必武,鄔小兵,樂國偉,等.人血清白蛋白基因工程研究進展[J].生物技術,2002,12(1):28-29.
[5]楊 喆,劉紅巖,馬 波,等.重組人血清白蛋白在漢遜酵母中的高密度發酵表達[J].云南大學學報:自然科學版,2007,29(S1):446-450.
[6]朱家文,武 斌,陳 葵,等.離子交換層析分離純化重組人血清白蛋白[J].華東理工大學報:自然科學版,2002,28(4):341-345.
[7]馮 昕,王吉中,堯俊英,等.考馬斯亮藍法測定乳與乳制品中蛋白質含量[J].糧食與食品工業,2010,17(3):57-59.
[8]DI M A,ARENA E,FALLICO B,et al.Recovery of anthocyanins from pulp wash of pigmented oranges by concentration on resins[J].J Agr Food Chem,2002,50(21):5968-5974.
[9]CHANG X L,WANG D,CHEN B Y,et al.Adsorption and desorption properties of macroporous resins for anthocyanins from the calyx extract of roselle (Hibiscus sabdariffaL.)[J].J Agr Food Chem,2012,60(9):2368-2376.
[10]HO Y S,MCKAY G.Pseudo-second order model for sorption processes[J].Process Biochem,1999,34(5):451-465.
[11]GUIBAL E,MILOT C,TOBIN J M.Metal-anion sorption by chitosan beads:equilibrium and kinetic studies[J].Ind Eng Chem Res,1998,37(4):1454-1463.
[12]ZHOU C C,YAN J,CAO Z N,et al.Postcrosslinking of macroporous styrene-divinylbenzene copolymers via pendant vinyl groups:Effect of the starting copolymers on the pore structure of the postcrosslinked products[J].J Appl Poly Sci,2002,83(8):1668-1677.
[13]LIN L,ZHAO H,DONG Y,et al.Macroporous resin purification behavior of phenolics and rosmarinic acid fromRabdosia serra(Maxim.)hara leaf[J].Food Chem,2012,130(2):417-424.
[14]WAWRZKIEWICZ M,HUBICKI Z.Equilibrium and kinetic studies on the sorption of acidic dye by macroporous anion exchanger[J].Chem Eng J,2010,157(1):29-34.
[15]LORENC-GRABOWSKA E,GRYGLEWICZ G.Adsorption of lignitederived humic acids on coal-based mesoporous activated carbons[J].J Colloid Interface Sci,2005,284(2):416-423.
[16]胡洋葉,王玉蓉,韓振蘊.大孔樹脂吸附知母總皂苷的動力學與熱力學研究[J].中醫藥信息,2011,28(5):36-39.
[17]MA C Y,TAO G J,TANG J,et al.Preparative separation and purification of rosavin inRhodiola roseaby macroporous adsorption resins[J].Sep Purif Technol,2009,69(1):22-28.

