鐮刀菌Fusariumsp sp.JN 158色素的鑒定及其抗腫瘤活性
鄭里翔, 蔡宇杰, 徐敏娟, 李昌偉,王巧鳳, 王 月, 孟憲明, 廖祥儒*
(1.江南大學 工業生物技術教育部重點實驗室,江蘇 無錫 214122;2.江西中醫藥大學 基礎醫學院,江西 南昌330004)
鐮刀菌Fusariumsp sp.JN 158色素的鑒定及其抗腫瘤活性
鄭里翔1,2, 蔡宇杰1, 徐敏娟2, 李昌偉1,王巧鳳2, 王 月2, 孟憲明2, 廖祥儒*1
(1.江南大學 工業生物技術教育部重點實驗室,江蘇 無錫 214122;2.江西中醫藥大學 基礎醫學院,江西 南昌330004)
通過對鐮刀菌發酵所產色素的分離及結構的分析,篩選其抗腫瘤的活性成分。采用形態與分子生物學方法對鐮刀菌株鑒定,利用HPLC的對該菌株發酵所產的色素進行分離,分離的產物用紫外、紅外、核磁進行結構鑒定,使用MTT的方法篩選抗腫瘤的活性成分。結果表明:該鐮刀菌所產色素共6個不同的峰,相對分子質量均在380左右,其中VI號峰結構新穎,為花青苷類色素,分子式為C17H18O10,能抑制A539、MCF-7、MKN-45、HepG2、SW620五種不同腫瘤細胞的增殖,并呈現濃度的依賴性,其中MCF-7乳腺癌細胞抑制最明顯(P<0.01),故VI號峰色素可能是一種很有前景的防治乳腺癌的化合物。
鐮刀菌;色素;結構;抗腫瘤
色素廣泛應用于食品工業、醫藥等行業,色素一般分為天然色素和合成色素。天然色素主要來源于植物、動物和微生物等,一般具有營養保健功能;合成色素雖然有很多優點,但有毒性和致癌性,因此,合成色素正逐漸被天然色素取代。微生物色素是天然色素的重要發展方向,可以不受季節、材料等限制,可連續不斷的發酵生產,能滿足日益增加的社會需求,而且大部分微生物色素具有一定的生物學活性[1-4]。
鐮刀菌作為一類在自然界中廣泛存在和分布的真菌微生物,對其研究主要集中在致病機理上。近年來,隨著人們對于天然色素需求的增加,對鐮刀菌所產的色素也引起人們的關注,開發利用也逐漸增加[5-6]。而鐮刀霉菌產色素抗腫瘤的報道很少。作者將傳統的形態學方法與現代分子生物學技術相結合,對該鐮刀菌進行了鑒定;同時對鐮刀菌所產的色素進行分離和結構的鑒定,并對部分成分進行抗腫瘤的活性研究。
1 材料與方法
1 1主要儀器與試劑
1.1.1 儀器超凈工作臺 (SW-CJ-1f):蘇州凈化廠;回轉式恒溫搖床(HZC-250):廣州醫療器材廠;恒溫恒濕培養箱(LHS-250 HC):蘇州醫療器材廠;分光光度計(UV-3000):日本日立公司;立式壓力蒸汽滅菌鍋(YXD-LS-60):江蘇儀器廠;液質聯用儀(Waters Platform ZMD4000):美國waters公司;核磁共振儀(AVANCE III 400 MHz):傅立葉紅外光譜儀(NICOLET NEXUS 470):美國;冷凍干燥機(EZ585Q):江蘇吳中;掃描電子顯微鏡 (Quata-200):日本三菱。
1.1.2 試劑葡萄糖、果糖、乳糖、D-半乳糖、甘油、蔗糖、麥芽糖、尿素、硫酸銨、丙酮、氯仿、無水乙醇、鹽酸、異丙醇、二甲基亞砜(DMSO)、檸檬酸、苯甲酸鈉、三氟乙酸(TFA),以上均為分析純,購自上海國藥集團;四甲基偶氮唑鹽(MTT):購自美國Sigma公司。
1.2 方法
1.2.1 鐮刀霉菌培養基
1)PDA斜面培養基 (g/L):土豆200,葡萄糖20,瓊脂20,pH自然;
2)種子培養基(g/L):土豆 200,葡萄糖20,pH自然;
3)液態發酵培養基(g/L):土豆200,葡萄糖20,牛肉膏3,pH自然。
1.2.2 菌株的形態學特征將供試菌株接種在培養基平板上,30℃培養,對病原菌在培養基上的菌落形態、生長情況、顏色以及孢子形狀、大小、產孢結構等進行觀察,將菌株的菌絲、孢子用電子顯微鏡及光學顯微鏡(石碳酸-棉藍染色)觀察,并拍照記錄,并依據鐮刀菌的分類系統[7-9],對鐮刀菌菌株進行鑒定。
1.2.3 菌株的分子生物學鑒定采用CTAB法[10]提取鐮刀菌基因組RNA,使用真菌26 rRNA基因間隔區通用引物(ITS1/ITS4)[11],對鐮刀菌分離物的基因組rRNA進行PCR擴增,序列全長為606 bp,測序,獲得的 ITS序列在 GenBank數據庫(http://www. ncbi.nim.nih.gov/blast)中進行同源性比較。
1.2.4 鐮刀霉菌的培養及色素提取從斜面培養基上挑取一小塊菌落,轉接到有種子培養基的三角瓶(250 mL三角瓶中裝液量50 mL),30℃下旋轉式搖床以200 r/min的轉速培養36 h,以5%的接種體積分數接種到50 L的發酵罐中發酵72 h。
發酵液經10 000 g離心10 min,收集紫色菌體,加入4倍體積的95%酸性乙醇溶液 (乙醇-鹽酸=9∶1)浸提過夜,得到色素提取液,用1 mol/L NaOH調PH至7.8左右,離心得到紫色沉淀,即得色素粗品。
1.2.5 色素的HPLC分離分離條件:色譜柱Phecda C18(5 μm,4.6 mm×250 mm),柱溫25℃;DAD檢測器檢測波長254 nm;流量1.0 mL/min,進樣量10 μL,流動相A為含體積分數0.1%TFA(氟乙酸)的乙腈,流動相B為含體積分數0.1%TFA的蒸餾水,梯度洗脫程序見表1。
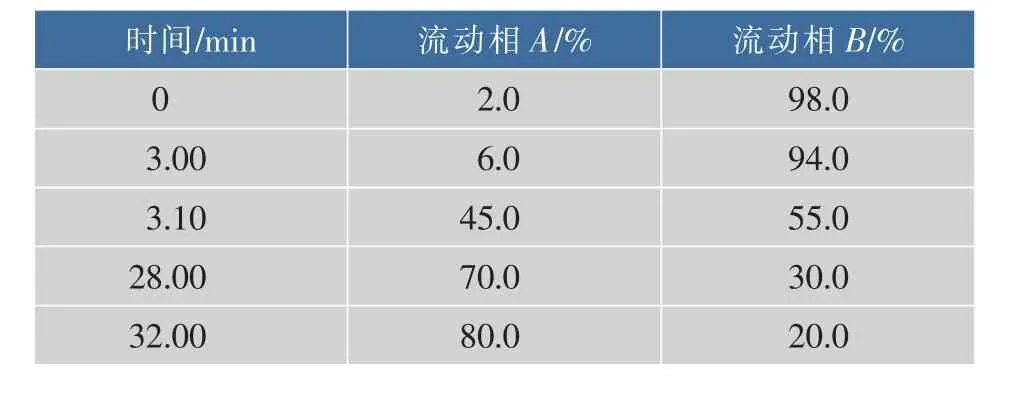
表1 流動相梯度程序Table Gradient program of mobile phase
1.2.6 鐮刀霉菌發酵產紫色素結構的分析
1)紫外光譜分析:取紫色素純品2 mg溶于乙腈-三氟乙酸 (10∶1)中,通過 Waters Platform ZMD4000進行液質分析,液相掃描選擇的波長為200~750 nm,然后利用Masslynx V4.1軟件分析出該色素紫外圖譜。
2)紅外光譜分析(IR):取紫色素純品2 mg,與200 mg干燥的KBr研磨混勻,用傅立葉變換紅外光譜儀在4 000~400 cm-1區間掃描,掃描次數:32次,分辨率:4 cm-1。
3)核磁共振(NMR)分析:用氘代三氟乙酸將待測樣品溶于5 mm標準的NMR管中,加入少量TMS作為基準參照物進行測定。
1.2.7 MTT比色法測定色素對不同腫瘤細胞增殖的影響用含10%胎牛血清的完全培養基,培養肺腺癌細胞A539、乳腺癌MCF-7、人胃癌細胞MKN-45、肝癌HepG2細胞株、大腸癌細胞株SW620等5種不同的細胞株 (上述細胞均購于上海細胞所),MTT方法參照文獻[12],將制好的含細胞的完全培養液加入96孔培養板中,色素終濃度分別為5、10、15 μmol/L,對照組加入含等體積鹽酸乙醇的新鮮完全培養液200 μL;陽性藥物烏苯美司終濃度為(IC50)10 mmol/L,對照組含1%的醋酸培養液[13]。每組均為15個復孔,選擇490 nm波長,在酶聯免疫檢測儀上測定各孔吸光度(A)。
1.3 統計學方法
應用SPSS11.5統計軟件進行數據處理,數據采用均數±標準差(x±s)表示。兩組間比較將采用LSD、Hochberg's GT2、Games-Howell統計學方法進行統計處理。取α=0.05做為顯著性檢驗標準,以P<0.05為差異有顯著性意義。
2 結果與分析
2.1 平板生長特性
將鐮刀菌株接種于PDA固態培養基的平皿中,30℃恒溫培養,觀察菌體生長狀態。培養3~4 d后,菌落中央的菌絲體頂部呈白色叢毛突起,菌落邊緣整齊,菌絲體呈白色絨毛狀,菌落背面呈紫色;7~8 d后,氣生菌絲發達,密集叢立,少匍匐,菌落致密,質地呈棉絮狀平展,菌落上有一層白色孢子,菌落和培養基緊密連接,難以挑取,無滲出液,無特殊氣味。
2.2 顯微形態特征
鏡下觀察發現透明分隔狀菌絲,有頂生、間生的厚壁孢子和較多腎形小分生孢子,呈頭狀著生于不分支的分生孢子梗上,大分生孢子多見,呈鐮刀狀,兩頭尖,2~4個分隔,無足細胞或頂端突起。根據菌體形態特征的研究,查閱《真菌鑒定手冊》[14]和《中國真菌志》[15],初步鑒定菌株為鐮刀霉菌JN158。
2.3 鐮刀菌株JN158的rRNA基因間隔序列測定
通過PCR擴增得到的26S rRNA基因間隔序列的D1/D2區,序列全長為606 bp,見圖1。經GenBank,其登錄號為HQ265299。根據BLAST結果,取相似度較高的序列列表,見表2。通過表2的分析發現,與Fusarium sp的26S r RNA基因其相似度為100%,因此結合菌株的形態特征,確定菌株JN158屬于鐮刀霉菌屬,命名為Fusarium sp JN158。
2.4 利用HPLC對Fusarium sp.JN158產色素的分離純化
本實驗HPLC選用C18柱,對色素分離效果較好,由圖2可看出有6個峰,與LC/MS分析的出峰數基本上一致(數據未顯示),分別標記成Ⅰ~Ⅵ(圖2a),Ⅵ峰的峰相對最高(圖2b),與周圍雜峰距離也較遠,該組分較易分離純化,所以只對這一組分進行了制備。
2.5 Fusarium sp.JN158紫色素結構的鑒定
2.5.1 紫色素的紫外光譜分析早期對有色的有機化合物研究發現,顏色的發生與分子中存在不飽和基團或體系有關如>C=C<、>C=O、—N=N—、苯環等,把這些基團或體系稱為生色團。紫外光譜僅提供分子中的共軛體系和某些基團的結構信息。通過LC/MS的分析,得到該色素的紫外吸收光譜見圖3。可以看出,該化合物在紫外區有兩條吸收帶,分別為253 nm和274 nm,可初步判斷該色素是一種帶苯環的化合物。

圖1 鐮刀菌Fusarium JN158 26S rRNA基因間隔區序列Fig.1 Gene sequence of Fusarium sp JN158 26S rRNA Spacer
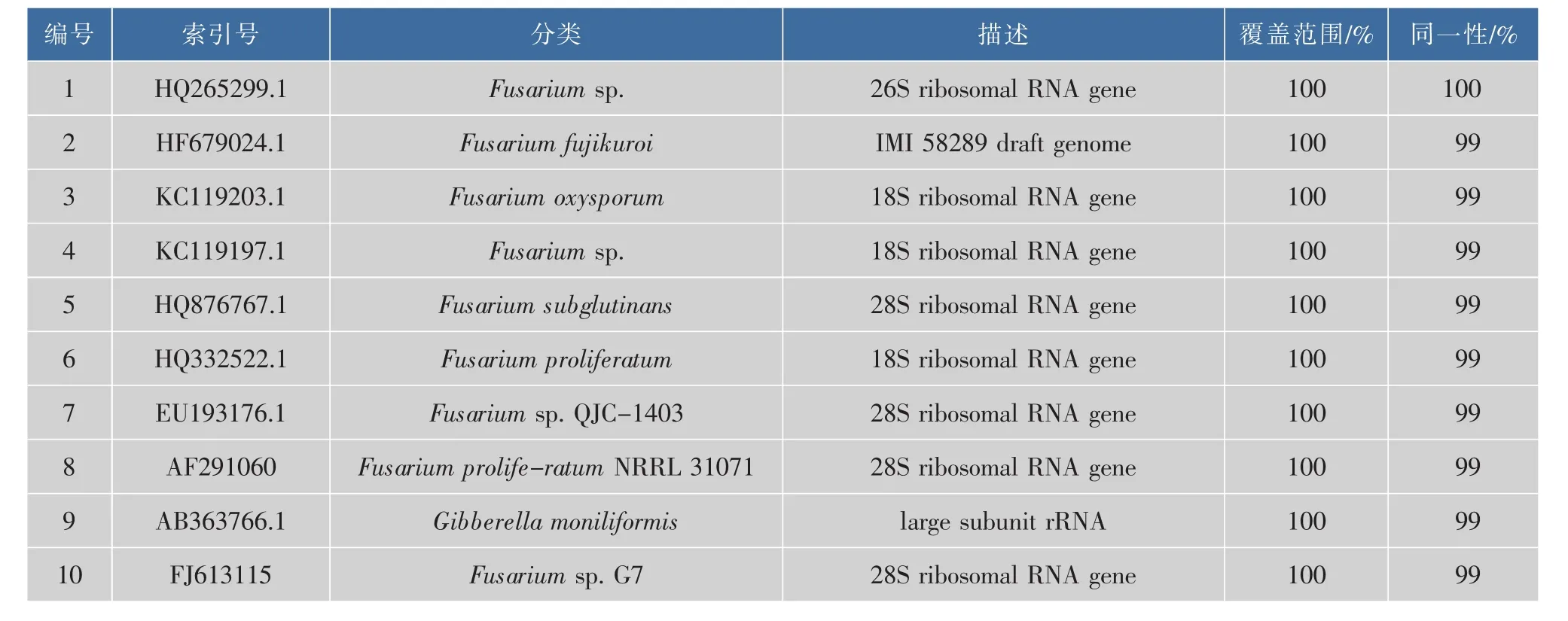
表2 用于同源比對的鐮刀菌 (Fusarium)真菌的RNA序列Table 2 RNA sequences from Fusarium used for alignment with the new sequence
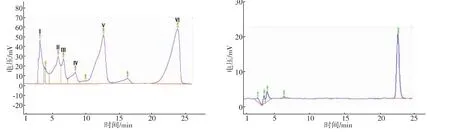
圖2 HPLC分離色素Fig.2 HPLC separate pigment
2.5.2 紫色素的質譜分析一級質譜主要是用于分析目標分子的相對分子質量,該紫色素的一級質譜圖見圖4,可以看出該色素的相對分子質量為382.0。
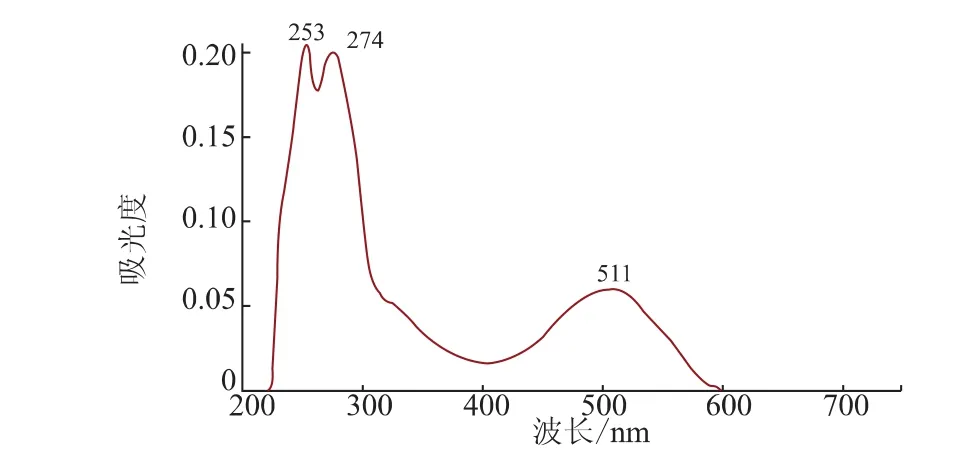
圖3 紫色素的光譜掃描圖Fig.3 Spectrum of purple pigment
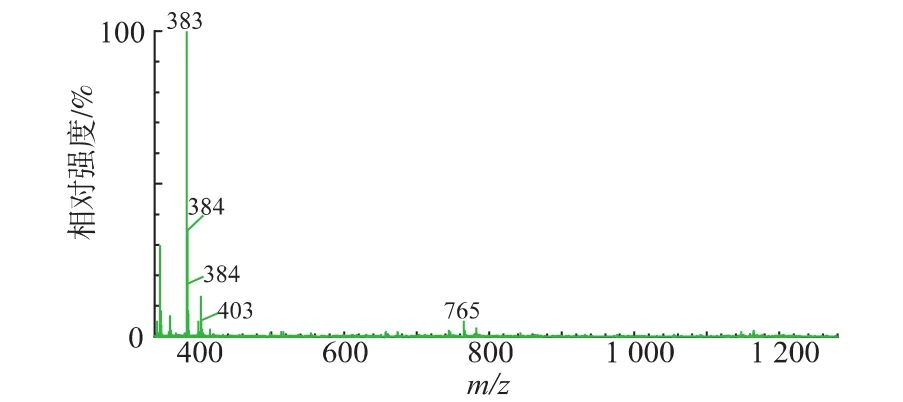
圖4 Fusarium JN158紫色素的正離子質譜圖Fig.4 MS spectra of purple pigment from Fusarium JN158
2.5.3 紫色素的紅外光譜分析紅外光譜是記錄有機分子吸收紅外光后產生化學鍵振動而形成的光譜吸收,測定范圍一般為4 000~400 cm-1,常用來確定各種羧基、烷烴、芳環及炔烴等基團的特征吸收峰。基團頻率區在4 000~1 300 cm-1之間,在1 800 cm-1(1 300 cm-1)~600 cm-1區域內,除單鍵的伸縮振動外,還有因變形振動產生的譜帶。O—H基的伸縮振動出現在3 650~3 200 cm-1范圍內;-CH2基的吸收峰出現在2 930 cm-1和2 850 cm-1附近;C=O伸縮振動出現在1 900~1 650 cm-1范圍內;苯的衍生物的泛頻譜帶,出現在2 000~1 650 cm-1范圍,是C—H面外和C=C面內變形振動的泛頻吸收;頻率范圍在1 500~1 300 cm-1為C—H彎曲振動區;酚的相應譜帶在較高頻率1 200~1 280 cm-1;醇的C—O出現在1 000~1 200 cm-1。結合圖5,該紫色素的紅外光譜分析結果匯總見表3。
2.5.4 紫色素的核磁共振(NMR)分析
1)1H核磁共振圖譜分析:從圖譜的位移值及峰形來看,化學位移11.500為烯醇的H;化學位移5.384與芳環中的羥基中的H一致;化學位移3.908為醇羥基中的H;化學位移4.550為甲氧基相連的CH2中的H;化學位移4.053與羥基相連的CH2的H一致;化學位移4.486為C=C—OCH3中的H;化學位移3.527為C—C—OCH3中的H。
2)13C核磁共振圖譜分析:從圖譜的位移值及峰形來看,化學位移178.67、176.12與羧基中的C一致;化學位移53.12、53.71、55.68為甲氧基中的C,表明該色素含有3個甲氧基,其中2個是對位的,與氫譜結果一致;化學位移157.42為苯環中與羥基相連的C;化學位移為C=C中接羥基的碳;化學位移56.27與C—OH中的C一致。
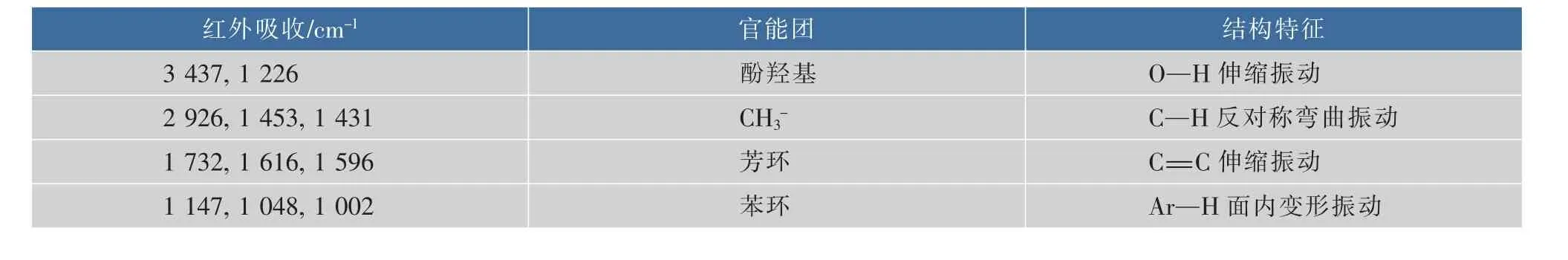
表3 Fusarium sp.JN158紫色素的紅外光譜分析結果Table 3 IR spectrum results of purple pigment from Fusarium sp.JN158
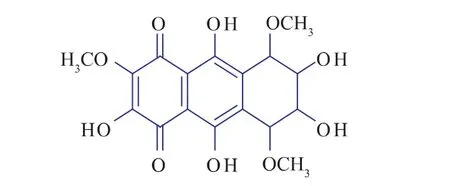
結合紫色素的性質及質譜與紅外的光譜分析,通 過 COSY (Correlated Spectroscopy)、HMQC(Heteronuclear Multiple Quantum Coherece)、ROESY(Rotaing Frame Overhauser Efect Spectroscopy)及MLEV[M.Levitt(broadband composite decoupling sequence)]對1H、13C核磁共振譜峰進行準確的歸屬,確定了該色素的相對分子質量為382.0,分子式為C17H18O10,結構為:
2.6 鐮刀霉菌產VI號化合物對不同瘤株細胞增殖的影響
MTT比色實驗法檢測Fusarium sp.JN158產VI號化合物對MCF-7、A549、NKM-45、SW 620結腸癌細胞、HePG2肝癌細胞5種腫瘤細胞增殖的影響,使用5、10、15 μmol/L 3個不同濃度的VI號化合物和烏苯美司(IC5010 mmol//L)作用于腫瘤細胞24 h,烏苯美司(Ubenimex)是從網狀橄欖鏈霉菌培養液中發現的一種具有抗菌作用和免疫增強作用的小分子二肽化合物,相對分子質量與VI相似,已有體外研究表明,烏苯美司可誘導人非小細胞肺癌細胞、人白血病細胞等凋亡。
通過酶聯免疫檢測儀而測出的490 nm波長下的各組吸光度(A)值,見表4。
可以看出,VI號化合物對MCF-7、MKN-45、A549、SW 620、HePG2均有不同的抑制作用,并呈現濃度的依賴性,其中MCF-7有明顯的抑制作用。在相同濃度的情況下,色素對所有腫瘤細胞的抑制均要優于陽性藥物—烏苯美司,對正常人臍帶靜脈內皮細胞(HUVEC)沒有影響(數據沒有在表中列出),提示VI號化合物可能是一種有應用開發前景的抗腫瘤化合物。
3 結語
本研究使用的霉菌是根據霉菌的形態特征和培養性狀的觀察結果,參照Booth的鐮刀菌分類系統及其生物學特點,根據26SRNA間隔測序的結果,判斷為Fusarium sp.B158鐮刀菌。
鐮刀菌 Fusarium sp.B158發酵所使用的培養基只需要葡萄糖和土豆,培養基所用的成本低廉。發酵的產物在酸性乙醇中(pH 1.5左右)呈現紅色,在堿性條件下(pH 7~8)變成紫黑色,并有結晶沉淀。該色素不溶于水,可溶于酸性乙醇。
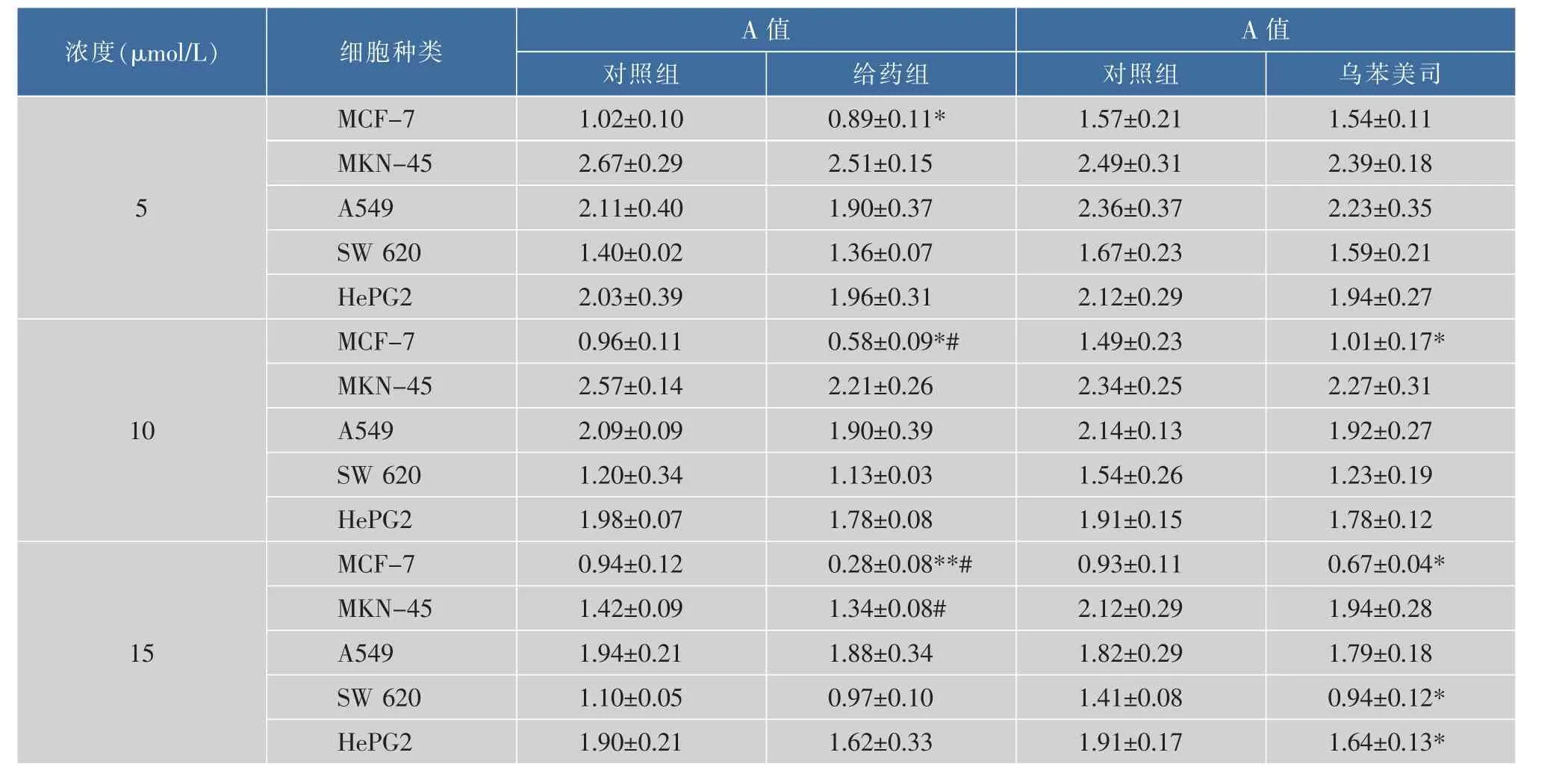
表4 VI號化合物對不同腫瘤細胞增殖的影響(x±s)Table 4 Effect of different cancer cell proliferation from NO.6 compound
通過色素的液相分離和制備實驗,選擇最佳流動相和最佳洗脫程序,分離得到6個峰,其中VI號峰遠離其余的峰,通過液相制備系統制得純度約98%。
質譜實驗可知VI號峰的相對分子質量為382,結合有機元素實驗數據,推測可能的分子式是C17H18O10,是花青苷類色素。通過科技查新可知:沒有這種相對分子質量的分子式報道,故VI號峰的色素可能是一種新的化合物。
為證實該色素的功效特點,選擇常見的5種瘤株,測定VI號化合物對腫瘤細胞的影響。結果發現,這個化合物對上述5種腫瘤細胞瘤株均具有抑制作用,而對MCF-7乳腺癌細胞抑制最為明顯(P<0.05),而對正常細胞沒有毒性作用(結果未在文章中顯示),提示這可能是一種潛在的有開發前景的防治乳腺癌的化合物。
[1]周波,吳吉林,朱明軍,等.微生物黃色素的研究進展[J].微生物學通報,2010,37(9):1362-1368.
ZHOU Bo,WU Jilin,ZHU Mingjun,et al.Research progress of microbial yellow pigment[J].Microbiology China,2010,37(9):1362-1368.(in Chinese)
[2]趙春安,李海燕,柳陳堅.微生物色素的生物合成及其遺傳工程研究進展[J].現代化工,2009,29(12):35-37.
ZHAO Chunan,LI Haiyan,LIU Chenjian.Microbial pigment biosynthesis and genetic engineering progression[J].Modern Chemical Industry,2009,29(12):35-37.(in Chinese)
[3]孫肇喝,楊秀萍.放線菌素研究進展[J].首都師范大學學報:自然科學版,2011,32(2):54-57.
SUN Zhaohe,YANG Xiuping.Research progress of actinomycin[J].Journal of Capital Normal University:Natural Science Edition,2011,32(2):54-57.(in Chinese)
[4]李洪波,杜巍,趙凱,等.靈茵紅素研究進展[J].生物技術通訊,2012,22(1):139-141.
LI Hongbo,DU Wei,ZHAO Kai,et al.Research progress of Ling Yin red pigment[J].Letters in Biotechnology,2012,22(1):139-141.(in Chinese)
[5]李昌偉,蔡宇杰,廖祥儒,等.鐮刀霉菌(Fusarium JN158)紫色素的提取及理化性質[J].食品科學,2012,33(3):131-133.
LI Changwei,CAI Yujie,LIAO Xiangru,et al.Extraction and physico-chemical properties of purpurin pigment from liquid-cultured mycelia Fusarium sp B158[J].Food Science,2012,33(3):131-133.(in Chinese)
[6]王永威,沈健增,蔡宇杰,等.鐮刀霉菌(Fusarium sp)JN158色素提取和分離技術的研究[J].Journal of Food Science and Biotechnology,2013,32(1):167-171.
WANG Yongwei,SHEN Jianzeng,CAI Yujie,et al.Research of extraction and separation on pigment of Fusarium sp JN158 and [J].Journal of Food Science and Biotechnology,2013,32(1):167-171.(in Chinese)
[7]Booth C.The genus fusarium commonwealth mycological institute[M].England:Kew Surrey,1971.
[8]Brayford D.The identification of fusarium species[M].Egham:international Mycological Intitute Press,1993.
[9]Leslie J F,Summerell B A.The fusarium laboratory manul[M].Iowa:Blackwell Professional Publishing,2006.
[10]Kuniyasu K,Kishi K. Seed transmission of Fusarium wilt of bottle gourd,Lagenaria siceraria Stand1,used as rootstock of watermelon.II.The seed infection course from the infected stem of bottle gourd to the fruit and seed[J].Annals of the Phytopathological Society of Japan,1977,43(2):192-198.
[11]O Donnell K,Cigelnik E,Casper H H.Molecular phylogenetic,morphological,and mycotoxin data support reidentification of the Quorn mycoprotein fungus as Fusarium venenatum[J].Fungal Genetics and Biology,1998,23(1):57-67.
[12]鄭里翔,劉紅寧,舒洋,等.不同體質血清對A549肺癌細胞周期蛋白表達的影響[J].中華中醫藥雜志,2012,27(2):324-326.
ZHENG Lixiang,LIU Hongning,SHU Yang,et al.The effect of different constitution serum on Cyclins/Cdk expression of A549 lung cancer[J].China Journal of Traditional Chinese Medicine and Pharmacy,2012,27(2):324-326.(in Chinese)
[13]鄭艷波,弓建華,李毅,等.烏苯美司抑制腫瘤細胞侵襲與誘導凋亡的研究[J].藥學學報,2012,47(12):1593-1598.
ZHENG Yanbo,GONG Jianhua,LI Yi,et al.Reseach of Ubenimex inhibiting tumor cell invasion and induced apoptosis[J].Acta Pharmaceutica Sinica,2012,47(12):1593-1598.(in Chinese)
[14]魏景超.真菌鑒定手冊[M].上海:上海科學技術出版社,1979.
[15]孔華忠.中國真菌志[M].北京:科學出版社,2007.
Pigment Production by Fermentation of Fusarium(Fusarium sp.JN158)and It's Anti-Cancer Activity
ZHENG Lixiang1,2, CAI Yujian1, XU Minjuan2, LI Changwei1,WANG Qiaofeng2, WANG Yue2, MENG Xianming2, LIAO Xiangru*1
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.School of Basic Medicine,Jiangxi University,Nanchang 330004,China)
Through the separation and structural analysis of the pigment produced by Fusarium fermentation,the research aims to screen the anti-tumor active components.Fusarium was identified by using morphological and molecular biology methods.The pigmen was isolated by HPLC,the production structure was identified by UV,IR,NMR.,and the screening of anti-tumor activity was by MTT.The results showed that the pigment from Fusarium produced a total of six different peaks,the molecular weight is about 380,the VI peak,which is the anthocyanins,can inhibit the A539,MCF-7,MKN-45,HepG2,SW620 five different tumor cell proliferation in a concentrationdependent manner,among them MCF-7 breast cancer cells were inhibited most(P<0.01),so the VI compound with a new structure from Fusarium sp JN 158,may be a good treatment for breast cancer.
Fusarium,pigment,structure,anti-tumor
R 915
A
1673—1689(2015)02—0463—07
2014-01-03
國家自然科學基金項目(8116031);國家級大學生創新創業項目(2013)。
鄭里翔(1965—),男,江西南昌人,醫學碩士,教授,博士研究生導師,主要從事分子腫瘤方面的研究。E-mail:zlx000168@126.com
*通信作者:廖祥儒(1964—),男,江西贛州人,理學博士,教授,博士研究生導師,主要從事發酵工程方面的研究。
E-mail:13771104596@163.com

