天門冬酰胺酶基因在黑曲霉中的同源表達
韋素真, 張 會, 姚 楊,岳苗苗,李 杰
(東北農業大學 生命科學學院,黑龍江 哈爾濱 150030)
天門冬酰胺酶基因在黑曲霉中的同源表達
韋素真, 張 會, 姚 楊,岳苗苗,李 杰*
(東北農業大學 生命科學學院,黑龍江 哈爾濱 150030)
根據NCBI中的黑曲霉天門冬酰胺酶基因asp序列(GI:145231287)設計特異性引物,從黑曲霉CICC2462基因組中擴增asp基因編碼區,構建其黑曲霉表達載體pSZHG-Asp。通過農桿菌介導法轉化黑曲霉,篩選以asp基因置換糖化酶基因glaA的同源重組轉化子。對轉化子的表達產物進行SDS-PAGE分析和酶活檢測。獲得8株在glaA位點發生基因置換的同源重組轉化子,并對其中4株的上清液進行檢測。SDS-PAGE結果顯示,在42 000處有目的蛋白質條帶,重組菌株的目的蛋白質表達量為185~417 μg/mL,發酵液最高酶活為21 111 U/mL。
天門冬酰胺酶;黑曲霉;基因置換;Berthelot顯色反應
天門冬酰胺酶(Asparaginase)又叫天冬酰胺酶、 L-天門冬酰胺酶、門冬酰胺酶等,它是一種催化天門冬酰胺水解生成天門冬氨酸和氨的酶,廣泛存在于植物、動物組織及微生物中[1]。來自于黑曲霉的天門冬酰胺酶是一種食品添加劑,其功能是降低油炸或膨化食品中的丙烯酰胺含量。2002年4月,瑞典國家食品管理局和斯德哥爾摩大學研究人員率先報道,在一些燒烤和油炸的淀粉類食品中,例如油炸土豆片、薯條等中檢出丙烯酰胺,而且含量超過飲水中允許最大限量的500多倍[2]。之后英國、瑞士、挪威和美國等國家也相繼報道了類似結果[3]。丙烯酰胺具有遺傳毒性、神經毒性和潛在致癌性,因此控制食品中丙烯酰胺含量尤其重要[4]。丙烯酰胺主要是通過美拉德反應,由食品原料中的天冬酰胺和還原糖在高溫加熱過程中形成的[5],天門冬酰胺酶可以將丙烯酰胺的前體物——天冬酰胺轉化成天冬氨酸,從而減少丙烯酰胺的含量[6],可以從源頭上控制丙烯酰胺的生成[7]。荷蘭的帝斯曼公司成功地研發了一種酶制劑——PreventASeTM,經過天冬酰胺酶反應過程,可有效消除90%以上的丙烯酰胺成分,并申報了專利[8]。2005年我國衛生部發布公告,要求人們注意食品中的丙烯酰胺的含量,呼吁采取積極的措施減少其含量[9],并在2009年把天門冬酰胺酶列為食品添加劑[10],但是國內關于天門冬酰胺酶作為食品添加劑的研究和應用報道很少。作者擬構建食品級天門冬酰胺酶工程菌,為天門冬酰胺酶的工業化生產和應用奠定基礎。
1 材料與方法
1.1 材料
1.1.1 菌株與載體黑曲霉CICC2462:由肇東市日成酶制劑有限公司提供;農桿菌AGL1:由作者所在實驗室保存;大腸桿菌菌株E.coli DH5α:購自北京全式金生物技術公司。載體pSZHG:由作者所在實驗室保存;載體pSZHG-Asp:由作者所在實驗室構建;PMD18-T vector:購自大連寶(TaKaRa)生物工程公司。
1.1.2 試劑各種限制性內切酶、T4DNA連接酶、Taq酶、核酸相對分子質量標準、質粒提取試劑盒、DNA回收試劑盒等:購自TaKaRa公司;蛋白質相對分子質量標準、瓊脂糖等:購自BBI公司;氨芐青霉素、卡納抗生素、潮霉素B、蛋白胨、氯化鈣、氯化鈉、檸檬酸鈉、水楊酸、亞硝基鐵氰化鈉、天門冬酰胺等:均為國產試劑。
1.1.3 培養基LB培養基、YEB培養基、PDA培養基、發酵培養基:均按照常規實驗室標準配置[11]。
1.2 方法
1.2.1 黑曲霉基因組DNA提取黑曲霉基因組的提取方法采用CTAB方法[12]。
1.2.2 引物設計根據Genebank中公布的黑曲霉天門冬酰胺酶基因Asp序列 (序列號GI:145231287)以及黑曲霉表達載體pSZHG多克隆位點的特征,用Primer5.0軟件分別設計Asp基因特異引物。根據黑曲霉表達載體pSZHG-Asp的序列以及黑曲霉糖化酶基因位點的序列,設計轉化子、PCR檢測引物及同源重組轉化子PCR檢測引物。引物序列見表1。
1.2.3 PCR反應PCR基本的反應體系如下(25 μL):5×Buffer 5 μL,Mg2+(25 mmol/L)2 μL,dNTP(2.5 mmol/L)2 μL,上下游引物(20 μmol/L)各0.5 μL,模板 1 μL,Prime Star Taq酶 0.2 μL,加ddH2O至25 μL。
PCR反應條件:94℃預變性5 min,94℃變性30 s,56℃退火30 s,72℃延伸2 min,共30個循環,72℃終延伸10 min,4℃終止反應。
1.2.4 表達載體構建將pSZHG、pMD-Asp載體分別用NheⅠ、HindIII限制性內切酶酶切,分別回收15 000 bp的載體條帶和1 254 bp的目的基因條帶,連接并構建表達載體pSZHG-Asp。
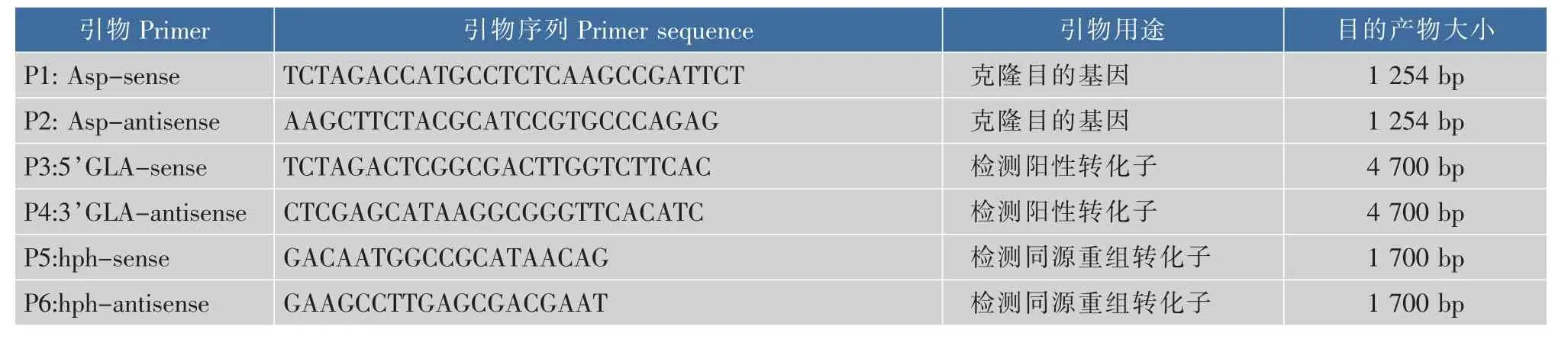
表1 本研究所用引物Table 1 Primers used in this research
1.2.5 黑曲霉的遺傳轉化見文獻[12]。
1.2.6 采用根癌農桿菌介導法見文獻[13]。
1.2.7 天門冬酰胺酶酶活測定活性測定以及相關試劑的配置參照文獻[14-15]。標準曲線繪制:精確稱取(NH4)2SO4溶于超純水,配置質量濃度分別為5、10、20、50、70、100 μg/mL的標準溶液。按表2進行標準曲線的制作以及天門冬酰胺酶活性的測定[16]。
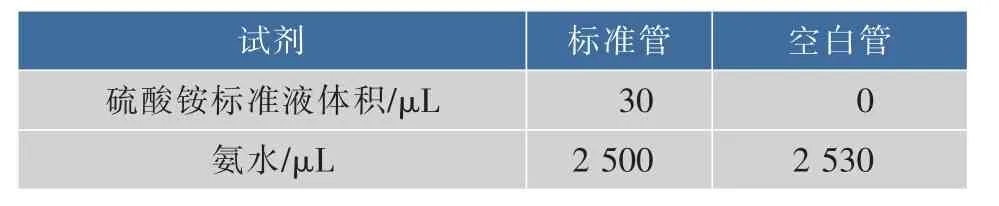
表2 標準曲線制作Table 2 Standard curve
在各管中加入1.2 mL水楊酸溶液,再加入0.10 mL亞硝基鐵氰化鈉溶液和0.10 mL次氯酸鈉溶液,混勻,37℃水浴30 min。用1 cm比色皿,按照表3標準管列分別加入不同濃度的標準溶液,反應后測定650 nm波長的吸光度,以水作參比,測定各管溶液的吸光度。
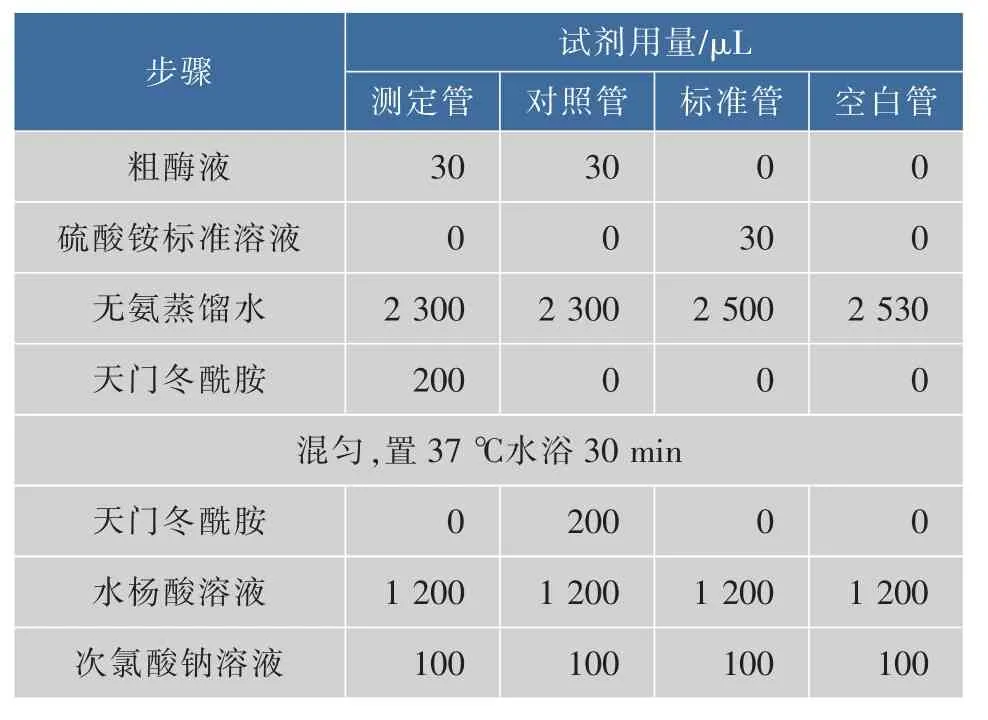
表3 天門冬酰胺酶酶活的測定步驟Table 3 Procedure for asparaginase determination
混勻后置37℃水浴30 min,于650 nm處用無氨水調零,測定各管吸光度。測定管吸光度減去對照管吸光度所得的吸光度值,對照標準曲線得到脫氨反應產生的氨質量濃度X(μg/mL)計算酶活[17]:
酶活 (μg/(min·mL))=(X μg/30 min)×(1/0.03 mL)=10X/9
酶活性單位定義(U):在標準條件下,1 mL酶液在37℃與底物作用1 min產生1 μg氨為1個酶活性單位(pH 5.0,37℃)。
2 結果與討論
2.1 asp基因的擴增
以黑曲霉CICC2462基因組為模板,用asp基因特異性引物進行PCR擴增,獲得約1 254 bp的目的片段,見圖1。將該片段克隆至pMD18-T,送交測序。將測序結果進行blast比對分析發現,該序列與登錄號 GI:145231287的基因序列相似性為100%。

圖1 asp基因PCR擴增結果Fig.1 Results of PCR amplification asp
2.2 表達載體構建
表達載體pSZHG-asp構建見圖2。該載體用XbaI、HindIII雙酶切鑒定,得到大約14 000 bp和2 300 bp的兩條帶,見圖3,證明構建正確。
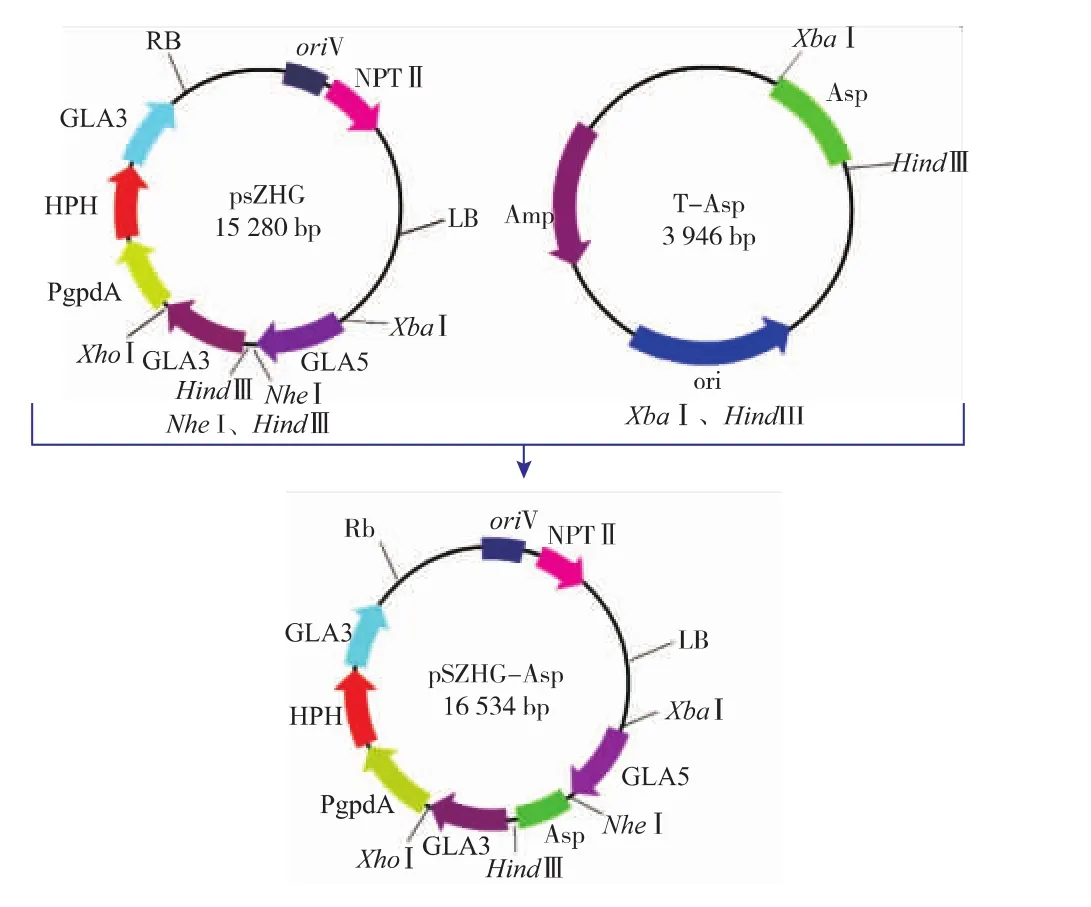
圖2 pSZHG-asp表達載體的構建Fig.2 Construction of expression vector pSZHG-asp

圖3 pSZHG-asp雙酶切結果Fig.3 Enzymes digestion of vector pSZHG-asp
2.3 同源重組轉化子的篩選
農桿菌與黑曲霉共培養之后,挑取篩選平板長出的黑曲霉菌落,搖菌,提取基因組。利用P3、P4引物進行PCR檢測,共對19個菌株進行檢測,有4株擴增出3 500 bp左右的目的條帶和4 700 bp的glaA基因條帶,為陽性轉化子,見圖4。利用P5、P6引物對4株陽性轉化子做PCR檢測,結果均能擴增出1 700 bp左右的目的條帶,因此這4株都是同源重組轉化子,見圖5。
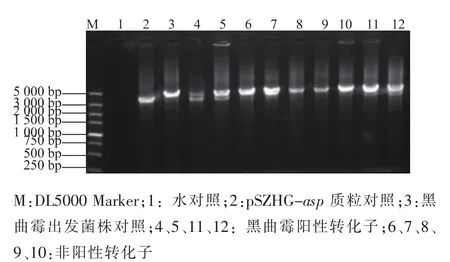
圖4 黑曲霉轉化子PCR驗證結果Fig.4 Results of PCR of Aspergillus niger transformants
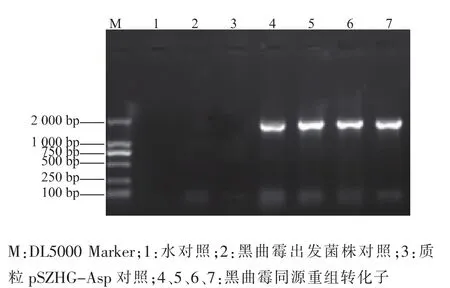
圖5 黑曲霉轉化子同源重組PCR驗證結果Fig.5 Results of PCR of homologous recombination Aspergillus niger transformants
2.4 天門冬酰胺酶酶活測定
2.4.1 氨態氮標準曲線的制作按表1標準管系列分別加入不同質量濃度的標準溶液,反應后在650 nm處測定吸光度,以氨質量濃度(μg/mL)為橫坐標,吸光度為縱坐標,繪制標準曲線,見圖6。R2= 0.999 7,表明其線性相關性較好。
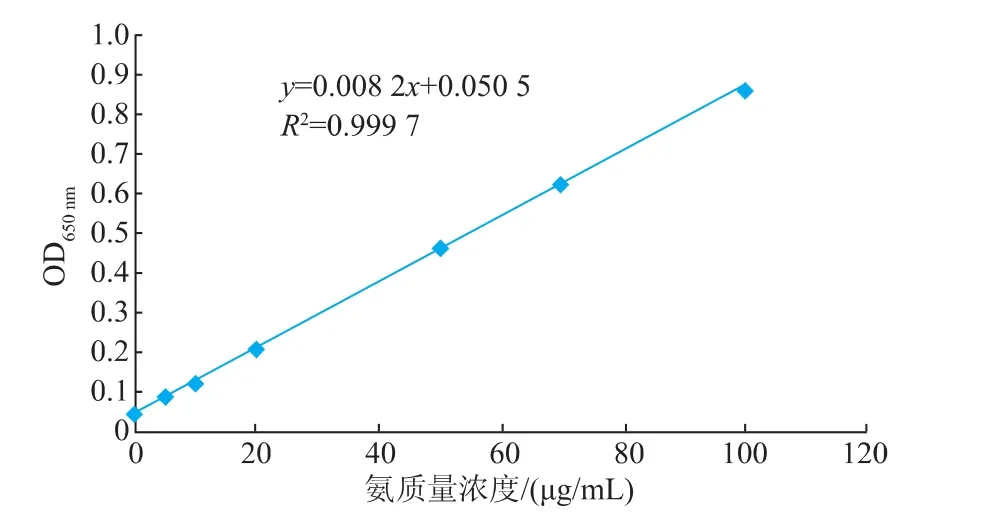
圖6 氨態氮標準曲線Fig.6 Standard curve of ammonium nitrogen assay
2.4.2 酶活測定取出發菌株和3個同源重組菌株進行搖瓶發酵培養,不同發酵時間的酶活見表4。最高酶活可達21 111 U/mL。
2.5 天門冬酰胺酶在重組菌株中的分泌表達
對培養發酵10、11 d的菌液,取上清液進行SDS-PAGE分析,結果見圖7。與出發菌株相比,3株重組菌株都在約42 000的位置出現了目的蛋白質條帶。經ALPHAIMAGER SYSTEMS軟件分析,3株重組菌株的目的蛋白質表達量為 185~417 μg/mL,而出發菌株僅為12 μg/mL。
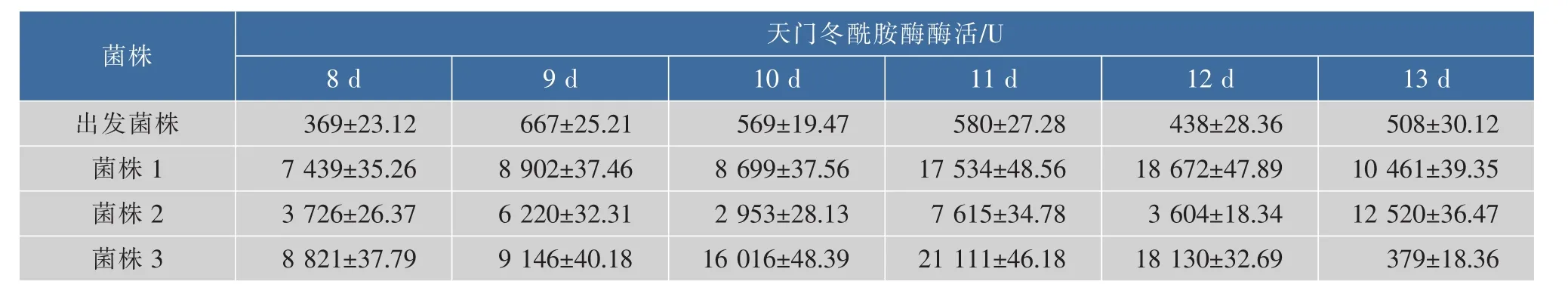
表4 天門冬酰胺酶在不同發酵時間的酶活Table 4 Enzyme activity detection at different fermentation time of asparaginase
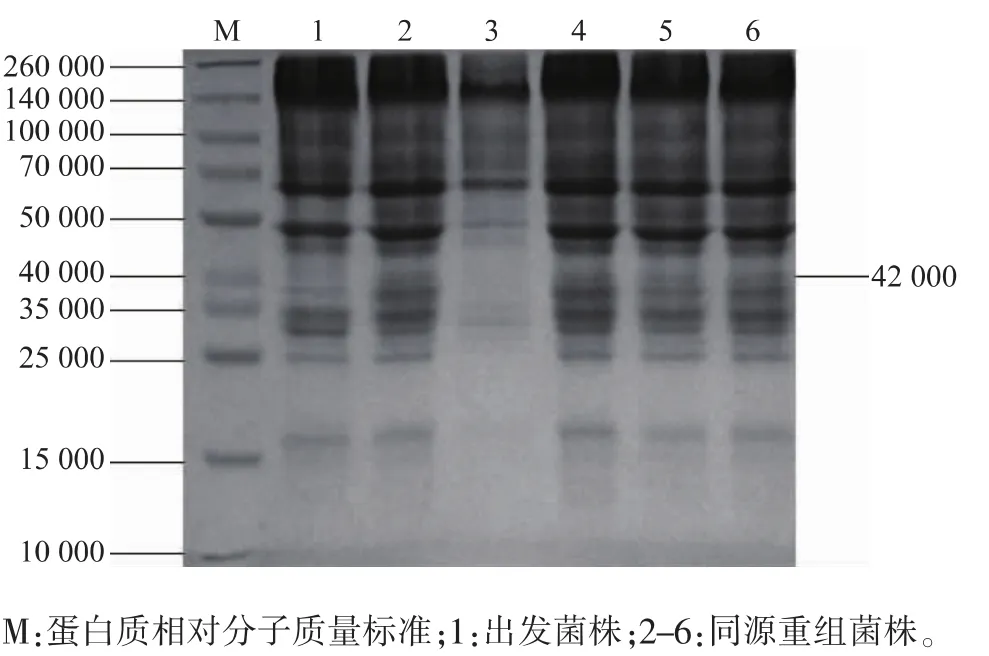
圖7 表達蛋白SDS-PAGEFig.7 SDS-PAGE of expressed protein
3 結語
隨著生活質量的提高,食品安全問題越來越引起人們的關注。丙烯酰胺具有遺傳毒性、神經毒性和潛在致癌性。我國已將食品中丙烯酰胺的檢驗列為“十五”國家重大科技專項“食品安全關鍵技術”課題。降低食品中丙烯酰胺的方法有很多,但是使用天門冬酰胺酶降解原料中的天門冬酰胺是最為簡便有效的方法。因此,天門冬酰胺酶已在2009年被國家衛生部確定為一種食品添加劑。但是我國目前還沒有制定各種食品中丙烯酰胺的限量標準,天門冬酰胺酶的研究和應用還沒有得到足夠的重視。
作者以糖化酶生產菌株CICC2462同時作為基因供體和轉化受體,以糖化酶基因位點為基因整合的靶位點,構建了天門冬酰胺酶工程菌,且在篩選標記潮霉素基因表達框兩側設計了順向重復序列,可在后續實驗中刪除篩選標記基因,達到食品級表達系統要求。本研究獲得的工程菌搖瓶發酵酶活最高已達到20 000 U/mL以上,具有明確的產業化的前景。但是目的蛋白質產量只有417 μg/mL,這說明表達的天門冬酰胺酶具有較高的比活,同時也有巨大的提升表達量的潛力。
[1]張卓丹,趙蓉,吳濤.控制食品中丙烯酰胺含量的方法研究進展[J].食品科學,2009,30(1):294-297.
ZHANG Zhuodan,ZHAO Rong,WU Tao.Summary of control metheds for reducing acrylamide in food[J].Food Science,2009,30(1):294-297.(in Chinese)
[2]Tareke E,Rydberg P,Karlsson S,et al.Acrylamide:cooking carcinogent[J].Chen Res Toxicol,2002(13):517-522.
[3]徐東路,宋賢良.食品中的丙烯酰胺及生物解決方案[J].食品與發酵工業,2010,12:152-155.
XU Donglu,SONG Xianliang.Acrylamide content in food and enzymtic solution[J].Food and Fermentation Industries,2010,12:152-155.(in Chinese)
[4]王文艷,劉凌,周明.天冬酰胺酶降低膨化食品丙烯酰胺含量的初步研究[J].中國食品添加劑,2011,5:59-63.
WANG Wenyan,LIU Ling,ZHOU Ming.Preliminary study on reducing acrylamide content in puffed foods by adding asparaginase[J].China Food Additives,2011,5:59-63.(in Chinese)
[5]Mottram D S,Wedzicha B L,Dodson A T.Acrylamide is formed in the miallard reaction[J].Nature,2002,419:448-449.
[6]楊波.膨化食品及其丙烯酰胺的研究進展[J].食品科技,2011,3:42-45.
YANG Bo.Research progress in studies on puffing food and its acrylamide[J].Food Science&Technology,2011,3:42-45.(in Chinese)
[7]歐什益,張玉萍,黃才歡,等.幾種添加劑對油炸薯片中丙烯酚胺產生的抑制作用[J].食品科學,2006,27(5):137-189.
Ou Shiyi,ZHANG Yuping,HUANG Caihuan,et al.Inhibition of acrylamide formation in fried potato crisps by some food additives[J].Food Science,2006,27(5):137-189.(in Chinese)
[8]Monica Anese,Michele Suman M,Cristina Nicoli.Technological strategies to reduce acrylamide levels in heated foods[J].Food Eng Rev,2009,1:169-179.
[9]Hendriksen H V,Kornbrust B A,Oestergaard P R,et al.Evaluating the potential for enzymatic acrylamide mitigation in a range of food products using an asparaginase from Aspergillus oryzae[J].Journal of Agricultural and Food Chemistry,2009,57(10):4168-4176.
[10]余以剛,李理,梅艷群,等.減少高溫加工食品中丙烯酰胺含量的幾種方法[J].現代食品科技,2007(1):83-85.
YU Yigang,LI Li,MEI Yanqun,et al.Methods for reducing acrylamide content in high-temperature processed foods[J].Modern Food Science and Technology,2007(1):83-85.(in Chinese)
[11]龍小濤,何嘉銳,葉雪麗.食品中丙烯酰胺的抑制方法研究進展[J].現代食品科技,2012,6:688-691.
LONG Xiaotao,HE Jiarui,YE Xueli.Study on inhibition methods of acrylamide in food[J].Modern Food Science and Technology,2012,6:688-691.(in Chinese)
[12]張谷楠.黑曲霉葡萄糖氧化酶基因在畢赤酵母和黑曲霉中的分泌表達[D].哈爾濱:東北農業大學,2012.
[13]張會.β-1,4-內切木聚糖酶基因在黑曲霉中安全高效表達的研究[D].哈爾濱:東北農業大學,2013.
[14]季艷偉,許楊,黃志兵,等.催化光度法測定三聚氰胺脫氨酶活性[J].食品科學,2011,32(18):234-238.
JI Yanwei,XU Yang,HUANG Zhibing,et al.Determination of melamine deaminase activity by catalytic spectrophotometry[J]. Food Science,2011,32(18):234-238.(in Chinese)
[15]GB/T 18204.25-2000,公共場所空氣中氨測定方法[S].
[16]涂追,許楊,季艷偉,等.三聚氰胺脫氨酶基因克隆表達及活性測定[J].食品與技術學報,2011,30(2):234-238.
TU Zhui,XU Yang,JI Yanwei,et al.Cloning,expression and characterization of recombinant melamine deaminase in E.coli[J]. Journal of Food Science and Biotechnology,2011,30(2):234-238.(in Chinese)
[17]何戰勝,鄧健,許金生,等.催化光度法測定體液腺苷脫氨酶的活性[J].中國衛生檢驗雜志,2005,15(5):546-547.
HE Zhansheng,DENG Jian,XU Jinsheng,et al.Determination of adenosine deaminase activity in body fluids by catalytic spectrophotometry[J].Chinese Journal of Health Laboratory Technology,2005,15(5):546-547.(in Chinese)
Homologous Expression of Asparaginase Gene in Aspergillus niger
WEI Suzhen, ZHANG Hui, YAO Yang, YUE Miaomiao, LI Jie*
(College of Life Sciences,Northeast Agricultural University,Harbin 150030,China)
In order to achieve the homologous expression of asparaginase gene asp in Aspergillus niger CICC2462,the asparaginase engineering strains were construced.The specific primers were designed according to asparaginase gene asp sequence in the NCBI(GI:145231287)to amplify the coding region of asp and pSZHG-asp expression vector was constructed.Then agrobacterium mediated method was utilized to transform Aspergillus niger,and homologous recombinations which glucoamylase gene(glaA)was replaced by Asp were screened.The expression products of the transformant were analyzed using SDS-PAGE and enzyme activity detection.Eight homologous recombination strains,where glaA locus was replaced,were obtained,and the supernatant in 4 of them were measured.The result of SDS-PAGE showed protein bands at 42 000,the amount of the recombinated protein was 185~417 μg/mL,and the highest enzyme activity of fermentation broth was up to 21 111 U/mL.
asparaginase,Aspergillus niger,gene replacement,berthelot colour reaction
Q 786
A
1673—1689(2015)05—0554—06
2014-02-19
農業生物功能基因重點實驗室開放課題資助項目。
*通信作者:李 杰(1972—),男,黑龍江拜泉人,農學博士,副教授,碩士研究生導師,主要從事分子遺傳學與基因工程方面的研究。
E-mail:lijie_neau@126.com

