不同濃度卡那霉素、潮霉素對楸樹試管苗生長的影響
于永明 ,王軍輝,麻文俊,馬建偉,張宋智,李平英,韓云花
1.中國林業科學研究院 林業研究所,國家林業局 林木培育重點實驗室,北京 100091;2.甘肅省小隴山林業科學研究所,甘肅 天水 741022
楸樹(Catalpa bungeiC.A.Mey.)材質優良,樹干挺拔,花色淡紅素雅,觀賞性高,是珍貴用材及綠化樹種,在我國豐富的樹木資源中,惟其“材”貌雙全,自古素有“木王”之美稱。近年來,在楸樹生物學特性、開花結實習性、種質資源現狀、良種選擇、繁殖技術、造林技術等方面都有較為系統的研究。“十一五”期間,珍貴闊葉樹種種質創新課題組對楸樹種源和無性系選擇、目標樹選擇和培育、立地選擇、干形培育、混交林結構調整、密度控制和水肥調控等關鍵技術進行了深入研究,建立了珍貴用材林定向單株培育的科技創新平臺,提高了我國珍貴用材林培育的技術創新能力[1-4]。在楸樹組培研究領域,已有研究者對楸樹器官的體細胞胚胎發生進行探討,并取得一定的研究結論[5],但普遍以楸樹嫩芽為材料。本珍貴闊葉樹種種質創新課題組根據研究結果,已制定了《楸樹無性系組培快繁技術規程》地方標準[6]。
抗生素是由微生物或高等動植物在生活過程中產生的具有抗病原體或其他活性的一類次級代謝產物,能干擾其他生活細胞的發育功能。卡那霉素是一種蛋白質生物合成抑制劑,通過與30S 核糖體結合而使mRNA 密碼誤讀,若細菌產生一種破壞卡那霉素的酶,則該菌可變為抗性株,卡那霉素抗性質粒常被作為選擇基因或標記基因用于分子克隆[7-8]。潮霉素是一種常用的抗性篩選藥物,其抗性基因表達產物是一種蛋白激酶,通過磷酸化潮霉素使其喪失活性。由于在真核和原核生物中潮霉素篩選假陽性率低,重復性好,現在通過潮霉素對轉基因生物進行篩選已被廣泛應用[9-12]。卡那霉素和潮霉素是目前遺傳轉化體系廣泛應用的2 種抗生素。我們進行了卡那霉素和潮霉素對楸樹無性系試管苗生長的影響研究,以確定抗生素對楸樹莖段分化和生根的敏感質量濃度,建立有效的遺傳轉化體系,為楸樹特性良種的選育與轉化提供重要理論和實踐指導。
1 材料與方法
1.1 材料
河南洛陽楸樹優良無性系2-8、1-4組培苗由本課題組篩選;卡那霉素與潮霉素均購自Sigma公司。
1.2 楸樹無性系生長分化培養
選擇生長一致的楸樹組培苗,轉接到增殖分化培養基上。增殖培養莖段帶1 個腋芽,確保誘導分化在同一水平。繼代增殖分化培養基為DKW+BA(芐氨基腺嘌呤)1.0 mg/L+IBA(吲哚丁酸)0.2 mg/L+蔗糖25 g/L+瓊脂4.5 g/L(pH5.8),以楸樹無性系2-8 組培繼代瓶苗為材料,在培養基中分別加入0、25、50、100、150 mg/L 的卡那霉素,1、5、10 mg/L 的潮霉素,共8個處理質量濃度;以楸樹無性系1-4、2-8 組培繼代瓶苗為材料,在培養基中分別加入0、1、5、10 mg/L 的潮霉素,共4個處理質量濃度。每個處理設置3 個重復,每重復接種10 瓶,每瓶接種3 株。所有材料都置于組培室內,組培苗培養溫度22~26℃,光照2000 lx,光照時間為14 h/d。
1.3 楸樹試管苗生根培養
生根莖段長度為1.5 cm,確保插入培養基莖段部位沒有腋芽,以免影響根系的誘導。生根培養基為1/2MS+IBA 0.1 mg/L+NAA(萘乙酸)0.01 mg/L+蔗糖10 g/L+瓊脂5.0 g/L(pH5.8),以楸樹無性系2-8 組培繼代瓶苗為材料,在培養基中分別加入0、25、50、100、150 mg/L 的卡那霉素,1、5、10 mg/L的潮霉素,共8個處理質量濃度;以楸樹無性系1-4、2-8 組培繼代瓶苗為材料,在培養基中分別加入0、25、50、100、150 mg/L 的卡那霉素,共5 個處理質量濃度。每個處理設置3個重復,每重復接種10瓶,每瓶接種3 株。所有材料都置于組培室內,培養條件同上。
1.4 生長指標的測定
增殖培養40 d 后,統計增殖培養指標,包括增殖芽數、芽長、葉數、接入莖段愈傷組織橫向及縱向膨大情況。增殖系數以各處理增殖芽數與芽長的積除以轉接莖段長度(1 cm)而得。
生根培養30 d 后統計生根培養指標,包括接入莖段發根數、根長、發芽數、芽長、葉數。
2 結果
2.1 抗生素對楸樹繼代瓶苗生長的影響
2.1.1 抗生素對楸樹無性系2-8 繼代瓶苗生長的影響 方差分析顯示,經不同質量濃度的抗生素處理,楸樹無性系2-8 瓶苗的增殖芽數(P=0.008)、芽長(P=0.000)、愈傷組織橫向膨大(P=0.000)、增殖系數(P=0.000)、葉數(P=0.000)、愈傷組織縱向膨大(P=0.000)的差異極顯著。多重比較顯示(表1),不同質量濃度的抗生素處理對各指標間的差異不同。在培養基中添加抗生素,楸樹誘導增殖分化芽均低于對照(質量濃度為0 mg/L);隨著質量濃度的增大,呈現出逐漸降低的變化趨勢,與對照相比,變化呈負相關。卡那霉素與潮霉素的作用基本相同,隨著添加質量濃度的增大都呈負相關。與對照相比,在培養基中添加低質量濃度的潮霉素(1 mg/L)對2-8 的分化指標增殖芽數、葉數及莖段基部愈傷組織的膨大有一定的促進作用,但對分化芽的生長有一定的抑制作用。添加卡那霉素質量濃度為50 mg/L 時葉片開始發黃;當濃度為100 mg/L 時葉片開始發白,葉尖開始干枯,莖段基部愈傷組織基本停止膨大,瓶苗生長緩慢;當濃度為150 mg/L 時葉片大多發白,葉片干枯,莖段基部無愈傷組織形成,瓶苗基本不生長。依此,楸樹繼代瓶苗的分化芽對卡那霉素的耐受范圍為100~150 mg/L。添加潮霉素質量濃度為1 mg/L 時葉片開始發黃;當濃度為5 mg/L 時葉片開始發白,葉片小,莖段基部愈傷組織較小,瓶苗生長緩慢;當濃度為10 mg/L 時葉片開始干枯,莖段基部愈傷組織較小,瓶苗基本不生長。依此,楸樹繼代瓶苗的分化芽對潮霉素的耐受范圍為10 mg/L左右。
2.1.2 潮霉素對楸樹無性系1-4 繼代瓶苗生長的影響 方差分析顯示,經不同質量濃度的潮霉素處理,1-4 瓶苗的增殖芽數(P=0.009)、芽長(P=0.001)、愈傷組織橫向膨大(P=0.005)、增殖系數(P=0.002)、葉數(P=0.000)、愈傷組織縱向膨大(P=0.009)的差異極顯著。多重比較顯示(表2),不同濃度處理對各指標間的差異不同。與對照相比,低質量濃度(1 mg/L)潮霉素對楸樹無性系1-4 分化芽數有促進作用,而對其他指標有明顯的抑制作用;隨著潮霉素質量濃度(5、10 mg/L)的加大,對各指標出現明顯的抑制,與對照相比,變化趨勢呈負相關。在促進增殖分化芽數方面,潮霉素對無性系1-4 與2-8 的影響一致,說明低質量濃度(1 mg/L)的潮霉素對楸樹無性系的繼代分化芽數有一定的促進作用。
2.1.3 潮霉素對無性系1-4、2-8 分化差異的影響見表3,同一抗生素對不同無性系間繼代分化指標的影響差異不顯著,在同等培養條件下,無性系間分化指標的差異主要取決于無性系遺傳因素的制約。
2.2 抗生素對楸樹生根瓶苗生長的影響
2.2.1 抗生素對楸樹無性系2-8 生根瓶苗生長的影響 方差分析顯示,在楸樹無性系2-8 生根培養基中添加不同濃度的抗生素,對楸樹根系誘導有明顯的抑制作用,各處理(卡那霉素25、50、100、150 mg/L,潮霉素1、5、10 mg/L)與對照相比,差異極顯著(P發根數=0.000、P根長=0.000、P發芽數=-、P芽長=0.000、P葉數=0.000、P生根率=0.000)。隨卡那霉素與潮霉素質量濃度的升高,生根率及其他指標生長呈下降趨勢。潮霉素質量濃度達5 mg/L 時,生根苗已出現不良生長狀況,少部分莖段干枯;濃度為10 mg/L 時,大部分莖段干枯,少部分為綠,莖段未出現芽的分化與根的萌發現象。依此,楸樹組培瓶苗生根苗對潮霉素的耐受范圍為5~10 mg/L。卡那霉素質量濃度達50 mg/L 時,生根苗已出現不良生長狀況,生根誘導率基本是對照的一半;濃度為100 mg/L 時,大部分莖段干枯,少部分為綠但未分化芽與根;濃度為150 mg/L 時,大部分莖段干枯,極少部分上部為綠,基部干枯,但未分化芽與根。依此,楸樹組培瓶苗生根苗對卡那霉素的耐受范圍為100~150 mg/L。
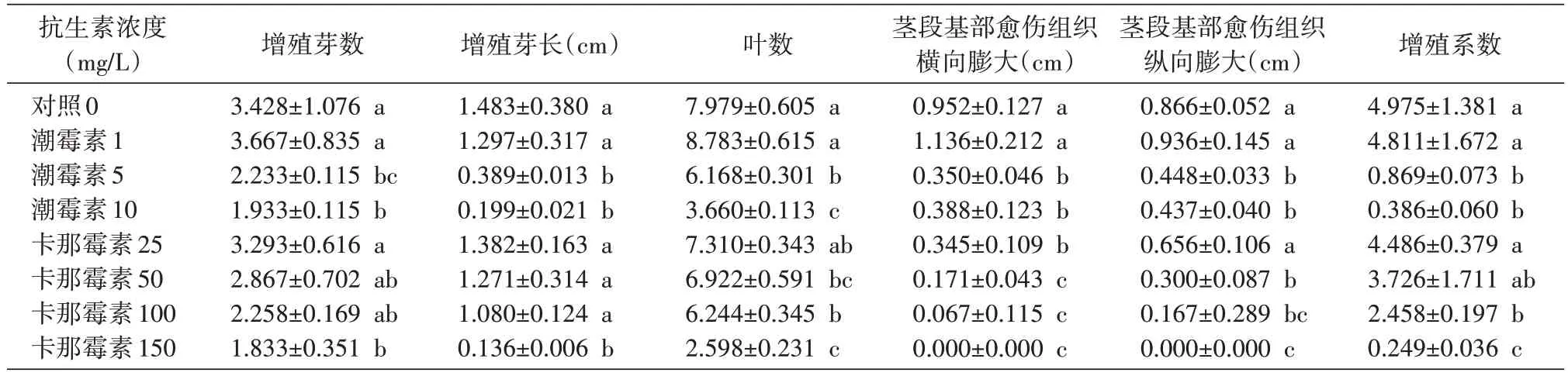
表1 不同質量濃度的潮霉素和卡那霉素對2-8組培苗繼代分化的影響

表2 不同質量濃度的潮霉素對1-4組培苗繼代分化的影響

表3 不同質量濃度的潮霉素對楸樹無性系2-8、1-4生根苗培養性狀的影響方差分析(P值)
2.2.2 卡那霉素對楸樹無性系1-4 生根瓶苗生長的影響 在楸樹無性系1-4 生根培養基中添加卡那霉素25、50、100、150 mg/L,與對照相比,差異極顯著(P發根數=0.000、P根長=0.000、P發芽數=-、P芽長=0.000、P葉數=0.000、P生根率=0.000),影響趨勢與2-8 類似,隨抗生素質量濃度的升高,各生長指標受到明顯抑制。當卡那霉素濃度達100 mg/L 時,莖段部分為綠,部分干枯,莖段無發根發芽情況;濃度為150 mg/L 時,莖段基本全部干枯,僅極少數為綠,但未分化芽與根。
2.2.3 卡那霉素對無性系1-4、2-8 生根差異的影響 由表6 可知,不同質量濃度的卡那霉素對楸樹無性系2-8、1-4 生根苗培養性狀的影響相同,不同無性系間并無差異,說明在楸樹無性系生根培養基中添加卡那霉素對生根培養性狀的抑制有普適性。
3 討論
生物體對周圍環境都有一定的適應性,當環境處于逆境時,生物體會對逆境產生一定的抗性,逆境強度決定了生物體能否生存。抗生素與鹽脅迫、低溫脅迫、病害等的發生類似,也是一種逆境脅迫。在植物遺傳轉化體系中,不同植物、不同材料對抗生素的敏感性不同。因此,進行選擇性抗生素的抗性試驗并篩選出適宜濃度,是轉基因進行的前提[13]。在抗生素的選擇上,卡那霉素與潮霉素較為常用,卡那霉素的應用更為普及。
本試驗結果表明,卡那霉素對楸樹組培苗生長有明顯的抑制作用,且與作用濃度呈負相關。潮霉素與卡那霉素對楸樹瓶苗的影響基本類似,但低質量濃度(1 mg/L)的潮霉素對繼代芽的分化有促進作用,抗生素對植物組培材料的分化有促進作用還未見報道。潮霉素對楸樹無性系2-8、1-4組培繼代分化各生長指標影響相同,說明試驗結論并非偶然,楸樹無性系繼代培養過程中,培養前期主要為莖段基部的愈傷組織膨大,隨著愈傷組織的形成與膨大,其他指標也開始迅速增長,當愈傷組織膨大到一定程度(一般在培養30~40 d)時開始褐化干枯,潮霉素可能阻止了愈傷組織釋放的酚類物質的氧化,延緩楸樹莖段基部愈傷組織的褐化干枯,提高芽的分化,其內在機理還有待深入研究。楸樹供試無性系對卡那霉素與潮霉素的耐受濃度一致,同等質量濃度的抗生素對2 種無性系的作用無顯著差異,敏感濃度相同,在楊樹[14]研究中涉及了不同樹種,表明耐受濃度不同,無性間還未見有其他研究報道。

表4 不同質量濃度的潮霉素和卡那霉素對楸樹無性系2-8生根苗培養性狀的影響

表5 不同質量濃度的卡那霉素對楸樹無性系1-4生根苗培養性狀的影響

表6 不同質量濃度的卡那霉素對楸樹無性系2-8、1-4生根苗培養性狀的影響方差分析(P值)
近年來,關于植物抗生素耐受性研究應用取得了一定的進展,以組培手段選擇抗生素耐受濃度在菊花、煙草、楊樹、川芎、黃瓜、大豆、蘋果[13-22]等植物中有研究報道,選擇的抗生素主要為卡那霉素與潮霉素。研究表明,抗生素對植物組培生長有明顯的抑制作用,本試驗結果與之吻合。不同植物、不同材料、不同培養階段的耐受濃度不同,大多植物材料對卡那霉素的敏感濃度為5.0~100 mg/L。30 mg/L 卡那霉素能夠明顯抑制菊花莖段的分化,10 mg/L 能夠抑制生根[15];卡那霉素與潮霉素對煙草葉片的分化抑制濃度均為30 mg/L[16];楊樹葉片、莖段對潮霉素的敏感濃度為1.0~6.0 mg/L[14,17],葉片對卡那霉素素的敏感濃度為20~40 mg/L[14,17-18];川芎的根、莖、葉對卡那霉素的耐受濃度為20~40 mg/L[13];以黃瓜種子為供試材料,魏愛民等研究認為,200 mg/L 的卡那霉素能夠抑制黃瓜幼苗的生長。本試驗研究材料為楸樹莖段,研究結論與大多研究報道基本一致。綜合來看,種子與莖段對抗生素的耐受性質量濃度稍高,葉片較低;植物對卡那霉素的耐受濃度高于潮霉素,這也說明潮霉素對楸樹組培苗的毒性較大。卡那霉素是目前應用較為廣泛的選擇抗生素,在植物組培應用篩選技術基本成熟的同時,也逐漸應用于田間轉基因植株的篩選,這在苜蓿、棉花、大豆、番茄、水稻、小麥等作物中有研究報道[19]。
蔣衛東[13]等認為,遺傳轉化體系中的篩選劑必須是植物細胞的抑制劑,但不可殺死細胞,轉化體系過程中低毒性化合物的選擇效果優于高毒性化合物,當選擇劑對植物細胞具有強毒害時,細胞將快速死亡,死亡或將死細胞對鄰近的細胞將產生抑制作用,使鄰近轉化細胞也受到抑制[20]。依此機理,作為選擇性抗生素,卡那霉素的毒性遠遠低于潮霉素,王丹[14]等對楊樹的研究也得到同樣結論,這也與本試驗結論一致。不同植物對抗生素的敏感性不同,這只是在少部分植物研究中有結論,大部分研究報道在抗生素選擇上局限于同一抗生素不同濃度的篩選,很少有不同抗生素針對同一植物的選擇研究。有必要拓展相關研究領域,為植物遺傳轉化體系奠定扎實的理論基礎與實踐經驗。
[1]于永明,王軍輝,馬建偉,等.LaCl3對楸樹無性系試管苗生長的影響[J].東北林業大學學報,2011,39(1):31-33.
[2]于永明,王軍輝,張宋智,等.二次回歸正交設計在楸樹離體生根培養中的應用[J].南京林業大學學報(自然科學版),2011,35(4):47-50.
[3]于永明,王軍輝,馬建偉,等.楸樹無性系離體培養特性差異研究[J].西北植物學報,2012,32(1):199-204.
[4]于永明,王軍輝,麻文俊,等.同一離體培養下梓樹屬不同種的反應差異[J].東北林業大學學報,2013,41(12):17-20.
[5]江榮翠,彭方仁,譚鵬鵬,等.楸樹體細胞胚胎發生的研究[J].南京林業大學學報(自然科學版),2010,34(2):15-18.
[6]甘肅省質量技術監督局.楸樹無性系組培快繁技術規程[S].DB62/T 2013-2011,2011-01-11.
[7]王坤波,張香娣,劉方,等.子葉期卡那霉素快速鑒定轉基因棉花[J].中國棉花,2001,(2):20-21.
[8]王紫萱,易自力.卡那霉素在植物轉基因中的應用及其抗性基因的生物安全性評價[J].中國生物工程雜志,2003,23(6):9-13.
[9]Pettinger R C,Wolfe R N,Hoehn M M,et al.Preliminary studies on the production and biological activity of a new antibiotic[J].Antibiot Chemother,1953,3:1268-1278.
[10]Gritz L,Davies J.Plasmid-encoded hygromycin B resistance:the sequence of hygromycin B phosphotransferase gene and its expression in Escherichia coli and Saccharomyces cerevisiae[J].Gene,1983,25(2-3):179-188.
[11]Kaster K R,Burgett S G,Rao R N,et al.Analysis of a bacterial hygromycin B resistance gene by transcriptional and translational fusions and by DNA sequencing[J]Nucleic Acids Res,1983,11(19):6895-6911.
[12]Rao R N,Allen N E,Hobbs J N Jr,et al.Genetic and enzymatic basis of hygromycin B resistance in Escherichia coli[J].Antimicrobial Agents Chemother,1983,24(5):689-695.
[13]蔣衛東,唐琳,楊蒼勁,等.卡那霉素對川芎愈傷組織誘導和生長的影響[J].河南農業科學,2007,(11):85-87.
[14]王丹,鄒莉,王義,等.楊樹對潮霉素的敏感性研究[J].吉林農業大學學報,2010,32(1):47-50.
[15]王沛,周洲,尹新明,等.不同質量濃度抗生素對菊花‘綠鸚哥’莖段組織培養的影響[J].河南農業大學學報,2010,44(1):96-99.
[16]李勝彬,胡根海,王清連.煙草葉片直接再生植株及抗生素耐受性研究[J].種子,2010,29(4):38-39.
[17]鄒莉,王丹,趙光潔,等.單倍體小黑楊對潮霉素的敏感性研究[J].林業科技,2008,33(4):7-9.
[18]程貴蘭,蔡智軍.卡那霉素對小黑楊花粉植株葉片分化及試管苗生根的影響[J].遼寧農業職業技術學院學報,2010,12(2):3-4.
[19]燕麗萍,夏陽,梁慧敏,等.卡那霉素葉片涂抹法田間篩選轉基因苜蓿的研究[J].中國農學通報,2009,25(14):22-26.
[20]魏愛民,張文珠,杜勝利,等.黃瓜花粉管通道法抗蟲基因導入及卡那霉素抗性篩選[J].華北農學報,2008,23(6):54-57.
[21]袁鷹,劉德璞,王玉民,等.卡那霉素對大豆生長的抑制及篩選試驗研究[J].大豆科學,2003,22(4):261-263.
[22]梁海永,姚偉明,杜鴻云,等.蘋果葉片再生體系建立研究[J].河北林果研究,2005,20(3):247-249.

