長春新堿對人骨肉瘤細胞的效應及其作用機制研究
婁 楠,王 洋,劉國雄,黃嵐峰
(1.深圳市龍華新區人民醫院,廣東 深圳518109;2.深圳市人民醫院;3.吉林大學第二醫院)
骨肉瘤的發病率近年來呈快速增長的趨勢,并且日益年輕化,骨肉瘤的惡性程度高,進展快,化療或放療效果欠佳,數月內即可出現肺部轉移預后較差[1]。尋找行而有效的骨肉瘤治療方案仍是目前研究的焦點。建立骨肉瘤細胞系是對骨肉瘤生物學特性的深入研究的好辦法。長春新堿(vincristine VCR)是一類二聚吲哚類生物堿,在治療惡性腫瘤方面具有顯著的療效,迄今為止仍是主要的抗腫瘤藥物之一[2-4],但其對骨肉瘤的應用研究尚不明確。因此本文以原代培養建立的骨肉瘤細胞系HOS細胞作為體外實驗的研究模型,分析VCR對細胞的增殖和凋亡的作用規律;檢測VCR對細胞內JunB及c-Jun基因表達的影響,進而闡述藥物作用的分子機理。
1 材料與方法
1.1 細胞及試劑RPMI-1640培養液 (Gibico USA),優等胎牛血清(Hyclone USA),CCK-8細胞活性檢測試劑盒及Hoechest 33342細胞凋亡檢測試劑盒(碧云天生物技術研究所),胰酶 (Promega USA),RNase free DNase I(Promega),Total RNA提取試劑盒(Invitr-ogen),實時熒光定量PCR試劑(ABI公司),RT-PCR試劑盒(TaKaRa),PCR引物由TaKaRa公司合成,長春新堿(哈爾濱醫大藥業有限公司)。
1.2 HOS的細胞培養及處理 標本離體后3h進行培養在無菌條件下將瘤組織置于培養皿中,先用Hanks液沖洗幾次,然后去除結締組織和壞死組織,將瘤組織剪成1-1.5mm3大小的組織塊,再將剪碎的組織放在不銹鋼網上(200目孔徑),用Hanks液洗去紅細胞及組織碎片,用貼壁方法將組織塊接種于培養瓶內,瓶底朝上,同時加入含20%小牛血清及青、鏈霉素各100g/ml的RPMI-1640培養液4ml中,置37℃培養箱內,90min后待組織塊粘貼瓶壁,再輕輕將培養瓶翻轉,使組織塊完全浸沒于培養液中培養。將指數增長期的HOS細胞以106個的密度接種于6cm培養皿中,繼續培養24 h,待細胞穩定生長后,分別加入0、5、10、20、50、100 μg.L-1不同濃度的VCR溶液,繼續培養24h,進行下述檢測。
1.3 細胞生長曲線的繪制 將指數生長期細胞接種于96孔培養板中,每孔接種1×103個細胞,分別標記不同的實驗分組,每組設6個平行孔。于5%CO2、飽和濕度、37℃條件下在細胞孵育箱內進行培養24h,再向孔板中加入10μl的細胞活性檢測試劑CCK-8溶液,孵育2h,然后測定490nm吸光度,進而繪制細胞的生長曲線。
1.4 凋亡的觀察 將細胞置于1.5mL的EP管中,用緩沖溶液PBS清洗3次,以去除培養基殘留,并加入相應濃度的凋亡檢測試劑Hoechst33342,繼續孵育30min后PS清洗3次,于熒光顯微鏡下觀察。
1.5 相關mRNA表達水平的檢測 按商品說明書進行總RNA的提取,對RNA進行RNase free DNase I處理,并將RNA逆轉錄為cDNA均。PCR引物序列:JunB上游引物,5’-CAG GCT ACC CCA ATG ATC C-3’;下 游 引 物,5’-CTT CCG CCT CTT TCT CCA GG-3’。GADD45上游引物,5’-GAG AGC AGA AGA CCG AAA GGA-3’;下游引物,5’-TGC TCC AGT AGT CTT TCA GGG AA-3’。內 參 RPL-13 上 游 引 物,5’-CGA GTT GGC TGG AAG TAC C-3’;下游引物,CTT CTG GCC TGT TTC CGT AG-3’。按照試劑盒說明書要求進行PCR反應。其相關程序為:50℃、2min;95℃、10min;95℃、15s,60℃、1min;95℃、15s,60℃、30 s,95℃、15s,40個循環。經融解曲線證實PCR反應產物的特異性。將檢測到的實驗組的Ct值,與內參的Ct值進行比較,兩者的差值即為該實驗組的△Ct值,即實驗組△Ct值=實驗組Ct值-內參組Ct值。同理可知對照組△Ct值=實驗對照組Ct值-內參對照組Ct值。通過實驗組△Ct值與對照組△Ct值的比較,得出實驗組各濃度的△△Ct值=實驗組△Ct值-對照組△Ct值。最后通過2(-△△Ct)來定量基因表達的改變。
1.6 統計學分析 采用SPSS10.0統計軟件進行統計分析,結果以±s表示,組間比較采用t檢驗。
2 結果
2.1 VCR改變HOS細胞增殖率 將濃度分別為1、2、5、10、20、50和100μg.L-1的 VCR 作用于HOS細胞24h后,我們可以發現,濃度為5μg.L-1時VCR可明確減低HOS細胞的增殖率(P<0.05),且呈明確的劑量-效應關系,即隨著濃度的增加抑制作用更顯著(圖1)。
2.2 VCR對HOS細胞凋亡的影響 將HOS細胞經凋亡檢測試劑Hoechst33342染色,來直觀反映VCR的效應。我們發現,活細胞胞核不染色或呈均勻淡染的藍色,核形態良好,而凋亡細胞胞核固縮,濃染,呈現較明亮的著色區。對照組內細胞均為活細胞,罕有凋亡細胞;而VCR作用后出現較多典型的凋亡細胞。
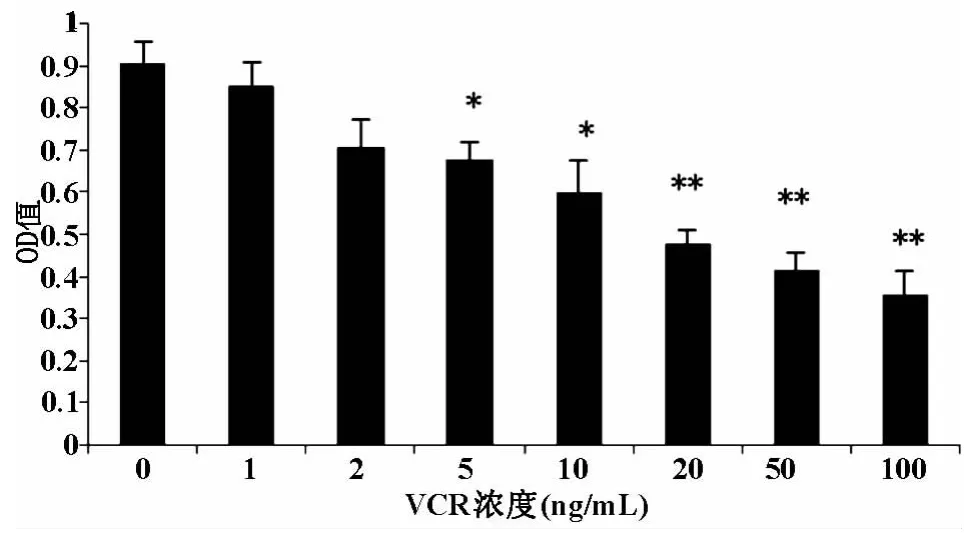
圖1 VCR可顯著抑制HOS細胞增殖
2.3 VCR改變了HOS細胞相關基因的表達 VCR在5和20μg.L-1濃度,JunB的mRNA表達量顯著減少(P<0.05),分別為對照組的(47.42±9.12)%和(19.07±10.97)%,呈顯著的劑量效應關系;而GADD45的mRNA表達量顯著上調(P<0.05),分別為對照組的0.95±0.07倍和2.45±0.09倍,呈明顯的濃度依賴關系。結果表明VCR可以通過下調JunB基因的表達,及上調GADD45基因的表達來抑制HOS細胞增殖并促進其凋亡(圖2)。
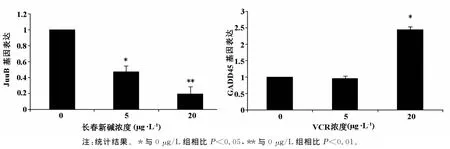
圖2 VCR顯著改變HOS細胞內JunB及GADD45的mRNA表達水平
3 討論
VCR具有一定的神經系統毒性以及局部組織刺激作用,這也在某種程度上限制了其大劑量在腫瘤治療方面的臨床應用于[5]。本研究分析了VCR對骨肉瘤HOS細胞的抑制增殖和促進凋亡作用并深入探討了其作用的分子機理。結果發現較低劑量(5μg.L-1)的VCR即可顯著抑制細胞的增殖并促進其凋亡。且這一劑量遠低于機體的中毒劑量(2 mg.kg-1),提示VCR在骨肉瘤化療應用方面具有一定的應用前景,這也為本研究前期實驗所證實[6]。
在細胞增殖的調控方面,JunB可以通過直接激活細胞周期蛋白cyclin A的轉錄來促進成骨細胞和成軟骨細胞生長[7]。在腫瘤發生發展的過程中,JunB的高表達可能起到幫助腫瘤細胞免疫逃脫的作用[8]。本研究結果顯示:VCR濃度為10μg.L-1時即可顯著抑制HOS細胞的增殖(P<0.05),且呈明確的劑量-效應關系;在5和20μg.L-1長春新堿作用下,MG63細胞內JunB的mRNA表達量均顯著減少(P<0.05),分別為對照組的47.42±9.12%和19.07±10.97%,呈明顯的濃度依賴關系。表明:VCR可以有效下調HOS細胞內JunB的mRNA表達量,使細胞增殖率顯著降低。這也提示JunB作為一種癌基因,在骨肉瘤的發生發展中起到促進作用,而VCR有效的抗骨肉瘤作用機制之一就是通過抑制細胞內JunB的表達來抑制增殖的。
細胞凋亡是化療藥物殺傷腫瘤細胞的重要機制。GADD45作為生長抑制及DNA損傷誘導基因家族的成員,對細胞凋亡、細胞周期阻滯及DNA修復都具有重要的作用[9,10]。本研究的結果顯示:VCR作用后細胞內開始出現一些散在分布的胞核固縮,濃染,呈現較明亮的著色區的凋亡細胞;GADD45的mRNA表達量顯著上調(P<0.05),分別為對照組的0.95±0.07倍和2.45±0.09倍,呈明顯的濃度依賴關系。因此我們認為,VCR可以顯著上調HOS細胞內GADD45的mRNA表達量,促進細胞發生凋亡。這也揭示出另一條VCR有效抗骨肉瘤的作用途徑。
綜上所述,VCR在較低濃度即可抑制骨肉瘤HOS細胞的增殖,且遠低于中毒劑量,這就表明其可能應用為骨肉瘤的一線化療藥物;而VCR有效的抗骨肉瘤作用機制之一就是通過抑制細胞內JunB的表達來抑制增殖的;同時VCR又可以顯著上調細胞內抑癌基因GADD45的表達,促進細胞發生凋亡,這也揭示出另一條有效的對抗骨肉瘤的作用途徑。
[1]MEYERS P A.Muramyl tripeptide(mifamurtide)for the treatmentof osteosarcoma[J].Expert Rev Anticancer Ther,2009,9(8):1035.
[2]祖元剛,羅 猛,牟 松,等.長春花生物堿成分及其藥理作用研究進展[J].天然產物研究與開發,2006,18:325.
[3]陳秀珍,朱大誠.長春新堿抗白血病作用的研究進展[J].時珍國醫國藥,2008,19(11):2720.
[4]ZuYG,FuYJ,LuoM,et al.Structure modification for reduced toxicity derivatives and anticancer activity of vinblastine[J].Chemistry Online,2004,67(4):w027.
[5]ZhengHZ,Dong ZH,She J,et al.Modernstudy of traditional Chinese medicine[M].Vol.Beijing:Academic Press,1991:1020-1035.
[6]劉國雄,婁 楠,王 洋,等.長春新堿對人成骨肉瘤 MG63細胞的增殖 抑制和凋亡促進作用及其機制[J].中國實驗診斷學,2013,17(9):1573.
[7]Andrecht S,Kolbus A,Schorpp M,et al.Cell cycle promoting activity of JunB through cyclin A activation[J].J Biol Chem,2002,277(39):35961.
[8]Nausch N,Schorpp M,Cerwenka A,et al.Cutting edge:the AP-1 subunit JunB determines NK cell-mediated target cell killing by regulation of the NKG2D-ligand RAE-1epsilon[J].J Immunol,2006,176(1):7.
[9]Miramar MD,Costantini P,Ravagnan L,et al.NADH oxidase Activity of mitochondrial apoptosis-inducing factor[J].J Biol Chem,2001,276(19):16391.
[10]Fornace AJ Jr,Nebert DW,Hollander MC,et al.Mammalian genes coordinately regulated by growth arrest signals and DNA-damaging agents[J].Mol Cell Biol,1989,9(10):4196.

