輻射對體外培養MC3T3-E1成骨前體細胞增殖和分化的影響
李玉梅 趙銥民 查年保 舒震 張松
1.襄陽市中心醫院口腔科,襄陽 441021;2.第四軍醫大學口腔醫院修復科;
3.第四軍醫大學藥學系生物技術中心,西安 710032;4.第四軍醫大學唐都醫院藥劑科,西安 710038
高劑量的放射治療會對正常的骨組織產生不良作用,如骨質疏松、放射性骨壞死、顱面部骨生長遲緩等。1983年,Marx[1]提出了被廣泛接受的骨壞死病理機制:即射線引起動脈內膜炎,接著發生組織缺氧、細胞數減少以及血管減少,最終出現慢性不愈合的傷口。其后學者們的研究更加關注于骨細胞,并認為骨細胞的改變要先于血管,而骨重建的抑制是發生骨壞死的關鍵所在[2]。本文擬從MC3T3-E1成骨前體細胞入手,探討60Co γ射線對成骨細胞增殖和分化的影響,為輻射骨損傷的防治提供理論依據。
1 材料和方法
1.1 主要試劑與儀器設備
α-MEM培養基(HyClone公司,美國),新生牛血清(杭州四季青生物工程材料有限公司),β-磷酸甘油、抗壞血酸(西安沃爾森生物技術有限公司),3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑噻藍 [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylte-trazolium bromide,MTT](西安科昊生物工程有限責任公司);黏膠纖維紅(Sigma公司,美國),茜素紅(西安舟鼎國生物技術有限公司);實時熒光定量聚合酶鏈反應(real time fluorescence quantitative polymerase chain reaction,qPCR)相關試劑(TaKaRa公司,日本);酶標儀(BIO-TEK公司,美國);60Co源(第四軍醫大學鈷源室);7500型qPCR儀(ABI公司,美國),基因擴增儀(東勝創新生物科技有限公司)。
1.2 細胞培養及成骨誘導
采用MC3T3-E1成骨前體細胞系亞克隆14(上海中科院細胞庫)進行實驗。使用含10%新生牛血清、100 IU·mL-1青霉素和100 μg·mL-1鏈霉素的α-MEM培養基,置于37 ℃、5%CO2、飽和濕度條件下培養,常規換液與傳代。用成骨誘導培養基誘導細胞成骨。成骨誘導培養基:在上述培養基里添加5 mmol·L-1的β-磷酸甘油和50 μg·mL-1抗壞血酸。
1.3 細胞輻射
MC3T3-E1細胞接種24 h后進行60Co γ射線照射。單次照射劑量分別為4、8 Gy,換液后繼續培養觀察。對照組帶入準備室,但不接受照射。
1.4 細胞增殖實驗
細胞以每孔1.5×103個的密度接種于96孔板,培養24 h后分別接受4、8 Gy射線照射。照射后1、3、5、7 d終止培養,PBS漂洗1次,每孔加入20 μL MTT(5 g·L-1)和200 μL無血清α-MEM培養基。37 ℃孵育4 h后吸棄上清,每孔加入150 μL二甲基亞砜溶解生成的結晶物,室溫下振蕩20 min,然后置于分光光度儀上于490 nm處測量其光密度(optical density,OD)值。
1.5 細胞膠原分泌的測定
使用黏膠纖維紅染色法測定膠原分泌[3]。細胞以每孔7.5×104個的密度接種于6孔板,培養24 h后接受4、8 Gy射線照射。細胞接近融合后更換為成骨誘導培養基。輻射后第12天終止細胞培養,4%多聚甲醛固定30 min,PBS漂洗3遍。0.1%黏膠纖維紅(溶于飽和苦味酸)染色18 h,鹽酸漂洗,細胞照相。定量分析時,加入氫氧化鈉溶解染色,570 nm處測量OD值。
1.6 成骨相關基因mRNA表達的測定
采用qPCR法檢測4種成骨相關基因mRNA的表達,分別為Runt相關轉錄因子2(Runt-related transcription factor 2,RUNX2)、轉錄因子Osterix(OSX)、骨橋蛋白(osteopontin,OPN)和骨鈣素(osteocalcin,OCN)。細胞以每孔7.5×104個的密度接種于6孔培養板,培養24 h后分別接受4、8 Gy射線照射。細胞接近融合后更換為成骨誘導培養基。輻射后第16天終止細胞培養,PBS漂洗后用適量Trizol裂解細胞,按試劑盒描述的步驟提取總RNA并定量。取1.0 μg總RNA,按照Prime Script RT reagent Kit說明進行逆轉錄,條件為:37 ℃ 15 min,85 ℃ 5 s。配制qPCR反應液,所使用的引物見表1,使用甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作為內參,置于7500型qPCR儀內進行反應。采用2-ΔΔCt法對數據進行相對定量分析,0 Gy組數據作為校正樣本。

表1 qPCR所使用的引物Tab 1 Primers used for qPCR
1.7 細胞基質礦化測定
使用茜素紅染色測定細胞基質礦化情況。細胞以每孔5×104個的密度接種于6孔板,培養24 h后接受4、8 Gy射線照射。細胞接近融合后更換為成骨誘導培養基。輻射后第28天終止細胞培養,PBS漂洗2次,75%乙醇固定1 h。40 mmol·L-1茜素紅染液(pH=4.2)室溫染色20 min,PBS漂洗5次后10%氯化十六烷基吡啶溶解染色,置于分光光度儀上于570 nm處測OD值。
1.8 統計學分析
使用SPSS 16.0統計分析軟件,采用單因素方差分析(one-way ANOVA)比較各組均數之間有無差異,Tukey顯著差異法進行均數之間的兩兩比較,檢驗水準為雙側α=0.05。
2 結果
2.1 細胞增殖實驗
細胞增殖實驗結果見表2。與未輻射組相比,從輻射后第3天開始,4、8 Gy的輻射劑量均導致MC3T3-E1細胞的增殖明顯降低(P<0.05),并且這種降低呈現劑量依賴性。
2.2 細胞膠原分泌
經不同劑量的輻射后,MC3T3-E1細胞膠原分泌的染色情況見圖1:隨輻射劑量的增加,染色強度逐漸降低。對照組(0 Gy)、4 Gy和8 Gy組膠原定量分析的OD值分別為1.368±0.208、1.059±0.169和0.856±0.078,3組間的差異有統計學意義(F=7.738,P=0.022),8 Gy組明顯低于對照組。
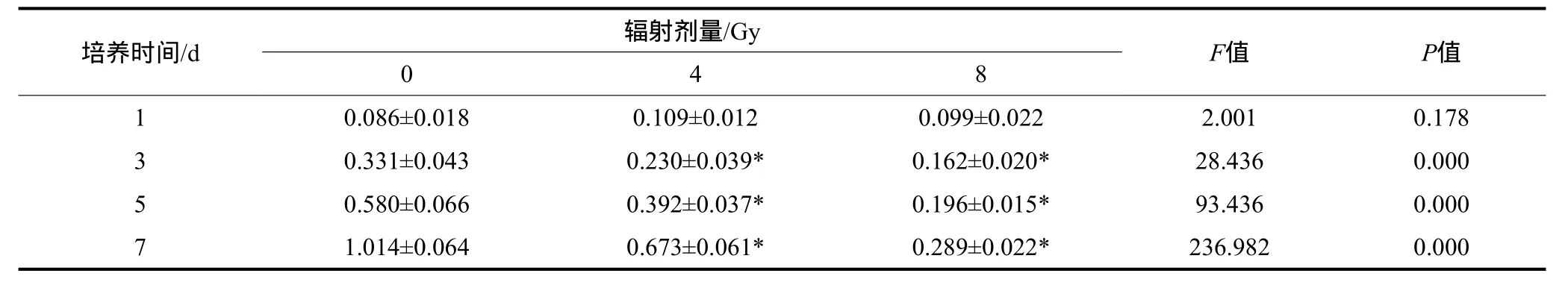
表2 經不同劑量輻射后細胞MTT實驗的OD值Tab 2 The OD value of cells in MTT assay under different radiation doses
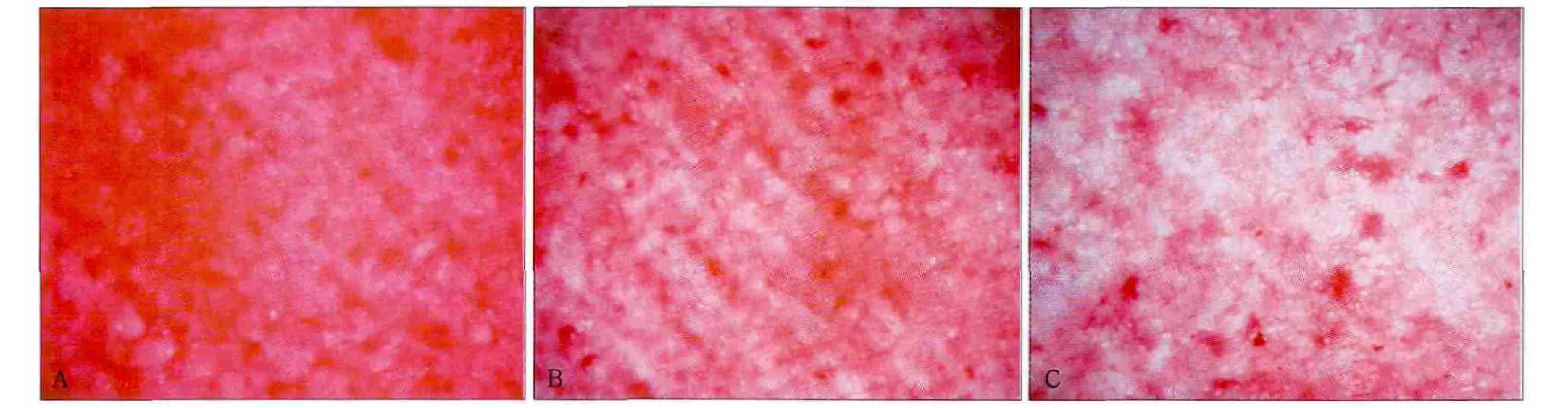
圖1 經不同劑量輻射后細胞的膠原分泌 黏膠纖維紅染色 × 6.3Fig 1 Collagen secretion by cells under different radiation doses sirius red staining × 6.3
2.3 成骨相關基因mRNA的表達
4種成骨相關基因的表達見表3:4 Gy以上射線可以明顯抑制MC3T3-E1細胞OSX和OCN基因的表達(P<0.05),但對RUNX2基因無明顯影響(P>0.05);8 Gy射線可輕微下調細胞OPN基因的表達,但與對照組相比差異并無統計學意義(P>0.05)。

表3 經不同劑量輻射后細胞成骨相關基因的表達Tab 3 Expression of osteogenesis-related genes of cells under different radiation doses
2.4 細胞基質礦化
對照組(0 Gy)、4 Gy和8 Gy組細胞基質礦化定量分析的OD值分別為2.155±0.257、1.728±0.265、1.485±0.042,3組差異有統計學意義(F=7.497,P=0.023),隨著射線劑量增大細胞基質礦化降低,8 Gy照射組與對照組相比差異有統計學意義(P<0.05)。
3 討論
MC3T3-E1成骨前體細胞系來源于新生小鼠顱頂骨,在體外可以分化為骨細胞,是較常用的研究射線對成骨細胞影響的細胞系之一[4]。檢測射線對細胞增殖影響的主要方法有克隆形成實驗、MTT法、細胞計數以及DNA含量測定等。MTT實驗是測試射線對細胞活性影響可靠、方便的方法之一。通過MTT實驗,本研究發現,從輻射后第3天開始,4 Gy以上的輻射劑量顯著降低了MC3T3-E1細胞的增殖,與以往文獻[4-6]報道一致。
骨的有機成分主要是Ⅰ型膠原,而黏膠纖維紅染色能特異性檢測Ⅰ型和Ⅲ型膠原,并能夠在原位確定產生膠原的細胞[3]。本研究顯示,8 Gy射線顯著抑制了MC3T3-E1細胞膠原分泌,與Gal等[6]的研究結果類似。本研究采用茜素紅染色及定量分析對MC3T3-E1細胞基質礦化能力進行檢測,結果表明,8 Gy射線導致細胞礦化能力顯著降低。Gevorgyan等[7]研究證明,15 Gy射線可引起兔眶顴復合體骨膜來源成骨細胞礦化能力明顯下降。
本研究進一步探討了射線對于MC3T3-E1細胞成骨相關基因表達的影響。RUNX2是與果蠅蛋白Runt同源的成骨相關轉錄因子,可與成骨特異順式作用元件結合,調節OCN、Ⅰ型膠原α1鏈(collagen type Ⅰα1-chain,Col-Ⅰα1)和OPN基因的表達。本研究表明,在輻射后第16天,8 Gy射線并沒有引起RUNX2基因mRNA水平的改變;Sch?nmeyr等[8]的研究也得出相似的結論。OSX是另一個重要的成骨相關轉錄因子,位于RUNX2的下游。在多能間充質干細胞向前成骨細胞分化過程中,RUNX2起了重要作用,而在其后的調控前成骨細胞向成熟成骨細胞分化的過程中,RUNX2的表達下調,OSX則成為主要的作用基因[9]。本研究發現,4 Gy以上射線顯著抑制了細胞OSX基因的表達,由此推測,射線有可能在成骨過程的中晚期通過下調OSX基因的表達來抑制細胞的分化能力。OPN是一種酸性糖蛋白,在成骨細胞增殖期有低表達,隨后下降;在細胞礦化起始期(第16~20天)第2次表達并達到峰值。OCN在礦化結節形成時才開始表達,是成骨細胞成熟的標志[10]。本研究顯示,射線可抑制OCN基因的表達,隨著射線劑量的增加,抑制作用增強,與其他文獻[5,11]報道一致。對于OPN基因,射線并無明顯下調作用。Matsumura等[11]發現,MC3T3-E1細胞接受10 Gy射線照射后,輻射后第16天OPN的表達與未照射組相比無明顯改變。
本研究從細胞和分子層面揭示了輻射骨損傷發生的可能機制,證實60Co γ射線可以降低MC3T3-El成骨前體細胞的增殖、膠原分泌及基質礦化能力,并可下調其成骨相關基因的表達。
[1]Marx RE. A new concept in the treatment of osteoradionecrosis[J]. J Oral Maxillofac Surg, 1983, 41(6):351-357.
[2]Al-Nawas B, Duschner H, Gr?tz KA. Early cellular alterations in bone after radiation therapy and its relation to osteoradionecrosis[J]. J Oral Maxillofac Surg, 2004, 62(8):1045.
[3]Tullberg-Reinert H, Jundt G. In situ measurement of collagen synthesis by human bone cells with a sirius red-based colorimetric microassay: effects of transforming growth factor beta2 and ascorbic acid 2-phosphate[J]. Histochem Cell Biol,1999, 112(4):271-276.
[4]Dare A, Hachisu R, Yamaguchi A, et al. Effects of ionizing radiation on proliferation and differentiation of osteoblastlike cells[J]. J Dent Res, 1997, 76(2):658-664.
[5]Gevorgyan A, Sukhu B, Alman BA, et al. Radiation effects and radioprotection in MC3T3-E1 mouse calvarial osteoblastic cells[J]. Plast Reconstr Surg, 2008, 122(4):1025-1035.
[6]Gal TJ, Munoz-Antonia T, Muro-Cacho CA, et al. Radiation effects on osteoblasts in vitro: a potential role in osteoradionecrosis[J]. Arch Otolaryngol Head Neck Surg, 2000, 126(9):1124-1128.
[7]Gevorgyan AM, La Scala GC, Sukhu B, et al. Radiationinduced craniofacial bone growth inhibition: in vitro cytoprotection in the rabbit orbitozygomatic complex periosteumderived cell culture[J]. Plast Reconstr Surg, 2008, 121(3):763-771.
[8]Sch?nmeyr BH, Wong AK, Soares M, et al. Ionizing radiation of mesenchymal stem cells results in diminution of the precursor pool and limits potential for multilineage differentiation[J]. Plast Reconstr Surg, 2008, 122(1):64-76.
[9]Zhang C. Transcriptional regulation of bone formation by the osteoblast-speci fi c transcription factor Osx[J]. J Orthop Surg Res, 2010, 5:37.
[10]Lian JB, Stein GS. Concepts of osteoblast growth and differentiation: basis for modulation of bone cell development and tissue formation[J]. Crit Rev Oral Biol Med, 1992, 3(3):269-305.
[11]Matsumura S, Hiranuma H, Deguchi A, et al. Changes in phenotypic expression of osteoblasts after X irradiation[J].Radiat Res, 1998, 149(5):463-471.

