大黃酸對乳腺癌腫瘤細胞中HER-2蛋白表達的影響
陳 海 戚曉東 邱 萍
乳腺癌是臨床常見惡性腫瘤之一,近年來,其發病率呈明顯上升趨勢,嚴重威脅患者的身心健康甚至是生命。原癌基因人類表皮生長因子受體2(human epidermalgrowth factor receptor-2,HER-2)是1種原癌基因,在多種上皮源性腫瘤具有異常擴增以及過表達現象,證實HER-2在腫瘤的發生及發展過程中具有重要意義[1]。大黃酸(Rhein)是傳統中藥大黃有效成分中大黃蒽醌類化合物的一種,目前已有大量研究資料表明,其具有誘導腫瘤細胞凋亡、預防腎小球硬化、抗炎、治療糖尿病深度以及保護肝抗纖維化等作用[2]。本研究擬用大黃酸干預人乳腺癌腫瘤細胞,并觀察其對HER-2蛋白表達的影響,旨在為臨床應用大黃酸治療乳腺癌的提供實驗以及理論依據。
1 材料與方法
1.1 主要材料
人乳腺癌SK-Br-3細胞株選自中科院上海細胞庫。大黃酸選自天津藥品檢驗所,純度在98%以上。細胞培養基DMEM選自Gibco公司;胎牛血清均選自中科院醫學生物工程研究所TBD公司;MTT、二甲基亞砜(DMSO)、明膠以及Ⅰ型膠原酶均選自Sigma公司。抗HER-2單克隆抗體選自NeoMarkers公司。DNAThennal Cycler型PCR擴增儀(Perkin Elmer公司),DU800型核酸/蛋白分析儀(Beckman公司),Galaxy B型CO2培養箱(RS Biotech公司),Multiskan MK3型酶標儀(Thenno Labsystenls公司),Pharmacia KB Multiple Ⅱ蛋白電泳系統(Pharmacia公司),LX-70型倒置熒光顯微鏡(Olympus公司)。
1.2 方法
1.2.1 細胞培養 將SK-Br-3細胞株置于無菌離心管之中,加入3 ml培養基懸浮細胞,然后在室溫下于1 000 r/min轉速下離心分離10 min,棄去上清液,然后加入15%的胎牛血清的DMEM培養基中,于37 ℃及含5%CO2的條件下進行培養,每3 d進行1次傳代,1瓶細胞可獲得傳代2瓶。
1.2.2 細胞增殖活性實驗 經培養的SK-Br-3細胞株按照4×103個細胞/孔將其接種于96孔細胞培養液中進行培養,24 h后待貼壁細胞生長良好以后,加入不同濃度(0、20、40和80 μmol/L)的大黃酸,繼續培養0 h、24 h、48 h以及72 h后進行MTT檢測。吸出上清液,然后加入20 μl 0.5 g/L的MTT,置于37 ℃下含有5%CO2培養箱中繼續培養4 h,再次吸出上清液,再加入200 μl DMSO,充分振蕩結晶以后應用酶標儀測定570 nm處吸光度(A)。實驗設置無藥對照孔以及無細胞對照孔,每組均設置3孔平行樣。細胞生長抑制率=(1-藥物組A/對照組A)×100%。
1.2.3 蛋白質提取以及Western blot檢測 對分別應用20、40和80 μmol/L的大黃酸處理48 h以及未加藥物處理的SK-Br-3細胞,采用預冷1×PBS洗滌3遍,然后加入100 ml新制細胞裂解液(50 mmol/L Tris-Hcl+150 mmol/L NaCl+1% NP-40+1 mmol/L NaF+1 mmol/L Na3VO4+10 g/L 亮抑酶肽+1% 抑蛋白酶肽+1 mmol/L 苯甲基磺酰氟),將裂解液與細胞充分混勻,置于冰浴下處理20 min,然后在4℃轉速為13 000 r/min下離心分離15 min。取上清液置于微量離心管中,采用BCA法進行蛋白含量測定,并調整各標本中的蛋白含量一致。按照測定的濃度進行蛋白上樣量調整,加入1/4體積(6 μL)5×上樣緩沖液,予以煮沸變性處理5 min,然后應用10% SDS-PAGE膠電泳。完成電泳后,將其轉移至硝酸纖維素膜致傷,應用1%的BSA進行封閉處理1 h,應用一抗在4 ℃下孵育過夜,然后再加入相應的二抗孵育處理2 h。將化學發光劑滴至膜上,操作按照說明書進行。拍攝凝膠成像并分析條帶灰度值。以條帶與β-actin灰度值之比作為其蛋白相對表達量。
1.2.4 RNA提取及PCR測定 取對數生長期腫瘤細胞接種在6孔板上,分別加入不同濃度大黃酸(0、20、40和80 μmol/L)處理0、24、48、72 h,提取細胞中的總RNA,并測定吸光度。采用兩步法PT-PCR進行擴增處理,檢測HER-2 mRNA表達情況。PCR擴增條件:94 ℃腺癌變性處理30 s,57 ℃復性處理30 s,72 ℃延伸處理30 s,重復30次。引物片段:HER-2的上游引物為5′-ACA CTG ATA GAC ACC AAC CGC TC-3′,長度為379 bp,下游引物為5′-CGT CGT AGA AAG GTA GTAGTAGG-3′。
1.3 統計學分析
2 結果
2.1 大黃酸對腫瘤細胞增殖的抑制作用
作用時間相同,隨著大黃酸濃度的增高,細胞抑制率呈顯著上升趨勢;大黃酸濃度相同情況下,隨著作用時間的延長,其細胞抑制率顯著升高(P<0.05),見表1。
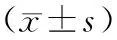
表1 大黃酸對腫瘤細胞增殖的抑制作用
注:a為與對照組比較,P<0.05;b為與作用24 h比較,P<0.05;c為與作用48 h比較,P<0.05。
2.2 不同濃度大黃酸對乳腺癌中HER-2表達的影響
經濃度分別為0、20、40和80 μmol/L的大黃酸干預處理48 h后,檢測細胞中HER-2蛋白表達水平,結果顯示,對照組呈高表達,而藥物組HER-2表達隨著大黃酸濃度的增高而下降,見表2。
2.3 大黃酸作用不同時間對乳腺癌細胞中HER-2蛋白表達的影響
40 μmol/L大黃酸處理0 h、2 h、48 h以及72 h后檢測HER-2 mRNA及蛋白表達情況。對照組HER-2呈高表達,經大黃酸處理后,HER-2的mRNA及蛋白表達水平均降低,且隨著藥物作用時間的不斷延長,HER-2 mRNA及其蛋白表達水平呈下降趨勢,見表3。
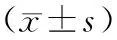
表2 不同濃度大黃酸對乳腺癌細胞中HER-2表達的影響
注:a為與對照組比較,P<0.05;b為與20 μmol/L比較,P<0.05;c為與 40 μmol/L比較,P<0.05。
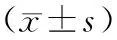
表3 大黃酸作用不同時間對乳腺癌細胞中HER-2蛋白表達的影響
注:a為與對照組比較,P<0.05;b為與作用24 h比較,P<0.05;c為與作用48 h比較,P<0.05。
3 討論
近年來,隨著醫療技術的發展及各類化療藥物的問世,乳腺癌的臨床療效獲得了一定程度的改善,但由于手術創傷、化療副作用等,總體有效率仍較低。故尋找1種新的合理有效的化療藥物治療乳腺癌,提高臨床療效、改善患者的生存質量尤為迫切。
大黃酸是中藥大黃的主要活性成分,具有抗菌、抗炎、抗病毒以及抗腫瘤等多種藥理活性,特別是其抗腫瘤作用機制受到了廣泛關注。相關研究資料證實,大黃酸對于多種惡性腫瘤細胞具有生長抑制作用,例肺癌、結腸腺癌、舌癌、卵巢癌以及鼻咽癌等[3]。此外,大黃酸聯合MMC能夠有效抑制腫瘤細胞中核苷的跨膜轉運,從而起到抗癌的作用[4]。本研究發現,應用不同濃度的大黃酸處理乳腺癌SK-Br-3細胞,對細胞的增殖具有明顯抑制作用。例如在相同作用時間下,不同濃度大黃酸對SK-Br-3細胞生長的抑制率隨濃度的增加而增加,存在劑量依賴性;而在相同濃度下應用大黃酸對SK-Br-3細胞處理24 h、48 h和72 h后,SK-Br-3細胞的抑制率也呈現增加的趨勢,呈現時間依賴性。認為大黃酸能夠有效抑制人乳腺癌SK-Br-3的增殖,并且具有時間-劑量依賴性。
HER-2屬于1種腫瘤表面抗原,臨床研究表明,約有20%~80%左右的晚期乳腺癌患者具有HER-2過度表達現象,這類患者不僅病情發展迅速,且對于傳統化療藥物具有明顯的耐藥性,極易發生化療失敗,臨床預后較差,治療后復發以及轉移率較高[5]。大部分學者認為HER-2的擴增以及過表達現象與乳腺癌的發生、發展以及惡性生物學行為具有密切關系。李慧慧等[6]應用熒光原位雜交法對328例乳腺癌患者的石蠟標本進行HER-2基因擴增檢測,結果顯示,HER-2表達陽性率為26.2%,且HER-2表達與乳腺癌臨床分級、病理類型、腫瘤直徑以及腋淋巴結轉移數均具有顯著相關性。Duchnowska[7]認為,HER-2表達水平越高,晚期乳腺癌腦轉移風險也將隨之增加。本研究亦顯示,在人乳腺癌腫瘤細胞SK-Br-3中,HER-2蛋白以及mRNA均呈現高表達,與相關報道的基本一致。故認為以HER-2為乳腺癌治療靶點,通過封閉HER-2蛋白的轉錄及表達。
林雅軍等[8]研究發現,大黃酸能夠抑制乳腺癌腫瘤細胞系MCF-7、MCF-7/ADR、MDA-MB-231以及SK-Br-3細胞EGFR以及HER-2蛋白以及mRNA表達水平,且呈現劑量依賴性。本研究亦顯示,應用大黃酸處理SK-Br-3細胞后,HER-2 mRNA及蛋白表達明顯降低,且隨著作用時間延長以及作用濃度的增加而降低。提示大黃酸能夠下調SK-Br-3 mRNA及蛋白表達,從而起到抑制瘤細胞增殖的作用。細胞增殖抑制作用檢測亦顯示,在相同的作用時間下,大黃酸濃度為20、40和80 μmol/L時,細胞抑制率呈顯著上升趨勢;在相同濃度下,隨著時間的延長,抑制率顯著升高。認為大黃酸能夠通過干預SK-Br-3細胞的HER-2信號分子表達,從而起到降低腫瘤的惡性表型,抑制癌細胞增殖的作用,可作為乳腺癌治療的新途徑[9]。Lin等[10]認為,大黃酸能夠利用線粒體以及Caspase通路而誘導腫瘤細胞的凋亡。因大黃酸能夠提高細胞內鈣離子以及活性氧自由基的聚集,降低線粒體的膜電位,從而促進細胞凋亡誘導因子的釋放,促進腫瘤細胞的凋亡。因此,抑制HER-2蛋白及mRNA表達是大黃酸誘導人乳腺癌SK-Br-3細胞凋亡的主要通路。
綜上所述,HER-2高表達與乳腺癌的發生及發展密切相關,而大黃酸能夠下調人乳腺癌SK-Br-3的蛋白及mRNA表達,有效抑制人乳腺癌SK-Br-3細胞的增殖,并且具有時間-劑量依賴性,可作為乳腺癌治療的新途徑。
[1] 江澤飛,邵志敏,徐兵河,等.人表皮生長因子受體2陽性乳腺癌臨床診療專家共識〔J〕.中華腫瘤雜志,2010,32(2):158-160.
[2] 洪 蔭,涂 健,朱 旬,等.乳腺癌組織中E-cad表達與EGFR、HER-2表達的關系〔J〕.臨床與實驗病理學雜志,2013,29(11):1239-1241.
[3] 李曉紅,李 蒙,陶艷蓉,等.大黃酸及其衍生物藥理作用研究新進展〔J〕.現代藥物與臨床,2010,25(6):417-421,452.
[4] 陳 軍,胡永均,張桃華,等.Her-2/neu和CD138在乳腺癌中表達及意義〔J〕.中國實驗診斷學,2013,17(10):1791-1794.
[5] 玄東春,金文彪,崔 海,等.Her-2與ALDH1在乳腺癌中表達與相關性研究〔J〕.現代儀器與醫療,2012,18(6):26-29,33.
[6] 李慧慧,馬 飛,曾 瑄,等.乳腺癌HER-2的表達與臨床病理特征的關系〔J〕.中華醫學雜志,2011,91(2):76-80.
[7] Duchnowska R,Biernat M,Szostakiewicz B,et al.Correlation between quantitative HER-2 protein expression and risk for brain metastases in HER-2 + advanced breast cancer patients receiving trastuzumab-containing therapy〔J〕.The oncologist,2012,17(1):26-35.
[8] 林雅軍,甄永蘇.大黃酸對腫瘤細胞EGFR和HER-2靶點的作用及其作用機制〔J〕.癌癥進展,2008,6(3):338.
[9] 柳光宇,王玉潔.新輔助療法:乳腺癌抗HER-2靶向治療的試金石〔J〕.中國癌癥雜志,2013,23(8):584-589.
[10] Lin YJ,Zhen YZ,Zhao YF,et al.Rhein lysinate induced S-phase arrest and increased the anti-tumor activity of 5-FU in HeLa cells 〔J〕.Am J Chin Med,2011,39(4):817-825.

