美羅華聯合米托蒽醌治療惡性淋巴瘤的療效觀察
何學鵬 楊 凱 陳 鵬 劉 兵 張 媛 王 芳 郭 智 劉曉東 樓金星 陳惠仁
淋巴瘤是以無痛性淋巴結腫大,肝脾腫大,伴發熱、盜汗、消瘦、瘙癢等全身癥狀為主要表現[1]。惡性淋巴瘤是具有相當異質性的一大類腫瘤,雖然好發于淋巴結,但是由于淋巴系統的分布特點,使得淋巴瘤屬于全身性疾病,幾乎可以侵犯到全身任何組織和器官。因此,惡性淋巴瘤的臨床表現既具有一定的共同特點,同時按照不同的病理類型、受侵部位和范圍又存在著很大的差異。淋巴瘤具有高度異質性,故治療上也差別很大,其治療方法主要有以下4種[2],具體實施,還需因人而宜選擇治療方法。現將我院自2012年3月至2013年11月收治的60例惡性淋巴瘤患者為研究對象,全部患者均經臨床病理和實驗室檢查確診。以觀察美羅華聯合米托蒽醌治療惡性淋巴瘤的臨床效果。
1 資料與方法
1.1 一般資料
以2012年3月至2013年11月收治的60例惡性淋巴瘤患者作為研究對象,患者均經臨床病理和實驗室檢查確診。其中男性38例,女性22例,年齡37~78歲,平均年齡(56.2±4.2)歲,病程1~3年,平均病程(2.7±0.9)年,將60例患者隨機分為米托蒽醌組(29例),美羅華聯合米托蒽醌組(31例)。其中,米托蒽醌組男性18例,女性11例,平均年齡(57.1±3.2)歲,平均病程(2.6±1.3)年;美羅華聯合米托蒽醌組男性20例,女性11例,平均年齡(59.4±4.7)歲,平均病程(2.6±1.8)年,兩組患者性別、年齡、病程等一般性資料經統計學處理,無顯著性差異(P>0.05),具有可比性,見表1 。

表1 兩組患者一般資料比較(例,%)
1.2 方法
米托蒽醌組患者采用米托蒽醌、依托泊苷和地塞米松治療。美羅華聯合米托蒽醌組在前者治療的基礎上加用美羅華治療。兩組患者均化療4個周期后進行療效評價。
1.3 觀察指標
觀察兩組采用不同藥物進行治療后完全緩解率(CR)及總生存率(OS)等指標,以觀察其臨床治療效果。
1.4 統計學處理

2 結果
美羅華聯合米托蒽醌組的完全緩解率[(CR)87.3%]明顯高于米托蒽醌組(68.1%),差異具有統計學意義(P<0.05);兩組1年總生存率(OS)、2年OS、3年OS相比較,差異均具有統計學意義(P均<0.05),見表2。
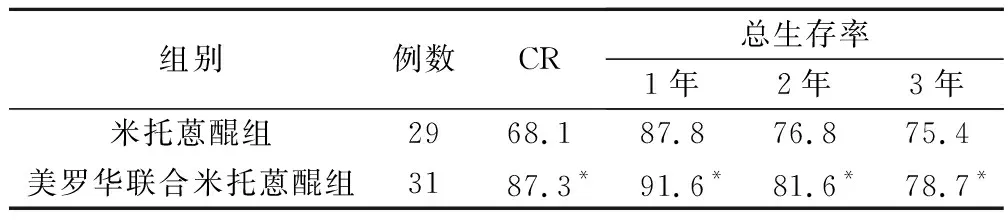
表2 2組療效及生存率比較/%
注:*為與米托蒽醌組相比較,P<0.05。
3 討論
淋巴瘤臨床表現多樣,雖然可以有慢性、進行性、無痛性淋巴結腫大,但也可以表現為其他系統受累或全身癥狀[3]。局部表現 包括淺表及深部淋巴結腫大,多無痛、表面光滑、活動,捫之質韌、飽滿、均勻,早期活動,孤立或散在于頸部、腋下、腹股溝等處,晚期則互相融合,與皮膚粘連,不活動,或形成潰瘍。惡性淋巴瘤在發現淋巴結腫大前或同時可出現發熱、瘙癢、盜汗及消瘦等全身癥狀。主要表現在免疫、血液系統[4]。其中10%~20%患者可有貧血,部分患者可有白細胞計數、血小板增多,血沉增快,個別患者可有類白血病反應,中性粒細胞明顯增多[5]。惡性淋巴瘤診斷時乳酸脫氫酶的升高與腫瘤負荷有關[6]。惡性淋巴瘤患者可有一系列非特異性皮膚表現。有全身癥狀較無全身癥狀為差。兒童及老年預后一般比中青年為差;女性治療后較男性為好[7]。部分高度惡性淋巴瘤對放化療敏感,經合理治療,生存期也能夠得到明顯延長。
本研究結果顯示,完全緩解率(CR)美羅華聯合米托蒽醌組與米托蒽醌組比較有顯著性差異(P<0.05)。兩組患者各年OS比較,也有顯著性差異(P<0.05)。美羅華聯合米托蒽醌組治療惡性淋巴瘤的療效顯著,優于單獨使用,不良反應較少,值得在臨床中大力展開。
[1] 劉紅巖,宋 敏,趙 紅.美羅華治療惡性淋巴瘤1例臨床觀察〔J〕.沈陽醫學,2004,24(4):165-166.
[2] 張應潮,王桃仙.國產米托蒽醌治療惡性淋巴瘤30例Ⅱ期臨床報告〔J〕.腫瘤防治,2010,1:44-46.
[3] 張 蕊,于錦香,李 艷,等.氟達拉濱聯合米托蒽醌與CHOP方案治療惡性淋巴瘤的療效比較〔J〕.中國實用內科雜志,2007,27(11):851-852.
[4] 劉倩平,魏 濤,鄒三鵬,等.氟達拉濱聯合米托蒽醌與CHOP方案治療惡性淋巴瘤的療效及安全性〔J〕.當代醫學,2012,18(17):136-137.
[5] 王 琛,夏堪冀,王 玲,等.氟達拉濱聯合米托蒽醌、地塞米松治療惰性淋巴瘤的臨床觀察〔J〕.重慶醫學,2010,39(12):1520-1521.
[6] Xie Bin,Yu Da jun.On liver yin deficiency in the pathogenesis of type 2 diabetes mellitus status〔J〕.Liaoning Journal of traditional Chinese medicine,2011(11):58-60.
[7] 葉瑩瑩,鄧瑋華.美羅華治療惡性淋巴瘤不良反應觀察及護理〔J〕.基層醫學論壇,2009,10(3):34-35.

