SiRNA沉默TRPC1基因對肺腺癌A549細胞增殖和侵襲的影響觀察
金 丹 吳明勇 劉建剛 袁淑芬 陳曉品
肺癌是我國目前發病率較高的癌癥之一,根據相關調查,男性的發病率高于女性,肺癌已經成為男性發病和死亡率最高的癌癥。最近幾年,肺癌的臨床治療的研究目標集中在基因水平上的靶向治療。根據研究[1],TRPC1是第一個哺乳動物電位受體蛋白,屬于非選擇性陽離子蛋白通道,對癌癥細胞的增殖和侵襲等多種癌癥細胞的惡性行為產生一定的影響。我院針對SiRNA沉默TRPC1基因對肺腺癌A549細胞增殖和侵襲的影響效果展開實驗研究,取得的效果比較滿意,現在將研究結果總結報告如下。
1 材料與方法
1.1 臨床材料
主要材料:實驗室保存的在37℃下、5% CO2的細胞培養箱中、RPMI-1640培養液中培養的肺腺癌A549細胞,美國Sigma公司生產的MTT,美國Abcam公司生產的抗人TRPC1的一抗,美國Gibco公司生產的RPMI-1640培養基,孔徑為8.0 μm的小室,Cy3標記物,美國Invitrogen公司生產的LipofectamineTM2000。
1.2 方法
TRPC1-SiRNA轉染A549細胞:將A549細胞接種于6孔板,細胞密度為每個孔2×105。第二天用血清培養液稀釋TRPC1-SiRNA(已經進行Cy3標記物標記)250 μl,濃度分別稀釋到20、30、50以及100 mmol/L,然后與5 μl的LipofectamineTM2000室溫下孵育5 min后輕輕混合再孵育20 min,然后加入到6孔板接種的A549細胞的每個孔,在37℃下、5% CO2的細胞培養箱中6 h后換血清培養液分別培養24 h、48 h以及72 h。然后進行熒光定量PCR檢測。并計算轉染速率。
A549細胞的增殖檢測:將等量的100 mmol/L TRPC1-SiRNA轉染A549細胞、未轉染A549細胞以及轉染試劑接種于8塊96孔的培養液中,密度是2×103,在5%CO2的細胞培養箱中培養。每孔加入20 μl的MTT培養液,4 h后吸取培養液的上清液,加入150 μl DMSO,應用酶聯免疫標記分析儀測定光密度值,計算增殖時間。
A549細胞侵襲實驗:先按照實驗室標準制備細胞侵襲實驗需要的小室膜。將未轉染A549細胞、TRPC1-SiRNA轉染A549細胞以及轉染試劑400 μl加入上室,等量的培養液加入下室。4%多聚甲醛固定15 min,然后進行染色、水洗和風干。制片封片后在顯微鏡下觀察并計算每個孔平均穿膜數。
1.3 觀察指標
觀察TRPC1-SiRNA轉染A549細胞在不同濃度、不同時間下的轉染速率,觀察未轉染A549細胞、TRPC1-SiRNA轉染A549細胞以及轉染試劑的增殖時間和穿膜細胞數。分析TRPC1-SiRNA對肺腺癌的治療作用。
1.4 統計學處理
應用SPSS 13.0統計軟件進行統計學分析,多組間計量資料采取F檢驗,以P<0.05為具有統計學意義。
2 結果
2.1 不同濃度和時間下TRPC1-SiRNA轉染速率情況
100 mmol/L TRPC1-SiRNA(Cy3標記物標記后)轉染A549細胞48 h速率,明顯大于其他濃度時的速率。TRPC1-SiRNA(Cy3標記物標記后)轉染A549細胞48 h和100 mmol/L濃度下轉染速率最大,兩個對照組的轉染時間和濃度也設定為48 h和100 mmol/L濃度,見表1。
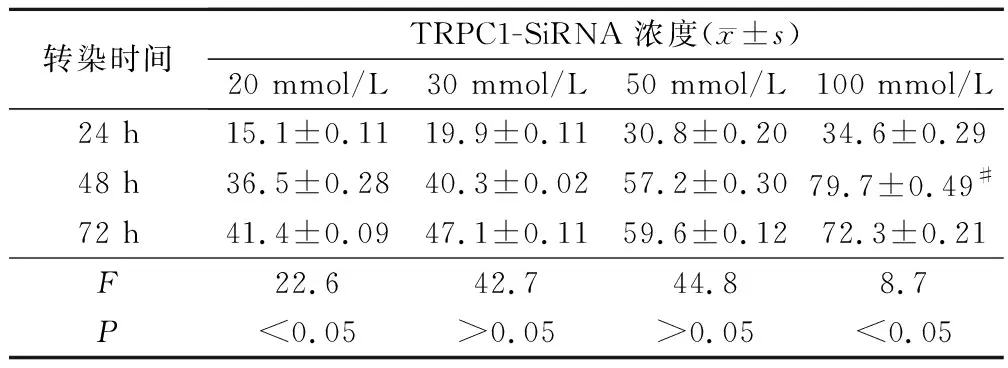
表1 不同濃度TRPC1-SiRNA轉染不同時間的轉染速率結果
注:#為轉染48 h,與其他濃度TRPC1-SiRNA轉染速率相比,P<0.05;100 mmol/L TRPC1-SiRNA濃度下,與其他時間的轉染速率相比,# 為P<0.05。
2.2 MTT法檢測A549細胞的增殖時間
TRPC1-SiRNA基因轉染A549細胞增殖時間明顯短于未轉染組和轉染試劑對照組,差異均具有統計學意義(P<0.05),見表2。
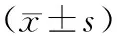
表2 MTT法檢測A549細胞的增殖時間結果
注:#為與未轉染組和轉染試劑組比較,P<0.05。
2.3 肺腺癌細胞侵襲能力實驗結果
TRPC1-SiRNA基因轉染A549細胞侵襲實驗中穿膜細胞數明顯少于未轉染組和轉染試劑對照組,差異均具有統計學意義(P<0.05),見表3。
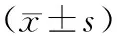
表3 肺腺癌細胞侵襲能力實驗中穿膜細胞數結果
注:#為與未轉染組和轉染試劑組比較,P<0.05。
3 討論
肺腺癌是肺癌的1種,主要致病因素是支氣管上皮細胞癌變,少數是支氣管的粘液腺發生癌變。絕大多數較小的支氣管細胞癌變的肺腺癌屬于周圍型肺癌。肺腺癌發病早期顯的臨床癥狀表現不明顯,患者不易察覺,胸部 X 線檢查時肺腺癌可以被發現。肺腺癌腫瘤形狀為圓形或橢圓形,據觀察生長速度比較緩慢,一般血行轉移發生在癌癥早期,淋巴轉移發生在肺腺癌晚期[2-3]。
TRPC1是位于細胞膜上的一類重要的非選擇性陽離子通道家族之一。曾有研究報道過鈣離子與腫瘤關系密切,能夠參與到腫瘤的增殖和侵襲等惡性生物學行為中[4]。非選擇性陽離子通道TRPC1作為調控細胞鈣離子通道的物質,以前部分學者認為該物質參與到受體介導的、鈣依賴的平滑肌以及腺體的分泌和收縮功能。最近有國外研究證明[5-7],TRPC1與腫瘤細胞的增殖和侵襲行為等有關。SiRNA是通過RNA干擾技術在體內或者體外培養產生的,會抑制同源性基因的表達,使同源細胞沉默,所以稱之為沉默基因。曹新梅等[8]研究證實SiRNA可以抑制某些癌基因的表達,從而抑制肺癌細胞的增殖、侵襲等惡性生物行為。本院的研究結果證明,SiRNA沉默TRPC1基因可抑制A549細胞的增殖能力,降低A549細胞的侵襲能力,本院這一研究結論恰好結合了國內外對于SiRNA和TRPC1的研究結論。黃棟等人曾經針對SiRNA沉默B7-H4基因轉染A549細胞進行轉染速率、癌細胞增殖、侵襲以及轉移能力的研究,部分結論與本院的SiRNA沉默TRPC1基因相似[9-10]。結合國內外多位醫學專家學者針對SiRNA各個亞型沉默基因的研究結論證實確實對癌細胞的惡性生物性行為有密切關系,可以應用到癌癥的臨床治療中。
[1] 張 駿,朱 震,李雄偉,等.SiRNA沉默TRPC1基因對肺腺癌A549細胞增殖和侵襲的影響〔J〕.中華醫學雜志,2013,93(28):2241-2243.
[2] 韓瑞超,范志文,周 敏,等.低氧條件下RNA干擾阻斷Notch3通路對人肺腺癌A549細胞增殖的影響〔J〕.上海交通大學學報,2013,33(4):421-424.
[3] 丁雨欽,曲 杰,張晶晶,等.鴉膽子油乳聯合siRNA-ERCC1對肺腺癌A549/DDP細胞的耐藥逆轉作用〔J〕.中國實驗方劑學雜志,2012,18(20):235-239.
[4] Collins BJ,Kleeberger W,Ball DW.Notch in lung development and lung cancer〔J〕.Semin Cancer Biol,2004,14(5):357-364.
[5] 滕 穎,王秀問,王亞偉,等.小干擾RNA干擾β連環素表達對肺腺癌A549細胞Wnt信號通路的作用〔J〕.中華醫學雜志,2010,90(14):988-992.
[6] 趙士磊,趙玉達,堯 然,等.小干擾RNA沉默Y盒結合蛋白-1基因對肺腺癌A549細胞株表皮生長因子受體表達的影響〔J〕.中華實驗外科雜志,2013,30(8):1595-1597.
[7] 張立英,劉紹霞,趙國強,等.TNF-α基因siRNA真核表達載體的構建及其對A549細胞TNF-α和TGF-β1表達的影響〔J〕.鄭州大學學報(醫學版),2012,47(5):629-632.
[8] 曹新梅,張岱權,王 栩,等.靶向HER2基因的siRNA聯合卡鉑對肺腺癌A549細胞的抑制作用〔J〕.山東醫藥,2012,52(29):43-44.
[9] Galluzzo P,Bocchetta M.Notch signaling in lung cancer〔J〕.Expert Rev Anticancer Ther,2011,11(4):533-540.
[10] 黃 棟,方 芳,許 峰.TLR4-siRNA對高氧誘導人肺腺癌細胞株A549炎性因子分泌的影響〔J〕.中華麻醉學雜志,2012,32(3):361-363.

