腸內營養支持對胃癌患者術后營養狀況和免疫功能的影響
毛宏銘 王光遠 毛洪緒
(六盤水市人民醫院普外科,貴州 六盤水 553001)
胃癌是臨床最常見的惡性腫瘤,常合并嚴重的營養不良〔1〕。腫瘤細胞的無限增殖使患者自身的營養被大量的消耗,加之機體分解代謝增加、合并疼痛和厭食等原因導致患者免疫功能障礙;且由于術后的禁食和手術創傷又進一步的加重了營養不良及免疫功能障礙。因此,充分的營養支持對胃癌根治術患者營養狀況和免疫功能的改善具有重要意義〔2,3〕。本研究對在我院行胃癌根治術的患者進行腸內營養或腸外營養支持治療,并通過比較其對術后營養狀況和免疫功能影響,以探討更為有效的營養支持治療方法。
1 資料與方法
1.1一般資料 選取2010年6月至2013年1月在我院行胃癌根治術的60例患者,納入標準〔4〕:均經胃鏡病理檢查確診;排除標準〔5〕:合并重要臟器功能不全患者,合并代謝性或內分泌疾病。隨機分為兩組,觀察組30例,男20例,女10例,年齡45~77〔平均(61.4±12.7)〕歲,手術時間(2.49±0.23)h,術中失血量(346.13±72.66)ml;對照組30例,男21例,女9例,年齡46~79〔平均(63.0±14.2)〕歲,手術時間(2.51±0.23)h,術中失血量(349.17±75.53)ml。兩組患者性別構成比、年齡、手術時間及術中失血量比較均無顯著差異(均P>0.05),具有可比性。
1.2方法 兩組患者術后均給予熱量為125.5 kJ/(kg×d)和氮量為0.2 g·kg-1·d-1的營養支持治療,療程為7 d。其中觀察組于術中將營養管置入胃空腸吻合口遠端約19 cm處,術后24 h通過營養管泵入腸內營養液(百普力,紐迪西亞公司),速度為35~75 ml/h,總量為30 ml·kg-1·d-1;對照組經中心靜脈穿刺置管,將葡萄糖液、脂肪乳劑、樂凡命、維它利匹特及微量元素等配成3 L腸外營養液輸袋注后,進行腸外營養支持治療,總量為2 500 ml/d。
1.3營養狀況指標 于術前1 d及術后第8天測定患者體重(BW),并應用自動生化儀檢測兩組患者血清前蛋白(PA)、白蛋白(ALB)及總蛋白(TP)。
1.4免疫功能指標 于術前1 d及術后第8天采用酶聯免疫法(ELISA)檢測患者外周血IgA、IgG、IgM(湖南永和陽光科技公司, 10156,20395,20347),采用流式細胞儀測定CD4+、CD8+及CD4+/CD8+,流式細胞儀由貝克曼庫爾特公司提供的MoFlo XDP超速系,抗體CD4+、CD8+及CD4+/ CD8+由上海雅吉生物公司提供,貨號:YS9271R、YS4060R、YS4058R,采用術前、術后8 d清晨空腹抽取患者靜脈血,按照流式細胞儀器說明進行操作。
1.5炎性因子 于術前1 d及術后第8天采用ELISA法檢測外周血白細胞介素(IL)-6和C反應蛋白(CRP)水平,ELISA免疫試劑盒由上海谷研公司提供。
2 結 果
2.1兩組患者營養指標比較 兩組間BW、PA、ALB及TP術前比較無顯著性差異(P>0.05);術后第8天,觀察組與對照組PA均顯著高于術前(均P<0.05),且兩組患者PA值比較差異顯著(均P<0.05)。見表1。
2.2兩組患者免疫指標比較 兩組患者術前各項免疫指標比較均無顯著性差異(均P>0.05);術后第8天時,觀察組IgA、IgG及IgM顯著高于術前及對照組(均P<0.05);術后第8天,觀察組CD4+、CD8+及CD4+/ CD8+顯著高于術前及對照組(均P<0.05)。見表2。
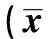
表1 兩組患者營養指標比較±s,n=30)
2.3兩組患者IL-6、CRP水平比較 兩組患者術前IL-6、CRP水平比較均無顯著性差異(均P>0.05);術后第8天,觀察組IIL-6、CRP水平顯著高于術前(均P<0.05);但觀察組顯著低于對照組(均P<0.05)。見表3 。
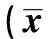
表2 兩組患者免疫指標比較±s,n=30)
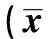
表3 兩組患者IL-6、CRP水平比較±s,n=30)
3 討 論
胃癌患者常常合并營養不良,其原因主要為機體攝入的營養物質減少而丟失卻增加,這不僅影響了手術、化療等抗腫瘤治療措施的有效應用,嚴重者還增加了患者術后并發癥發生率和死亡率;且營養不良亦可造成患者免疫功能低下,而手術應激加重了機體炎性反應,影響患者術后恢復〔6〕。腸外營養能明顯改善機體營養狀況,但有臨床研究〔7〕表明,其對改善患者的預后無明顯作用。而腸內營養既可保護機體腸黏膜功能,避免細菌播散,對降低腸源性感染的發生具有明顯作用;還可刺激免疫球蛋白和胃腸激素的分泌,促進胃腸蠕動,改善患者胃腸功能、營養狀況和免疫功能〔8〕。
既往認為,只有待胃腸功能恢復正常后才可對患者進行腸內營養支持治療〔9〕,而近年來,有臨床研究表明小腸的蠕動和吸收功能在術后2~3 h后即可恢復正常,因此,術后12~24 h可進行營養支持治療,亦說明術后早期(24 h內行)腸內營養支持治療是可行的〔10〕。本研究結果與之相同。另外,腸內營養支持的療效顯著優于腸外營養支持,與相關文獻〔11〕提示的結果相符。此外,本研究還說明了腸內營養和腸外營養均能有效改善患者免疫功能,而腸內營養在改善患者免疫功能方面顯著優于腸外營養,這與王佳銘等〔12〕的報道一致。究其原因可能是由于腸內營養液富含w-3脂肪酸,其可提供充分的營養支持,還可刺激機體免疫細胞,從而增強免疫應答和調節免疫功能〔13〕。由于炎癥因子IL-6和CRP是敏感的免疫炎癥因子,可反映患者免疫功能狀態。本研究結果進一步提示了腸內營養支持在減輕胃癌根治術后機體炎性方面優于腸外營養支持。
綜上,腸內營養支持可顯著改善胃癌患者術后營養狀況和免疫功能,且其改善程度顯著優于腸外營養支持,也極可能通過改善患者的免疫功能狀態的方式減輕患者術后機體炎性反應程度。
4 參考文獻
1Benizri EI,Bereder JM,Rahili A,etal.Ascites and malnutrition are predictive factors for incomplete cytoreductive surgery for peritoneal carcinomatosis from gastric cancer〔J〕.Am J Surg,2013;205(6):668-73.
2趙 巖,張楚辭,鄭國良,等.添加丙氨酰谷氨酰胺的胃腸外營養對存在營養風險的胃癌根治術患者免疫功能、營養狀態及術后恢復的臨床意義〔J〕.現代生物醫學進展,2012;12(19):3693-7.
3Loh KW,Vriens MR,Gerritsen A,etal.Unintentional weight loss is the most important indicator of malnutrition among surgical cancer patients〔J〕.Neth J Med,2012;70(8):365-9.
4Campana LG,Scarpa M,Sommariva A,etal.Minimally invasive treatment of peristomal metastases from gastric cancer at an ileostomy site by electrochemotherapy〔J〕.Radiol Oncol,2013;47(4):370-5.
5Liu SZ,Wang B,Zhang F,etal.Incidence, survival and prevalence of esophageal and gastric cancer in linzhou city from 2003 to 2009〔J〕.Asian Pac J Cancer Prev,2013;14(10):6031-4.
6卜 君,黃 雄,李 念,等.術前營養支持對于減少存在營養不良的胃癌患者術后呼吸系統并發癥的作用〔J〕.實用醫學雜志,2013;29(8):1246-8.
7Shamberger RC,Brennan MF,Goodgame JT Jr,etal.A prospective, randomized study of adjuvant parenteral nutrition in the treatment of sarcomas: results of metabolic and survival studies〔J〕.Surgery,1984;96(1):1-13.
8楊 華,趙 剛,吳國舉,等.老年胃癌患者術后腸內營養序貫治療與腸外營養支持的前瞻性研究〔J〕.中華老年醫學雜志,2012;31(10):881-4.
9梁華紅.螺旋型鼻腸管在急性重癥胰腺炎腸內營養中的護理〔J〕.廣西醫學,2008;30(9):1450-1.
10張亞冰.胃癌全胃切除術后早期腸內營養支持的臨床研究〔J〕.重慶醫學,2011;40(16):1579-81.
11徐偉偉,孫 琳,胡幼芳,等.60歲以上胃癌患者術后營養支持的回顧性分析〔J〕.江蘇醫藥,2012;38(24):3034-5.
12王佳銘,曹春遠,馬 震,等.老年胃癌患者20例圍術期腸內營養支持〔J〕.中國老年學雜志,2012;32(19):4278-9.
13朱利微,徐淑云,趙慶偉,等.胃癌病人全胃切除術后腸內營養支持的臨床觀察〔J〕.腸外與腸內營養,2011;18(2):112-3.

