老年胃腸道手術患者不同液體治療療效比較
趙 強 方開云 程 俊 王 勇 (六盤水市人民醫院麻醉科,貴州 六盤水 55300)
目標導向性液體治療(GDFT)可以根據患者的一般狀況、血容量狀態進行個性化液體治療方案,以維持血流動力學穩定〔1,2〕。本研究旨在比較GDFT與常規液體治療方案對胃腸道手術老年患者的療效。
1 資料與方法
1.1 研究對象 2012年7月至2013年10月我院普通外科接受手術治療的老年胃腸道疾病患者70例,年齡66~87歲,明確診斷為胃腸道疾病且擬行手術治療;美國麻醉師協會(ASA)分級Ⅱ、Ⅲ級。排除標準:伴有嚴重心、肺、腎、肝等重要臟器,凝血功能障礙者;伴有精神疾患、腦部器質性疾病者。根據液體治療的方案不同隨機分為觀察組和對照組。兩組年齡、性別、體質指數(BMI)、空腹血糖、手術時間及ASA分級均無顯著差異(P 均>0.05)。見表1。
表1 兩組一般資料比較(s,n=35)
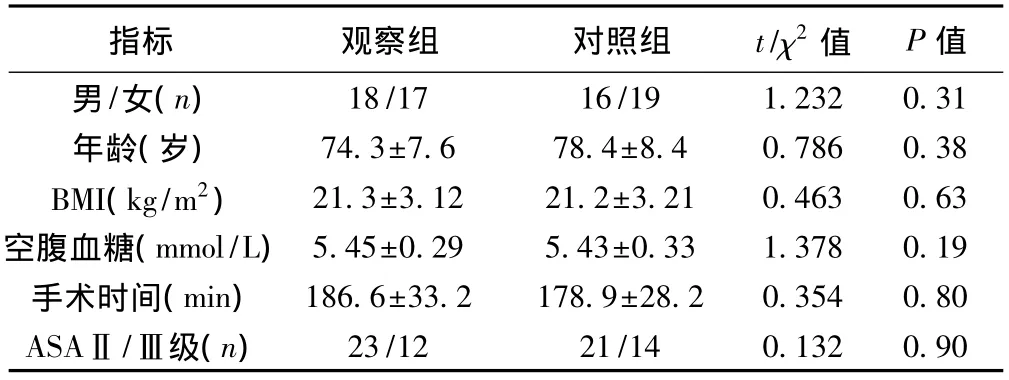
表1 兩組一般資料比較(s,n=35)
指標 觀察組 對照組 t/χ2值 P值男/女(n)18/17 16/19 1.232 0.31年齡(歲)74.3±7.6 78.4±8.4 0.786 0.38 BMI(kg/m2)21.3±3.12 21.2±3.21 0.463 0.63空腹血糖(mmol/L)5.45±0.29 5.43±0.33 1.378 0.19手術時間(min)186.6±33.2 178.9±28.2 0.354 0.80 ASAⅡ/Ⅲ級(n)23/12 21/14 0.132 0.90
1.2 治療方法 患者入麻醉室后,行橈動脈、頸內靜脈穿刺,監測患者的血壓(BP)、中心靜脈壓(CVP)等,橈動脈與Flotrac/Vigileo監護儀相連接,輸入患者的身高、體重、性別、年齡等,然后記錄心輸出指數(CI)、每搏變異度(SVV)等,兩組麻醉方案相同,用咪達唑侖 0.03 mg/kg,維庫溴銨 0.15 mg/kg,依托咪酯0.4 mg/kg及芬太尼4 μg/kg行麻醉誘導,面罩給氧氣管插管,與麻醉劑相連,相關參數:VT 8~10 mg/kg,呼吸 10~12次/min,呼吸比1∶2,2% ~3%的七氟烷用于維持麻醉。對照組根據經典輸液方案,麻醉前復方乳酸鈉5~7 ml/kg,然后根據平均動脈壓(MAP)、CVP和尿量進行具體的補液治療。若 MAP≥65 mmHg、CVP=8 ~12 mmH2O 且尿量>0.5 ml·kg-1·h-1則不予補液。在CVP<8 mmH2O且MAP≤65 mmHg時補給復方乳酸鈉500 ml,若在補液之后CVP依然低于8 mmH2O,MAP依然不大于65 mmHg,則需要再補給130/0.4的羥乙基淀粉250 ml,直至目標達成;若 MAP≤65 mmHg且 CVP≥14 mmH2O則給予多巴酚丁胺。觀察組輸入5~7 ml/kg復方乳酸鈉,參照 CI、MAP、SVI、SVV 補液:如果 SVI<35 ml/m2,CI≤2.5 L·min-1·m-2,對 SVV 進行觀察,若其高于 12% 則輸入500 ml的復方乳酸鈉后對SVI進行觀察(若SVI<35 ml/m2則于靜脈輸注5 min的130/0.4羥乙基淀粉250 ml),若其低于12%則輸入130/0.4羥乙基淀粉250 ml,同時注射多巴酚丁胺;若 SVI>35 ml/m2且 CI≤2.5 L·min-1·m-2,注射多巴酚丁胺;當 MAP≥65 mmHg,SVI>35 ml/m2,CI≥2.5 L·min-1·m-2時不予補液。
1.3 檢測指標 術中晶體、膠體用量、尿量、術中出血量及在不同時刻(包括T1進入麻醉室監測建立時,T2誘導后的即刻,T3手術開始1 h,T4手術結束)血流學參數(包括MAP、HR)、代謝指標〔包括乳酸(Lac)、中心靜脈血氧飽和度(ScvO2)、氧攝取率(ERO2)〕。
1.4 統計學方法 采用SPSS19.0軟件進行t和χ2檢驗。
2 結果
2.1 兩組液體出入量及血管活性藥物比較 觀察組晶體入量明顯少于對照組,而膠體入量、尿量顯著高于對照組(P<0.01)。見表 2。
2.2 兩組不同時間血流動力學參數比較 兩組T1、T2、T4的MAP均無顯著差異(P均>0.05),T3觀察組MAP水平顯著高于對照組(t=4.797,P<0.01);觀察組和對照組 HR T1、T2、T3、T4各時間點均無統計學差異(P均>0.05)。見表3。
2.3 兩組代謝指標比較 T3時兩組Lac、ScvO2、ERO2均無統計學差異,T4時觀察組 Lac明顯低于對照組(t=12.03,P<0.01),而 ScvO2(t=6.684,P<0.01)、ERO2(t=5.435,P<0.01)水平均顯著高于對照組。見表4。
表2 兩組液體出入量及血管活性藥物比較(s,n=35)
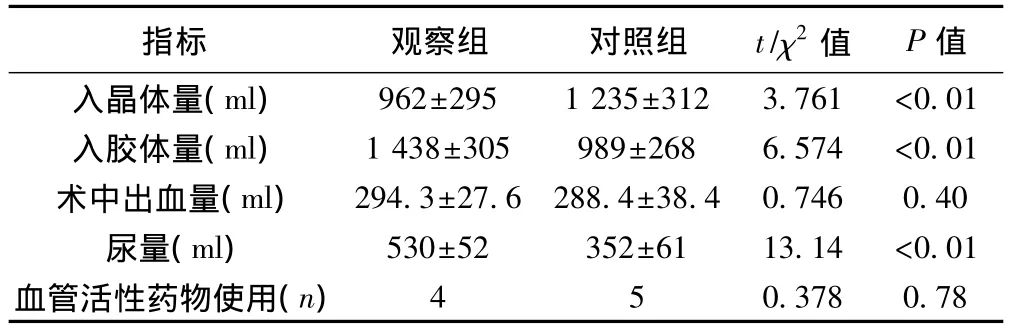
表2 兩組液體出入量及血管活性藥物比較(s,n=35)
指標 觀察組 對照組 t/χ2值 P值入晶體量(ml)962±295 1 235±312 3.761 <0.01入膠體量(ml)1 438±305 989±268 6.574 <0.01術中出血量(ml)294.3±27.6 288.4±38.4 0.746 0.40尿量(ml)530±52 352±61 13.14 <0.01血管活性藥物使用(n)4 5 0.378 0.78
表3 兩組不同時間點MAP、HR比較(s,n=35)
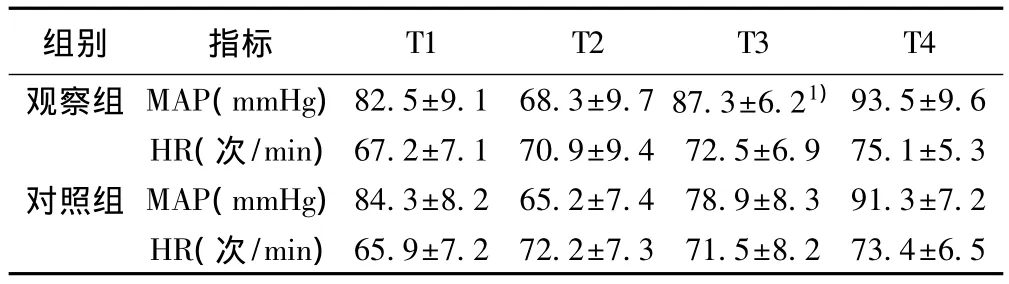
表3 兩組不同時間點MAP、HR比較(s,n=35)
與對照組比較:1)P<0.01
組別 指標 T1 T2 T3 T4觀察組 MAP(mmHg)82.5±9.1 68.3±9.7 87.3±6.21)93.5±9.6 HR(次/min)67.2±7.1 70.9±9.4 72.5±6.9 75.1±5.3對照組 MAP(mmHg)84.3±8.2 65.2±7.478.9±8.3 91.3±7.2 HR(次/min)65.9±7.2 72.2±7.3 71.5±8.2 73.4±6.5
表4 兩組不同時間點的代謝指標比較(n=35,s)
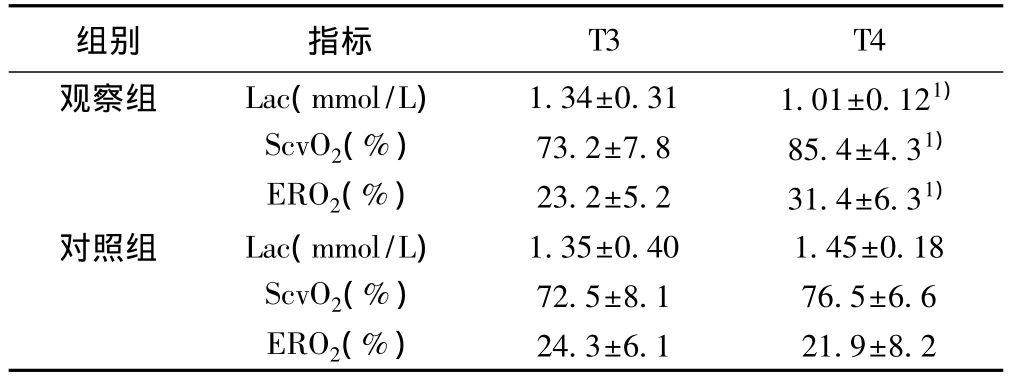
表4 兩組不同時間點的代謝指標比較(n=35,s)
組別 指標 T3 T4觀察組 Lac(mmol/L)1.34±0.31 1.01±0.121)ScvO2(%)73.2±7.8 85.4±4.31)ERO2(%)23.2±5.2 31.4±6.31)對照組 Lac(mmol/L)1.35±0.40 1.45±0.18 ScvO2(%)72.5±8.1 76.5±6.6 ERO2(%)24.3±6.1 21.9±8.2
3 討論
在臨床麻醉中,對于手術患者的液體治療策略常有較大爭議,若液體治療方案不恰當〔3〕,可導致圍術期多種并發癥,老年患者的系統、器官功能衰退,特別是心、腎功能,在液體治療不當時,很容易導致心力衰竭等相關并發癥〔4〕。學者〔5〕提出對于普通外科行胃腸道手術的患者,圍術期給予限制性補液對于減少圍術期并發癥有積極意義,相應地能夠顯著改善預后。但另有學者〔6〕提出限制性補液可能導致手術過程中出現血壓偏低、組織灌注不足,耗氧與供氧平衡狀態破壞,圍術期并發癥的發生率增加。而多數學者〔6〕認為術中的低血壓、缺氧及低血容量狀態可導致患者機體的供氧不足,繼而細胞的線粒體受損,最終導致了相應器官的功能障礙。而GDFT目標是對心臟前負荷的最佳優化,在維持循環血容量、微循環灌注量、組織供氧的同時盡量避免患者出現組織水腫、心力衰竭等嚴重并發癥〔7〕。心排量檢測儀是通過外周動脈進行連續的監測心輸出量,操作上只需外周動脈進行穿刺置管,即能通過患者年齡、性別、身高、體重等多項一般信息來對血管順應性進行相應的調整,而且可以將一段時間內的數據、波形等分析得出心排出量、心臟指數等眾多參數〔8〕。研究〔9〕證實該項技術對于重癥監護、外科手術治療的患者監測的血流動力學參數有著較好的相關性。SVV能夠有效評估有效循環血量,并能預測液體的反應性。研究〔10〕提出SVV可推薦作為大手術中的標準治療策略,GDFT的目標設定也可不完全相同。出于減小創傷、并發癥的相關考慮,將CI設定在≥2.5 L·min-1·m-2,因為患者在正常的血紅蛋白、動脈血氧飽和度下,CI可以有效評估患者的供氧量,而且可以迅速獲知結果〔11〕。本研究提示補液過程中對于晶、膠體的種類選擇有著一定的差異,而最終效果證明GDFT更利于患者血容量循環狀態的穩定〔12〕。GDFT液體治療方案能夠顯著改善患者的微循環功能,增加機體供氧量〔13〕。
1 Srinivasa S,Taylor MH,Singh PP,et al.Randomized clinical trial of goaldirected fluid therapy within an enhanced recovery protocol for elective colectomy〔J〕.Br J Surg,2013;100(1):66-74.
2 Challand C,Struthers R,Sneyd JR,et al.Randomized controlled trial of intraoperative goal-directed fluid therapy in aerobically fit and unfit patients having major colorectal surgery〔J〕.Br J Anaesth,2012;108(1):53-62.
4 Marik PE,Desai H.Goal directed fluid therapy〔J〕.Curr Pharm Des,2012;18(38):6215-24.
5 Davies SJ,Yates D,Wilson RJ.Dopexamine has no additional benefit in high-risk patients receiving goal-directed fluid therapy undergoing major abdominal surgery〔J〕.Anesth Analg,2011;112(1):130-8.
6 Jammer I.Goal directed fluid therapy:careful with conclusions〔J〕.Acta Anaesthesiol Scand,2013;57(7):946.
7 Srinivasa S,Kahokehr A,Soop M,et al.Goal-directed fluid therapy-a survey of anaesthetists in the UK,USA,Australia and New Zealand〔J〕.BMC Anesthesiol,2013;13:5.
8 Wang MD,Ji Y,Xu J,et al.Early goal-directed fluid therapy with fresh frozen plasma reduces severe acute pancreatitis mortality in the intensive care unit〔J〕.Chin Med J(Engl),2013;126(10):1987-8.
9 Mayer J,Boldt R,Beschmann R,et al.Uncalibrated arterical pressure waveform analysis for less-invasive cardiac output determination in obese patients undergoing cardiac surgery〔J〕.Br J Anaesth,2009;103(2):185-90.
10 Challand C,Struthers R,Sneyd JR,et al.Randomized controlled trail of intraoperative goal-directed fluid therapy in aerobically fit and unfit patient having major colorectal surgery〔J〕.Br J Aneasth,2012;108(1):53-62.
11 Ramsingh DS,Sanghvi C,Gamboa J,et al.Outcome impact of goal directed fluid therapy during high risk abdominal surgery in low to moderate risk patients:a randomized controlled trial〔J〕.J Clin Monit Comput,2013;27(3):249-57.
12 Hahn R.Goal directed fluid therapy a good method used too rarely〔J〕.Lakartidningen,2011;108(40):1968-70.
13 Bjorne H.Correct fluid in right time and correct amount!Goal-directed fluid therapy in major bowel surgery yields less complications〔J〕.Lakartidningen,2011;108(40):1953.

