誘導調節T細胞的鑒別及生成
黃尚 朱同玉 戎瑞明
(復旦大學附屬中山醫院泌尿外科,上海 200032)
1 引言
調節性T細胞(regulatory T cell,Treg)在器官移植免疫中起著重要的免疫抑制作用。Treg分為胸腺自然發育的自然調節T細胞(natural Treg,nTreg)和在外周免疫器官中經誘導產生的誘導調節T細胞(induced Treg,iTreg)。這兩種Treg都可對免疫活動起抑制作用,但二者作用不完全一致。nTreg主要負責內源性抗原耐受[1-2],而iTreg主要負責外源性抗原耐受[3-5]。因此,鑒別這兩種Treg以及誘導可致外源性抗原耐受的iTreg具有重要的臨床意義。
2 nTreg及iTreg的鑒別
2.1 nTreg和iTreg的功能區分 iTreg及其前體普通T細胞(conventional T cell,Tconv)的T細胞受體(T cell receptor,TCR)庫主要負責識別外源性抗原[3,6-7]。在小鼠模型和人群中iTreg功能下降均可導致外源性抗原耐受下降和炎癥性腸炎的發生[4,8]。Xu等[5]研究發現,輸注iTreg可降低氣道高反應性,抑制嗜酸性粒細胞聚集,降低IgE水平,減輕哮喘模型的炎性反應。腎移植患者的CD4+CD25+Foxp3+IFNγ+的iTreg與移植腎長期存活率相關[9]。因此,iTreg在功能上傾向于抑制外源性抗原產生的免疫反應。
2.2 nTreg和iTreg的研究模型 目前尚無理想的用于鑒別nTreg和iTreg的分子標志物。因此,對這兩個細胞亞群的功能研究一般應用因抗原編碼基因缺陷而不能產生成熟T淋巴細胞和B淋巴細胞的Rag-/-小鼠[10],將特異的抗原基因轉入該種小鼠體內以產生抗原特異性的單克隆iTreg或是將體外培養的nTreg或iTreg輸入體內[1,11];也可采用無法產生iTreg的CNS1-/-小鼠與野生型或經其他處理小鼠對照,研究iTreg的功能[1,12]。
2.3 nTreg和iTreg的分子標志物
2.3.1 Helios Helios是Ikaros轉錄因子家族中的一員。Ikaros家族在淋巴細胞的生成、活化及穩態維持中起重要作用[13]。Thornton等[14]曾發現,Helios是nTreg的特異性標志物。然而,近年來,不支持該結論的證據也有很多,例如Verhagen等[15]研究中的Rag-/- Tg4轉基因小鼠無法產生nTreg,其Treg理論上應該均為Helios-,但給予外源性抗原刺激后,該小鼠外周Helios+Treg占Treg總數的50%~60%;Gottschalk等[16]在體內和體外實驗中也發現,iTreg可表達Helios;Zabransky等[17]亦發現,Helios是否表達與Treg是否來源于外周無關,而Treg的調節活性與Helios+Treg的絕對數量呈正比。由此可見,Helios可能是Treg行使功能的標志物,而非nTreg的特有標志物。目前對Helios的功能爭議很大,但得到公認的是Helios+Treg在Treg群體中具有特殊的功能和地位,因此,對于Helios的具體作用還需要深入研究。
2.3.2 Neuropilin-1 Neuropilin-1(Nrp-1)表達于淋巴細胞、神經元細胞及腫瘤細胞表面,曾被作為區分Treg和Tconv的標志物[18]。近年來,Weiss等[19]和Yadav等[20]的研究發現,Nrp-1在nTreg中高表達,而iTreg低表達或不表達Nrp-1。Nrp-1作為分子標志物的最大優勢在于它表達于細胞表面,故便于Nrp-1+Treg的分離、純化。但是,Weiss等[19]在小鼠實驗性變態反應性腦脊髓炎(Experimental autoimmune encephalomyelitis,EAE)和肺炎模型中均發現Nrp-1- iTreg可轉換為Nrp-1+iTreg的現象,因此,免疫微環境對Nrp-1的表達可能也有影響。
對于Helios作為nTreg的標志物爭議很大,而Nrp-1在炎性反應環境中又可在iTreg中表達,因此,這兩種分子的表達、功能和分布仍需深入研究,同時仍有待尋找新的nTreg或iTreg標志物。
2.4 基因表達 nTreg和Tconv表達的基因不盡相同,例如,Itgae、Nrp1等基因由nTreg所特有[21]。口服免疫原可刺激Tconv表達Foxp3等Treg必須的基因,從而使Tconv轉化為iTreg并行使調節功能。iTreg中某些和調節功能無關的基因的表達程度更接近其前體Tconv而非nTreg,例如Igfbp4和Dapl1基因在nTreg及其前體細胞均低表達或不表達,而在Tconv及iTreg均高表達,甚至在Nrp-1+iTreg中Dapl1也高表達,說明其表達較穩定[19]。因此,Tconv和iTreg均表達而nTreg不表達的基因及其產物有望成為區分iTreg和nTreg的較好的分子標志物,有待深入研究。
3 iTreg生成的誘導
免疫復合物、共刺激信號、細胞因子等作用均與iTreg的增殖有關,傳染耐受(infectious tolerance)機制也可能與iTreg的誘導產生有關。
3.1 影響iTreg生成的因素
3.1.1 免疫復合物及共刺激因子 誘導iTreg生成的條件與nTreg有許多不同。弱抗原刺激產生的iTreg會被誘導凋亡,而低劑量強抗原刺激產生的iTreg可持續在外周行使功能,低TCR-pMHC免疫復合物刺激強度和一定的持續時間均是有利于iTreg在體內生成的因素[22]。CD28是抗原信號傳遞的重要共刺激因子,體外和體內研究[23]發現,CD28共刺激強度與iTreg生成負相關,強烈的CD28共刺激信號可抑制iTreg產生,且CD28共刺激強度是影響iTreg生成的一個獨立因素。細胞毒淋巴細胞相關抗原-4(cytotoxic T lymphocyte antigen-4,CTLA-4)是T細胞活化的重要負性共刺激因子。體外研究[24]發現,CTLA-4-/-小鼠的CD4+CD25- T細胞無法被誘導表達Foxp3而轉化為iTreg,在野生型CD4+CD25- T細胞中使用抗體阻斷CTLA-4也可抑制TGF-β對Foxp3+iTreg的誘導作用。
除了CD28和CTLA-4,程序性死亡受體配體-1(programmed cell death ligand 1,PD-L1)等分子也可作為共刺激因子發揮作用。在體外,使用PD-L1包被磁珠可誘導iTreg的免疫調節功能,且PD-L1-/- APC無法使幼稚CD4+T細胞轉化為iTreg;在體內,PD-L1-/-小鼠的iTreg生成明顯受到抑制[25]。補體片段C3a和C5a的受體C3aR和C5aR可提供效應T細胞的共刺激信號,維持其生存和促進活化。然而,在Treg細胞中,不管體外還是體內,無論是在蛋白層面或基因層面,阻斷C3aR和C5aR的信號轉導都可抑制PI3K/Akt/mTOR信號通路,從而誘導Foxp3的表達而促進iTreg生成[26]。
3.1.2 細胞因子 IL-2是誘導iTreg生成的重要細胞因子。在體外和體內,IL-2需要TGF-β共同作用才能使CD4+CD25- T細胞轉化為CD4+CD25+T細胞而生成iTreg[27]。實驗和數學建模分析顯示,iTreg只能利用周圍約10μm 范圍內的IL-2,而iTreg本身并不分泌IL-2,這可能是限制iTreg在體內產生的因素之一[28-29]。除了IL-2,TGF-β也是誘導iTreg必不可少的細胞因子。TGF-β可增強活化T細胞核因子(nuclear factor of activated T cells,NFAT)和Smad3與保守非編碼序列-1(conserved non-coding sequence-1,CNS-1)增強子的結合,增強CNS-1 DNA組氨酸的乙酰化,經過一系列步驟誘導Foxp3的表達[30]。體外誘導的iTreg并不穩定,Selvaraj等[31]對TGF-β和iTreg的作用進行了動力學分析,結果發現,雖然TGF-β可將約90%的幼稚T細胞誘導為iTreg,但培養體系中去除TGF-β后4 d即可觀察到Foxp3表達下降。
3.2 iTreg與傳染耐受 傳染耐受是指,在抗原提呈細胞(antigen presenting cell,APC)的輔助下,已有的Treg可將幼稚T細胞轉化成iTreg。此過程綜合了有利于iTreg生成的各項因素,指明iTreg的來源即幼稚T細胞,提供了在體內不斷生成iTreg的可能性。
Cobbold等[32]提出了傳染耐受機制的模型(圖1)。在這個模型中,APC和Treg將幼稚T細胞轉化為iTreg的過程發生在微觀的免疫微環境中,Treg表面的IL-10、TGF-β等細胞因子和CTLA-4等抑制性共刺激信號由Treg提供,上調APC的必需氨基酸(essential amino acid,EAA)代謝酶,使微環境中的色氨酸、精氨酸、苯丙氨酸、組氨酸等EAA減少,從而通過mTOR信號通路抑制幼稚T細胞向效應性T細胞分化。與此同時,Treg和APC在TGF-β的作用下分別表達CD39和CD73,將ATP降解為腺苷。在TGF-β、腺苷、ATRA和mTOR信號通路的共同作用下,幼稚T細胞即可轉化為iTreg。
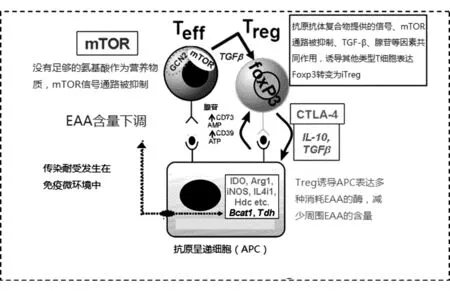
圖1 傳染耐受的發生過程,引自文獻[32]
EAA對幼稚T細胞分化方向的影響已成為免疫代謝研究內容的一部分。當免疫微環境中有足夠氨基酸、糖、脂質等營養物質時,幼稚T細胞傾向于啟動PI3K/AKT/mTOR通路,以有氧糖酵解供能分化為效應性T細胞[33];而當這些營養物質不足時,幼稚T細胞則傾向于啟動LKB1/AMPK通路,以氧化磷酸化供能分化為Treg[34]。傳染耐受模型將各種細胞因子、共刺激因子、APC、腺苷、ATRA等一系列已被證明可調節iTreg生成的因素綜合起來,與最近流行的免疫代謝學說也有很大的交集。研究傳染耐受的調控可能對免疫調節的臨床應用開拓新的思路,值得進一步研究。
4 結 論
盡管iTreg的研究取得了很多進展,但仍有很多關鍵問題尚待解決,包括尋找iTreg特異的表面標志物或表面標志物集合、iTreg在免疫穩態和免疫耐受中的作用范圍、利用傳染耐受有效地在體內誘導大量特異性或非特異性iTreg生成、增強iTreg在體內的穩定性以及iTreg的臨床應用等。
iTreg細胞的最終應用目的是維持正常人的免疫穩態或者誘導移植患者的免疫耐受。過多CD4+效應性T細胞可破壞免疫穩態,誘發自身免疫性疾病,在移植患者中產生移植物抗宿主病(graft-versus-host disease,GVHD)或排斥移植器官;而過多CD4+調節性T細胞會限制免疫系統對外來病原體的正常防御作用和對腫瘤的免疫監視作用[35]。因此,只有對iTreg進行深入研究,才可能使其安全有效地早日應用于臨床。
[1]Zheng Y,Josefowicz S,Chaudhry A,et al.Role of conserved non-coding DNA elements in the Foxp3 gene in regulatory T-cell fate[J].Nature,2010,463(7282):808-812.
[2]Wong J,Mathis D,Benoist C.TCR-based lineage tracing: no evidence for conversion of conventional into regulatory T cells in response to a natural self-antigen in pancreatic islets[J].J Exp Med,2007,204(9):2039-2045.
[3]Haribhai D,Williams JB,Jia S,et al.A requisite role for induced regulatory T cells in tolerance based on expanding antigen receptor diversity[J].Immunity,2011,35(1):109-122.
[4]Round JL,Mazmanian SK.Inducible Foxp3+regulatory T-cell development by a commensal bacterium of the intestinal microbiota[J].Proc Natl Acad Sci U S A,2010,107(27):12204-12209.
[5]Xu W,Lan Q,Chen M,et al.Adoptive transfer of induced-Treg cells effectively attenuates murine airway allergic inflammation[J].PLoS One,2012,7(7):e40314.
[6]Relland LM,Williams JB,Relland GN,et al.The TCR re-pertoires of regulatory and conventional T cells specific for the same foreign antigen are distinct[J].J Immunol,2012,189(7):3566-3574.
[7]Liu X,Nguyen P,Liu W,et al.T cell receptor CDR3 sequence but not recognition characteristics distinguish autoreactive effector and Foxp3(+)regulatory T cells[J].Immunity,2009,31(6):909-920.
[8]Haribhai D,Lin W,Edwards B,et al.A central role for induced regulatory T cells in tolerance induction in experimental colitis[J].J Immunol,2009,182(6):3461-3468.
[9]Daniel V,Sadeghi M,Wang H,et al.CD4+CD25+Foxp3+IFNgamma+CD178+human induced Treg (iTreg)contribute to suppression of alloresponses by apoptosis of responder cells[J].Hum Immunol,2013,74(2):151-162.
[10]Mombaerts P,Iacomini J,Johnson RS,et al.RAG-1-deficient mice have no mature B and T lymphocytes[J].Cell,1992,68(5):869-877.
[11]Lafaille JJ,Nagashima K,Katsuki M,et al.High incidence of spontaneous autoimmune encephalomyelitis in immunodeficient anti-myelin basic protein T cell receptor transgenic mice[J].Cell,1994,78(3):399-408.
[12]Samstein RM,Josefowicz SZ,Arvey A,et al.Extrathymic generation of regulatory T cells in placental mammals mitigates maternal-fetal conflict[J].Cell,2012,150(1):29-38.
[13]Pan F,Yu H,Dang EV,et al.Eos mediates Foxp3-depen-dent gene silencing in CD4+regulatory T cells[J].Science,2009,325(5944):1142-1146.
[14]Thornton AM,Korty PE,Tran DQ,et al.Expression of Helios,an Ikaros transcription factor family member,diffe-rentiates thymic-derived from peripherally induced Foxp3+T regulatory cells[J].J Immunol,2010,184(7):3433-3441.
[15]Verhagen J,Wraith DC.Comment on "Expression of Helios,an Ikaros transcription factor family member,differentiates thymic-derived from peripherally induced Foxp3+T regulatory cells"[J].J Immunol,2010,185(12):7129; author reply 7130.
[16]Gottschalk RA,Corse E,Allison JP.Expression of Helios in peripherally induced Foxp3+regulatory T cells[J].J Immunol,2012,188(3):976-980.
[17]Zabransky DJ,Nirschl CJ,Durham NM,et al.Phenotypic and functional properties of Helios+ regulatory T cells[J].PLoS One,2012,7(3):e34547.
[18]Bruder D,Probst-Kepper M,Westendorf AM,et al.Neuropilin-1: a surface marker of regulatory T cells[J].Eur J Immunol,2004,34(3):623-630.
[19]Weiss JM,Bilate AM,Gobert M,et al.Neuropilin 1 is expressed on thymus-derived natural regulatory T cells,but not mucosa-generated induced Foxp3+T reg cells[J].J Exp Med,2012,209(10):1723-1742,S1721.
[20]Yadav M,Louvet C,Davini D,et al.Neuropilin-1 distinguishes natural and inducible regulatory T cells among regulatory T cell subsets in vivo[J].J Exp Med,2012,209(10):1713-1722,S1711-1719.
[21]Hill JA,Feuerer M,Tash K,et al.Foxp3 transcription-factor-dependent and -independent regulation of the regulatory T cell transcriptional signature[J].Immunity,2007,27(5):786-800.
[22]Gottschalk RA,Corse E,Allison JP.TCR ligand density and affinity determine peripheral induction of Foxp3 in vivo[J].J Exp Med,2010,207(8):1701-1711.
[23]Semple K,Nguyen A,Yu Y,et al.Strong CD28 costimulation suppresses induction of regulatory T cells from naive precursors through Lck signaling[J].Blood,2011,117(11):3096-3103.
[24]Zheng SG,Wang JH,Stohl W,et al.TGF-beta requires CTLA-4 early after T cell activation to induce FoxP3 and ge-nerate adaptive CD4+CD25+regulatory cells[J].J Immunol,2006,176(6):3321-3329.
[25]Francisco LM,Salinas VH,Brown E,et al.PD-L1 regulates the development,maintenance,and function of induced regulatory T cells[J].J Exp Med,2009,206(13):3015-3029.
[26]Strainic MG,Shevach EM,An F,et al.Absence of signaling into CD4(+)cells via C3aR and C5aR enables autoinductive TGF-beta1 signaling and induction of Foxp3(+)regulatory T cells[J].Nat Immunol,2013,14(2):162-171.
[27]Zheng SG,Wang J,Wang P,et al.IL-2 is essential for TGF-beta to convert naive CD4+CD25- cells to CD25+Foxp3+regulatory T cells and for expansion of these cells[J].J Immunol,2007,178(4):2018-2027.
[28]Busse D,de la Rosa M,Hobiger K,et al.Competing feedback loops shape IL-2 signaling between helper and regulatory T lymphocytes in cellular microenvironments[J].Proc Natl Acad Sci U S A,2010,107(7):3058-3063.
[29]Thomas RM,Chunder N,Chen C,et al.Ikaros enforces the costimulatory requirement for IL2 gene expression and is required for anergy induction in CD4+T lymphocytes[J].J Immunol,2007,179(11):7305-7315.
[30]Tone Y,Furuuchi K,Kojima Y,et al.Smad3 and NFAT cooperate to induce Foxp3 expression through its enhancer[J].Nat Immunol,2008,9(2):194-202.
[31]Selvaraj RK,Geiger TL.A kinetic and dynamic analysis of Foxp3 induced in T cells by TGF-beta[J].J Immunol,2007,179(2):11 p following 1390.
[32]Cobbold SP,Adams E,Nolan KF,et al.Connecting the mechanisms of T-cell regulation: dendritic cells as the missing link[J].Immunol Rev,2010,236:203-218.
[33]Rathmell JC.Metabolism and autophagy in the immune system: immunometabolism comes of age[J].Immunol Rev,2012,249(1):5-13.
[34]Blagih J,Krawczyk CM,Jones RG.LKB1 and AMPK: central regulators of lymphocyte metabolism and function[J].Immunol Rev,2012,249(1):59-71.
[35]Shimizu J,Yamazaki S,Sakaguchi S.Induction of tumor immunity by removing CD25+CD4+T cells: a common basis between tumor immunity and autoimmunity[J].J Immunol,1999,163(10):5211-5218.

