布拉氏酵母菌對早產兒腸道菌群定植的影響
劉麗娟
(廊坊市廣陽區婦幼保健院新生兒科,河北廊坊 065000)
·臨床經驗·
布拉氏酵母菌對早產兒腸道菌群定植的影響
劉麗娟
(廊坊市廣陽區婦幼保健院新生兒科,河北廊坊 065000)
目的探討布拉氏酵母菌對腸道菌群定植的作用及其影響因素。方法將我院2013年4月至2014年4月期間出生的60例早產兒隨機分成實驗組和對照組,每組30例。對照組給予常規護理和治療;實驗組在常規護理和治療的基礎上,對早產兒經腸道喂養,同時口服布拉氏酵母菌散劑100 mg/kg,2次/d,用至出院。于入院時、入院后5 d、12 d行直腸拭子菌群培養。收集并分析兩組早產兒的臨床及實驗室資料。結果實驗組和對照組陽性菌株檢出率分別是44.7%和76.7%,差異有統計學意義(P<0.05)。入院第5天、第12天實驗組菌群正常率分別為76.7%和93.3%,明顯高于對照組的26.7%和70.0%(P<0.05)。實驗組腹瀉、喂養不耐受和新生兒壞死性小腸結腸炎(NEC)發生率分別為16.7%、26.7%和0%,低于對照組的50.0%、53.3%和20.0%,兩組比較差異均有統計學意義(P<0.05)。結論布拉氏酵母菌散劑有助于腸道正常菌群的定值,加快腸道微生態平衡的建立,從而減少早產兒罹患腸道性疾病的風險,有效降低死亡率。
布拉氏酵母菌;細菌定植;早產兒
隨著經濟的發展和生活節奏的日益加快,人們的生活和工作壓力也不斷加大,再加上環境污染、輔助生育技術在臨床的普遍開展,使得早產兒發生率呈逐年上升趨勢。有研究表明早產兒的發生率在9.5%[1],死亡率達到7.52%[2]。早產兒因全身各個器官都尚未發育成熟,難以適應子宮內外環境的驟然變化,易發生各種疾病。由于早產兒沒有建立完善的微生態平衡、完善的腸黏膜屏障,加之因抗生素的應用、管飼喂養、新生兒重癥監護環境等造成早產兒正常菌群定植延遲,造成機體免疫功能的降低,致病菌易穿過腸黏膜上皮進入組織、腸系膜淋巴結、器官和血流,引起腸源性感染,如腹瀉、新生兒壞死性小腸結腸炎(NEC)、敗血癥等而危及生命。此外,由于早產兒因胃腸功能發育不完善,易發生胃潴留、腹脹和嘔吐等喂養不耐受,嚴重影響生長發育。本文選取近年來在我院出生的30例早產兒,給予口服布拉氏酵母菌,觀察微生態制劑對早產兒腸道菌群定植、腸源性感染和喂養不耐受的影響,現將結果報道如下:
1 資料與方法
1.1 一般資料選擇我院2013年4月至2014年4月期間產科出生胎齡<37周或259 d的新生兒,出生后24 h收入新生兒病房的早產兒60例。排除明顯胃腸道功能異常者;近期有抗真菌藥物接觸史者以及先天性缺陷、消化道畸形、生命體征不穩定患兒。將入選的60例早產兒隨機分成實驗組和對照組,每組各30例。實驗組男性13例,女性17例,平均胎齡(32.1±1.3)周,平均體重(1 590±401.4)克;對照組男性12例,女性18例,平均胎齡(32.2±1.4)周,平均體重(1 588±403.5)克。兩組患兒在出生體重、性別、胎齡、病情、喂養方式、抗生素使用、菌群失調等方面差異均無統計學意義(P>0.05),具有可比性。
1.2 治療方法實驗組在早產兒常規護理的基礎上,對早產兒經腸道喂養同時口服布拉氏酵母菌散劑(億活)(法國百科達制藥廠生產,國藥準字S20100086)。含凍干活布拉氏酵母菌282.5 mg/袋,相當于250 mg酵母,按100 mg/kg,2次/d。服用方法:(1)放入少量水或糖水中,混合后吞服;(2)將小袋內的藥粉拌在不太冷或太燙的食物中;(3)胃腸管飼時,將藥物加到制備的營養液內;(4)避免與開水、冰水或含酒精的飲料等降低布拉氏酵母活性的方式服用。對照組僅給予早產兒常規護理,不服用布拉氏酵母菌散劑或其他益生菌。
1.3 細菌定植及菌群失調的概念定植:指從患者身上分離出細菌但無感染癥狀[5]。菌群正常:腸道菌群通過與宿主之間的動態性生理作用,達到微生態平衡,有效防止腸道內細菌及內毒素易位;菌群失調:指腸道正常微生態的失調[6]。
1.4 細菌培養所有早產兒于入院時、入院后5 d和12 d進行直腸拭子培養。取無菌棉簽蘸取無菌鹽水濕潤后,插入肛門2~3 cm,沿著腸管輕輕轉動15~30 s,以便病原菌吸附在拭子上,取出置于無菌試管中,接種到血培養瓊脂培養基上。在37°C空氣中培養18~24 h后采用全自動微生物鑒定系統MicroScan walkaway-40細菌分析儀(美國Dade Behring公司制造)進行細菌分離鑒定,詳細記錄每位早產兒的臨床及實驗室資料。
1.5 腸源性感染和喂養不耐受的診斷標準腸源性感染的新生兒腹瀉符合《諸福棠實用兒科學》第7版的小兒腹瀉診斷標準[3],大便性狀有改變,呈稀便、水樣便、黏液便或膿血便;大便次數比平時增多。喂養不耐受符合《實用新生兒學》中的診斷標準[4]:①嘔吐≥3次/d;②奶量不增加或減少,持續3 d以上;③胃潴留量大于前次喂養量的1/3;④腹脹。
1.6 統計學方法采用SPSS20.0統計軟件對數據進行統計分析。計數資料以絕對數或構成比(%)表示,組間比較采用χ2檢驗,不符合χ2檢驗條件的采用確切概率法,以P<0.05表示差異有統計學意義。
2 結果
2.1 定植菌種類及分布共送檢直腸拭子標本300份,共培養細菌182株。實驗組30例早產兒150份標本培養出細菌67株,陽性菌株檢出率為44.7%,其中腸球菌株占35.8%(24/67),其次是大腸埃希菌株25.4%(17/67)。對照組30例患兒150份標本培養出細菌115株,陽性菌株檢出率為76.7%,其中腸球菌株占36.5%(42/115);其次是大腸埃希菌株占30.4% (35/115)。兩組在細菌分布上差異無統計學意義(Fisher確切概率法P=1.000);細菌陽性檢出率差異有統計學意義(χ2=32.185,P<0.05),見表1。

表1 兩組定植菌種類及分布情況(株)
2.2 兩組腸道菌群定植情況比較入院第5天和第12天,實驗組腸道菌群正常率明顯高于對照組,差異均有統計學意義(P<0.05),見表2。
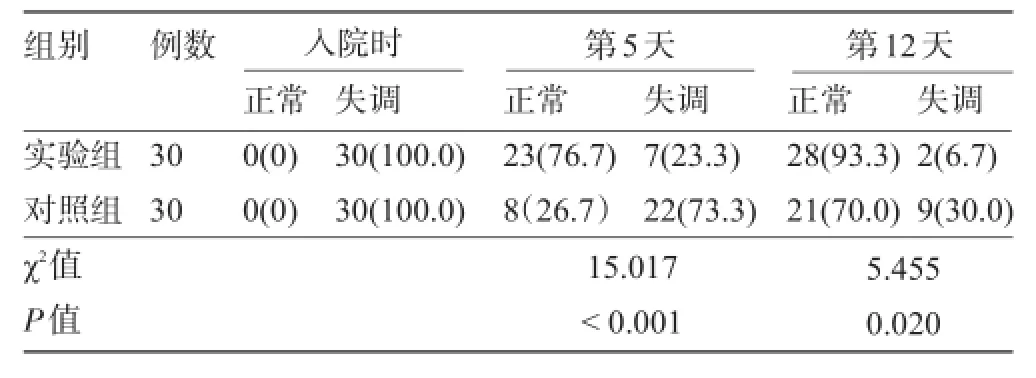
表2 兩組早產兒住院期間腸道菌群定植情況比較[例(%)]
2.3 腸源性感染和喂養不耐受情況實驗組腹瀉、喂養不耐受和NEC發生率明顯低于對照組,差異有統計學意義(P<0.05),見表3。兩組早產兒均未出現皮疹、胃腸道不良反應和新生兒敗血癥等不良反應。
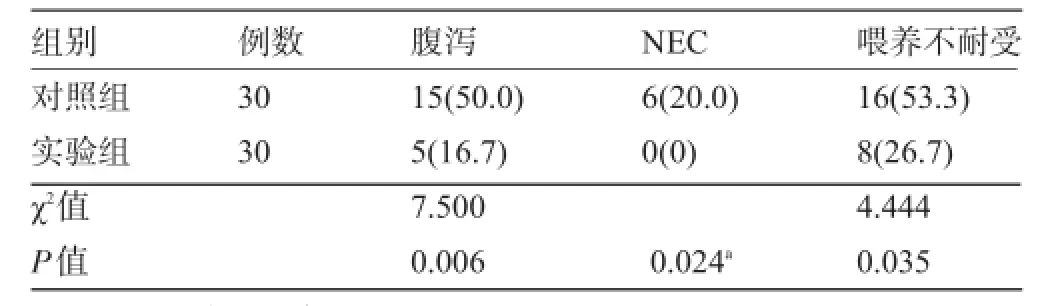
表3 腸源性感染和喂養不耐受情況[例(%)]
3 討論
正常人體腸道是一個龐大、復雜的微生態系統,成人含有約10 M個腸內菌,約400多種,主要是專性厭氧菌,以雙歧桿菌和糞桿菌為主,主要分布在結腸部位,其他部位的菌群相對較少[7]。2歲以下嬰幼兒在母乳喂養下主要的厭氧菌是雙歧桿菌、乳酸桿菌等[8]。新生兒腸道正常菌群的定植是一個動態過程,正常菌群的定植有利于刺激免疫系統的成熟,抵抗病原微生物的入侵和促進機體新生代謝。早產兒由于出生體重低、抗生素的應用、管飼喂養、重癥監護環境等造成其正常菌群定植延遲,機體免疫功能的降低,導致病原微生物感染、自身免疫性疾病等發生的危險性增高。
文獻表明,益生菌不僅可以減少早產兒胃腸道致病菌的定植,還可以促進全身免疫系統的成熟[9-11]。本研究發現,實驗組病原菌的陽性檢出率為44.7%,低于對照組的76.7%,差異有統計學意義(χ2=32.185,P<0.01),但是菌群種類分布差異無統計學意義(P>0.05),說明了布拉氏酵母菌可降低細菌的陽性檢出率,但是不能改變菌群的構成比,這與國內的研究一致[12-13]。實驗組入院第5天和第12天腸道菌群正常率分別為76.7%和93.3%,明顯高于對照組的26.7%和70.0%,兩組腸道菌群正常率差異有統計學意義(P<0.05),提示了布拉氏酵母菌作為微生態調節劑,促進有益健康的厭氧菌的生長和定植,且隨服用時間的延長效果也更加明顯,這與國內的研究一致[12]。
早產兒對布拉氏酵母菌具有良好的耐受性,現用于治療腹瀉、新生兒黃疸等疾病已取得良好的療效[14-16]。本研究表明,實驗組腹瀉和NEC的發生率分別為16.7%和0%,低于對照組的50.0%和20.0%,提示布拉氏酵母菌對治療腹瀉和新生兒壞死性小腸結腸炎(NEC)的發生有一定療效。布拉氏酵母菌可通過調節腸道的微生態系統、產生釋放多胺類物質,抑制致病菌過度生長繁殖的作用,從而發揮治療胃腸功能紊亂性的作用。此外,由于布拉氏酵母菌在消化系統中存活時間長,不易被胃酸、膽酸、抗生素等破壞,除調整腸道微生態環境等作用,還能激活網狀內皮系統和補體系統,通過抑制病原對黏膜細胞的黏附和侵襲發揮抗致病微生物的作用,提高人小腸免疫球蛋白(S-IgA)的分泌,以增強宿主的免疫功能,減少了腹瀉和NEC的發生[16]。
由于早產兒胃腸功能發育不完善,常出現為胃潴留、嘔吐、腹脹、便秘、胃管內抽出膽汁等喂養不耐受現象。本研究發現,實驗組喂養不耐受發生率為26.7%,低于對照組的53.3%,差異有統計學意義(χ2= 4.444,P=0.035),表明布拉氏酵母菌在促進腸道有益菌定植的情況下,能減少早產兒喂養不耐受的發生,與有關文獻報道一致[17]。有報道認為,益生菌可通過建立胃腸道正常菌群,營養胃腸黏膜細胞,提高胃腸道酸度,有效促進早產兒胃泌素和胃動力素等胃腸激素的分泌,從而減少了喂養不耐受[18]。
本研究未發現使用布拉氏酵母菌的有關不良反應,與之前的較大樣本研究結果一致,支持了早產兒使用益生菌制劑有較高的安全性[9]。由于早產兒的特殊性,存在個體差異,且本研究樣本量有限,尚未完全確認其安全性,今后仍需加強對布拉氏酵母菌使用的研究和效果評價。
綜上所述,布拉氏酵母菌作為微生態制劑,早產兒服用后有助于腸道正常菌群的定值,加快腸道微生態平衡的建立,從而減少早產兒罹患腸道性疾病的風險,有效降低死亡率。
[1]孔麗萍,余章斌,韓樹萍,等.晚期早產兒流行病學特點的文獻分析[J].護理管理雜志,2012,12(6):389-402.
[2]黃小鳳,郭舒文,林斌松.早產兒死亡因素分析與護理對策[J].齊齊哈爾醫學院學報,2011,32(20):3397-3399.
[3]胡亞美,江載芳.諸福棠實用兒科學[M].7版.北京:人民衛生出版社,2002:1289-1294.
[4]金漢珍,黃德珉,官希吉.實用新生兒學[M].3版.北京:人民衛生出版社,2003:192.
[5]劉健慧,王丹華.新生兒重癥監護病房早產兒細菌定植的臨床研究[J].中國實用兒科雜志,2006,21(1):41-44.
[6]胡詠,周國華.腸道菌群失調常見病因的研究進展[J].醫學綜述,2011,17(2):239-241.
[7]Agarwal RK.Probiotics—the health friendly gut bacteria[J].Indian Pediatr,2008,45:953-954.
[8]張高娜,張建梅,谷巍.影響嬰兒腸道菌群構成因素的研究進展[J].藥學研究,2013,32(12):716-718.
[9]Wang Q,Dong J,Zhu Y.Probiotic supplement reduces risk of necrotizing enterocolitis and mortality in preterm very lowbirth-weight infants:an updated meta-analysis of 20 randomized,controlled Trials [J].J Pediat Surg,2012,47:241-248.
[10]Zhu HJ,Cai Y.Effects of bacillus bifidus supplementation on the immunity in very-low-birth-weight infants[J].Chin J Contemp Pediat,2011,13(12):944-946.
[11]楊冰巖,張泉山,楊春暉,等.42例新生兒壞死性小腸結腸炎危險因素分析[J].海南醫學,2013,24(10):1522-1523.
[12]任亞方,王琍琍.微生態制劑對早產兒腸道細菌定植的影響[J].中國當代兒科雜志,2010,12(3):192-194.
[13]徐焱,王丹華,徐英春.新生兒重癥監護病房部分定植細菌定植特點及變化規律[J].臨床兒科雜志,2008,26(3):209-212.
[14]林蕊艷,楊莉.布拉氏酵母菌治療小兒急性腹瀉的臨床研究[J].中國實用醫藥,2013,8(33):6-8.
[15]Generoso SV,Viana ML,Santos RG,et al.Protection against increased intestinal permeability and bacterial translocation induced by intestinal obstruction in mice treated with viable and heat-killed Saccharomyces boulardii[J].Eur J Nutr,2011,50:261-269.
[16]白淑霞,付宇,丁希偉,等.布拉氏酵母菌防治嬰幼兒抗生素相關性腹瀉[J].醫藥導報,2012,31(5):605-607.
[17]朱將虎,葉曉華,葉偉,等.早產兒口服布拉氏酵母菌的臨床觀察[J].中國新生兒科雜志,2012,27(6):398-400.
[18]呂霞,張素平,趙倩.益生菌治療早產兒喂養不耐受臨床分析[J].長治醫學院學報,2012,26(3):207-209.
Effect of Saccharomyces boulardii on intestinal bacterial colonization in premature infants.
LIU Li-juan.
Department of Neonatology,Maternal Health Center of Guangyang District of Langfang,Langfang 065000,Hebei,CHINA
ObjectiveTo explore the effect of Saccharomyces boulardii on intestinal bacterial colonization and its influence factors.MethodsSixty infants were randomly divided into experiment group and control group(30 cases in each group).The experiment group was administered with oral Saccharomyces boulardii powder(100 mg/kg,twice daily)24 h after birth in addition to conventional treatment,while the control group received conventional treatment only. Rectal swab cultures were done at admission,5 and 12 d after admission.Clinical and laboratory findings were analyzed..ResultsThe positive rate of bacterial in the experiment group was 44.7%,which was lower than that(76.7%)in control group(P<0.05).The rates of normal bacteria flora at 5 d,12 d after admission in the experiment group were 76.7%,93.3%respectively,which were significantly higher than those(26.7%,70.0%)in the control group(P<0.05). The incidences of Diarrhoea,feeding intolerance and neonatal necrotizing enterocolitis(NEC)in the experiment group were 16.7%,26.7%and 0%,respectively,,which were lower than those(50.0%,53.3%and 20.0%)in the control group(P<0.05).ConclusionSaccharomyces boulardii can improve bacterial colonization and promote the balance of microecological in intestinal,which can reduce the incidence of diarrhea and mortality in premature infants.
Saccharomyces boulardii;Bacterial colonization;Premature infant
R722
A
1003—6350(2014)22—3390—03
10.3969/j.issn.1003-6350.2014.22.1327
2014-07-10)
廊坊市科技支撐計劃項目(編號:2013013045)
劉麗娟。E-mail:sea_iceland@163.com

