共表達KnobS蛋白與LTB蛋白的重組干酪乳桿菌構建
付錦楠,郭建軍,袁 林,傅筱沖,何順華
(江西省科學院微生物研究所,江西 南昌330096)
0 前言
減蛋綜合征病毒(egg drop syndrome virus,EDSV)屬禽類腺病毒,主要引起產薄殼蛋或無殼蛋、產蛋量迅速下降等特征。EDSV病毒是由11種大小從14 ku到97 ku不等的蛋白組成,其中纖維蛋白(fiber)是腺病毒的主要結構蛋白,可以識別細胞膜上的特異性受體[1],即病毒粒子通過纖維蛋白與細胞膜受體結合引起感染,纖維蛋白還可以阻斷大分子的合成,抑制病毒的增殖,且帶有主要的屬和亞屬特異性抗原決定簇及次要的種特異性抗原決定簇,同時也是EDSV的主要保護性抗原成分[2]。針對減蛋綜合征病毒黏膜感染特點和減蛋綜合征病毒纖維蛋白在疾病防治中所起的重要作用,設計以纖維蛋白KnobS為免疫原的黏膜免疫系統作為抵御病原入侵的第一道防線,對科學防治本病具有重要意義。
在疾病防治中,只能靠注射減蛋綜合征疫苗來預防。由于注射極不方便,人們迫切希望有口服疫苗面市。用何種菌來表達減蛋綜合征病毒纖維蛋白KnobS是該口服疫苗的關鍵所在。如果能利用乳酸菌表達和傳遞外源抗原進行黏膜免疫,無疑是最為安全有效的活菌疫苗。但乳酸菌作為載體表達外源抗原、存在外源抗原表達量低、免疫原性差,且有些乳酸菌表達的產物存在細胞內不能被免疫細胞識別和提呈等不足[3],因此如何提高乳酸菌外源抗原對黏膜免疫系統的刺激以及增加抗原與免疫細胞接觸,是提高乳酸菌黏膜免疫應答的重要技術環節[4,5]。
本實驗利用乳酸桿菌在腸道的黏附特性、耐膽汁酸鹽、耐胰酶和在腸道的定殖和對機體的益生作用,構建表達減蛋綜合征病毒纖維蛋白KnobS重組乳酸菌系統,為促進外源抗原對黏膜刺激的穩定性和持久性,在表達系統中插入了具有黏膜免疫佐劑的大腸桿菌不耐熱腸毒素B亞單位(LTB),實現了KnobS蛋白與LTB在乳酸菌的共表達,從而為進一步研制EDS的口服活菌疫苗奠定了物質基礎。
1 材料和方法
1.1 材料
1.1.1 試驗材料 質粒pET28a-KnobS,重組質粒pMG36e-UP/L-LTB,大腸桿菌DH5α,干酪乳桿菌Lactobacillus casei 393由本室保存。
1.1.2 主要試劑 高保真DNA聚合酶、T4 DNA連接酶、DL2000 Marker、蛋白質Marker、限制性內切酶均購自大連TaKaRa公司;MRS培養基購自Oxoid公司;質粒抽提試劑盒、DNA純化試劑盒購自愛思進公司;抗EDSV血清和抗LTB血清購自中國獸醫藥品監察所;HRP標記羊抗雞IgG為KPL公司產品;電擊杯為BioRad產品;引物委托上海英俊公司合成,其余試劑均為國產分析純。
1.1.3 引物 上游引物P1含SalⅠ酶切位點,下游引物P2含PstⅠ酶切位點,用于擴增KnobS基因,約700 bp。引物CX2、CX2用于擴增LTB基因;引物CX1、CX3用于鑒定KnobS-LTB目的基因片段,引物序列如下:
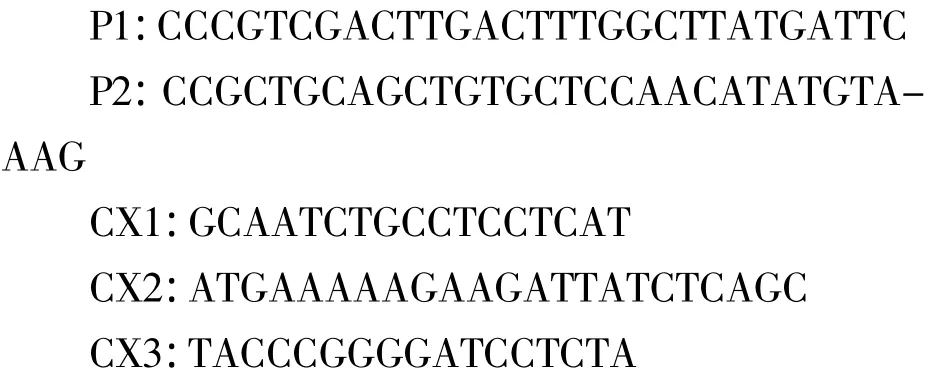
1.2 方法
1.2.1 重組干酪乳桿菌的構建及鑒定 以pET28a-KnobS為模版,P1和P2為引物,PCR擴增目的基因 KnobS,反應體系50 μL:5X PCR Primer STAR Buffer 10 μL,dNTP Mixture 4 μL,模板1 μL,引物各1 μL,Primer STAR HS DNA Polymerase 0.5 μL,補水至50 μL。反應條件如下:94℃預變性30;94℃15 s,50℃15 s,72℃30 s,共28個循環;72℃延伸5 min。將膠回收的PCR產物KnobS和表達質粒載體pMG36e-UP/L-LTB分別進行Sal和PstⅠ雙酶切,連接過夜,連接產物電轉化感受態細胞干酪乳桿菌Lactobacillus casei 393[5]。
取適量菌液涂布于含有 10 μg/mL Cm的MRS瓊脂培養基上,37℃ 厭氧培養36 h。挑取單個菌落,接種于含有10 μg/mL Cm的MRS液體培養基中,37℃厭氧培養過夜,提取質粒。對重組質粒進行酶切鑒定、以引物CX1、CX3進行PCR鑒定,并對疑似陽性重組質粒進行序列測定,獲得的陽性重組質粒乳酸桿菌命名為pMG36e-UP/LTB-KnobS/Lactobacillus casei 393。
1.2.2 目的蛋白的誘導表達 pMG36e-UP/LTBKnobS/Lactobacillus casei 393陽性重組菌落接種于MRS液體培養基中,37℃厭氧培養過夜活化,取過夜培養菌以1∶20比例接種于MRS培養基中進行培養。樣品處理:誘導表達菌液以6 000 r/min離心5 min,收集上清,加入SDS-PAGE樣品緩沖液(含DTT),混勻,沸水浴10 min;12 000 r/ min離心5 min。優化表達條件,對重組細菌擴大培養,采用Ni-NTA離子親和層析純化重組蛋白。
1.2.3 表達產物的鑒定 同時設pMG36e-UP/LLTB/Lactobacillus casei 393為陰性對照進行SDSPAGE電泳及Western Blot分析,確定目的蛋白表達。重組蛋白樣品經SDS-PAGE后,將電泳后的蛋白轉移到 NC膜上,按照文獻方法[2~5]進行Western blot檢測,用5%脫脂乳37℃封閉2 h,用PBST洗3次;分別以雞抗EDSV高免血清和抗LTB高免血清為一抗,1∶500稀釋,37℃孵育2 h,PBST洗3次,再與二抗為HRP標記羊抗雞IgG(1∶2 000稀釋)作用1 h,PBST洗3次;DAB顯色15~30 min,置蒸餾水中止顯色。
1.2.4 雞抗KnobS蛋白陽性血清與雞紅細胞的血凝抑制試驗 根據EDSV的血凝價,配制4個血凝單位的病毒液。在96孔V形微量反應板中,每孔加入PBS 2.5 μL,第1孔加入雞抗KnobS蛋白陽性血清2.5 μL,依次倍比稀釋至每10孔,棄去2.5 μL,加入4單位病毒至倒數第2孔,室溫作用30 min,最后一孔補2.5 μL PBS,加入10 mL/L的紅細胞,室溫放置30 min后,觀察結果。
2 結果與分析
2.1 重組干酪乳桿菌表達質粒 pMG36e-UP/ LTB-KnobS的鑒定
以P1、P2為引物,pET28a-KnobS為模板,經PCR擴增獲得約708bp的基因片段(見圖1),該片段經1%瓊脂糖凝膠純化,純化產物用Sal和PstⅠ雙酶切,與相同雙酶切的載體質粒pMG36e-UP/L-LTB進行連接,電轉化 Lactobacillus casei 393,經氯霉素MRS平板培養基選擇培養,挑取,單個菌落 pMG36e-UP/LTB-KnobS/Lactobacillus casei 393擴大培養,提取質粒后,經Sal和PstⅠ單酶切約有4.5 Kb的目的片段,雙酶切分別切出3 700 bp和1 200 bp目的片段,PCR鑒定擴增出約1 200 bp的基因片段(見圖2),測序鑒定結果表明外源基因KnobS正確插入pMG36e-UP/LTB中。
2.2 融合蛋白LTB-KnobS在干酪乳桿菌中的表達
對重組的pMG36e-UP/LTB-KnobS和pMG36e空載體干酪乳桿菌Lactobacillus casei 393進行誘導表達(見圖3),結果在約41 kDa近出現目的條帶,而空載體并未出現,說明LTB-KnobS可能在干酪乳桿菌中得到表達。從圖3中誘導的情況看,在培養8 h后表達量開始逐漸增加,培養32 h后達到最大量,然后在培養40 h、48 h后表達量基本保持一致。
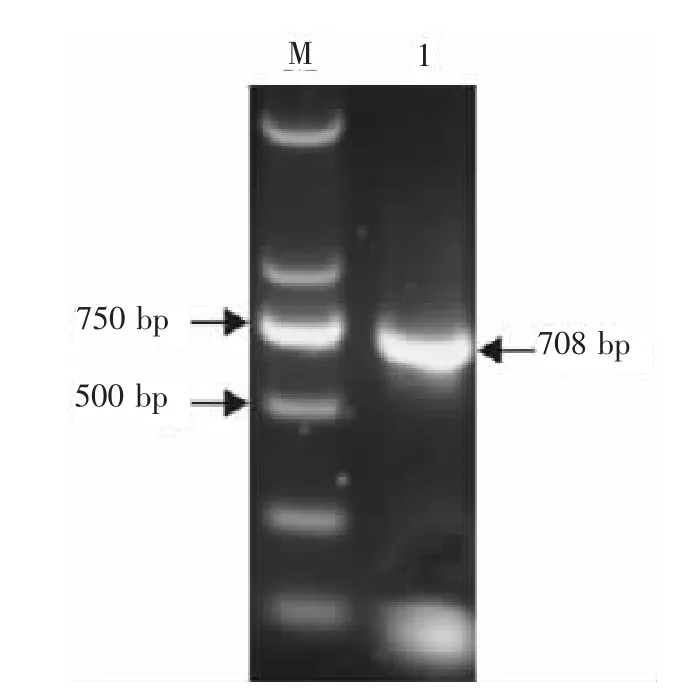
圖1 EDSV纖維蛋白KnobS基因的PCR產物電泳圖
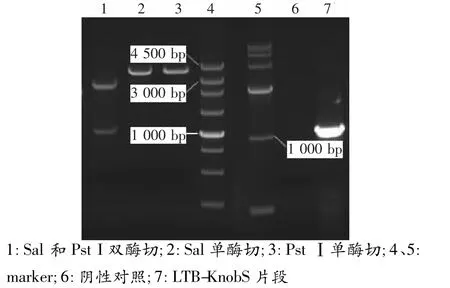
圖2 重組質粒pMG36e-UP/LTB-KnobS的鑒定
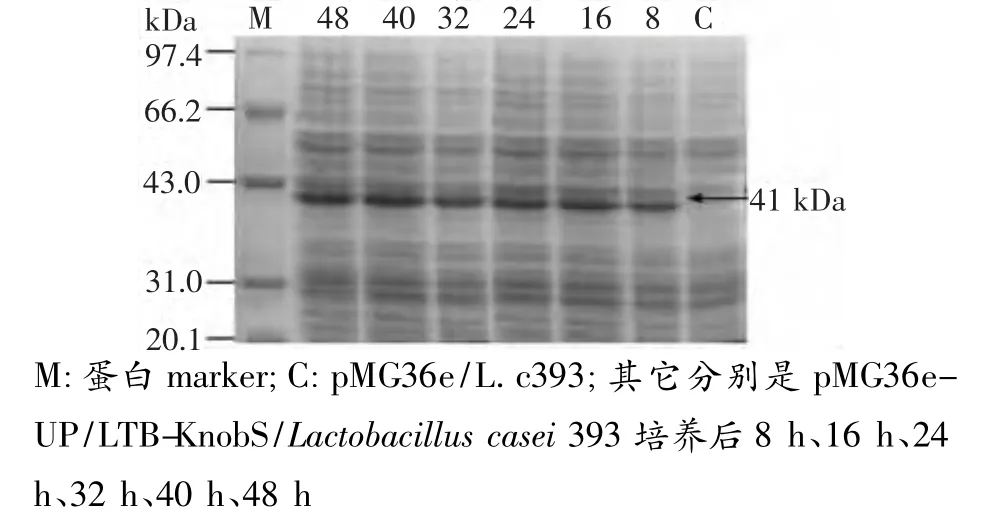
圖3 SDS-PAGE電泳檢測融合蛋白LTB-KnobS在干酪乳桿菌中的表達情況
2.3 重組融合蛋白的活性分析
表達的重組融合蛋白經純化后不能與雞紅細胞發生凝集,說明重組蛋白無血凝活性。利用抗EDSV高免血清或抗LTB高免血清與重組融合LTB-KnobS蛋白進行western blot分析,在41 ku處出現清晰的印跡帶,而不與其他雜蛋白反應(圖4),表明重組蛋白有很好的反應活性。因此,重組蛋白具有較好的免疫原性。
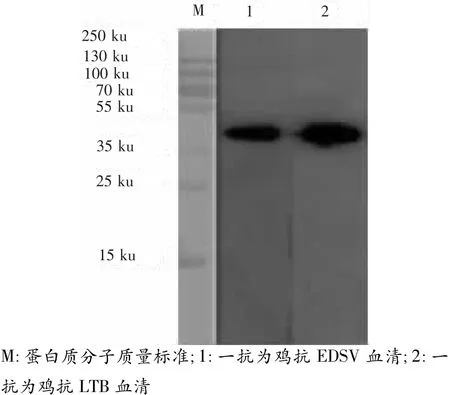
圖4 重組蛋白LTB-KnobS的western blot分析
3 討論
以細菌、病毒作為活載體均可表達外源蛋白,但從生物安全性及疫苗免疫效果角度出發,能在腸道黏膜定植的乳酸菌被認為是最合適的載體系統。干酪乳桿菌是定植于人及動物腸道黏膜表面的重要益生菌群之一,作為表達和傳遞外源基因的載體系統[3],具有益生性安全性以及可以通過先天性免疫激活腸道黏膜免疫系統,不會刺激體產生抗體等重要特點。胞內表達、分泌表達、表面表達是目前研制乳酸桿菌活載體疫苗的主要表達形式。其中,分泌表達的蛋白質不易被蛋白酶降解,且保持較好的活性。Bermudez[6]等證明胞內和分泌形式的重組乳酸乳球菌表達的lFN-ω雖然均具有活性,但分泌型菌株表達的lFN-ω活性比在細胞質中表達的高兩倍。Reveneau[7]等證明以乳酸菌作為抗原傳遞載體的口服疫苗刺激機體產生免疫應答與抗原表達的部位密切相關。本實驗中使用的分泌型表達系統,在一定程度上保證了蛋白的表達量和蛋白活性。
纖維蛋白是EDSV的主要結構蛋白,其五鄰體與六鄰體一起構成病毒核衣殼,決定病毒粒子的大小。纖維蛋白帶有主要的種特異性抗原決定簇和次要的亞屬特異性抗原決定簇,是具有中和活性的抗原,其中和作用是阻斷病毒體從酸性的核內質進入細胞,從而中和病毒。國內外學者對這纖維蛋白的研究表明,纖維蛋白的KnobS區[8]不但可識別宿主細胞受體而且能增強病毒的吸附,若病毒的KnobS區遭到破壞,即可阻止病毒的感染,因而,用EDSV纖維蛋白KnobS區作為免疫原,研究其誘導機體產生有效抗體來阻止病毒感染是可行的。
LTB作為黏膜免疫佐劑,能傳遞黏膜抗原信息,增加抗原特異性T細胞克隆的增殖和分化。LTB可激活Thl途徑,不易引起變態反應,同時能增大抗原分子量,提高外源抗原的免疫原性,亦能提高CD8+T細胞對病毒感染細胞的殺傷力[3,5]。根據這一特點將LTB設計成為靶向分子,推測其與抗原分子的結合,有助于促進細胞對抗原分子的吸收。因此,本試驗將編碼減蛋綜合征病毒主要免疫保護性抗原纖維蛋白KnobS與大腸桿菌不耐熱腸毒素B亞單位(LTB)基因插入干酪乳酸桿菌分泌表達載體,構建共表達減蛋綜合征病毒纖維蛋白KnobS與LTB的重組干酪乳桿菌;SDS-PAGE、Western-blot分析,以及血凝抑制試驗均表明,該融合蛋白LTB-KnobS獲得了正確表達;實現了LTB和減蛋綜合征病毒纖維蛋白KnobS在乳酸桿菌的分泌融合表達。該重組干酪乳桿菌在動物免疫中,能否有效刺激機體免疫應答,LTB對KnobS是否具有免疫增強作用,尚需進一步進行動物免疫加以驗證。
[1] 陳 滔,唐應華,陸吉虎,等.產蛋下降綜合征病毒纖突蛋白Knob-S區原核表達及其活性分析[J].動物醫學進展,2012,33(6):41-44.
[2] 郭建軍,范漢東,楊一兵.減蛋綜合征病毒纖維蛋白主要抗原結構域原核表達及抗原性鑒定[J].畜牧與獸醫,2012,44(2):22-25.
[3] 王相清,歐 迪,任安琦,等.豬細小病毒VP2與大腸桿菌不耐熱腸毒素B亞單位在干酪乳桿菌表面共表達[J].微生物學通訊,2009,36(10):1536-1541.
[4] Seegers J.Lactobacilli as live vaccine delivery vectors: progress and prospects[J].Trends Biotechnology,2002,20(12):508-515.
[5] 付錦楠,楊 罡,何順華,等.大腸桿菌不耐熱腸毒素B亞單位在干酪乳桿菌中的分泌表達[J].江西科學,2012,31(6):764-767.
[6] Bermudez-Humaran L G,Langella P,Commissaire J,et al.Controlled intra or extra cellular production of stap-hylococcal nuclease and ovine omega interferon in Lactococcus lactis[J].FEMS Microbiol Lett,2003,224:307-313.
[7] Reveneau N,Geoffroy M C.Comparison of the immune responses induced by local immunizations with recombinant Lactobacillus plantarum producing tetanus toxin fragment C in different cellular locations[J].Vaccine,2002,20:1769-1777.
[8] Fingerut E,GutterB,Gallili G,et al.Asubunit vaccine against the adenovirus egg drop syndrome using part of its fiber protein[J].Vaccine,2003,21:2761-2766.

