Co-Ni-Fe-Mn配合?沉淀體系的平衡熱力學
馬立文,聶祚仁,席曉麗,韓新罡
(北京工業大學 材料科學與工程學院,北京 100124)
Co、Ni是貴重的有色金屬,廣泛地應用于國防、原子能、航天、化工、電子等高科技領域,是重要的戰略資源。然而,由于原生資源的匱乏,鈷鎳二次資源的回收利用逐漸受到重視,成為研究熱點[1?4]。鈷鎳二次資源主要為報廢的機器、設備、金屬構件、廢舊電池、失效催化劑、廢功能合金、冶煉廢渣及其他化工過程產生的廢料等[5],除含Co和Ni以外,一般還含有Fe、Mn、Cu、Zn、Cd等有價金屬,成分比較復雜,分離較為困難。
鈷鎳二次資源的組成多樣、含量不同,但也具有其特點。廢 Ni-H電池及廢鎳合金含 Ni較高,可達11%~55.6%;廢鋰電池及廢鈷催化劑等含 Co較高,可達10%~50%;鈷鎳之外含量較高的元素主要是Fe、Mn,在某些廢合金及廢渣中可分別達到 70%及24%[6?9]。因此,有效分離 Co、Ni、Fe、Mn是濕法回收鈷鎳二次資源中一個具有普遍意義的問題。鈷鎳二次資源濕法回收過程中涉及的方法主要是化學沉淀法、溶劑萃取法和離子交換法[10?12]。這些方法的主要目的是對二次資源中的復雜多金屬成分進行有效分離。其中沉淀法不僅可以分離金屬組分,還能作為一種反應方法制備共沉淀材料,尤其在引入配合劑的情況下,溶液中金屬離子的配合、沉淀行為更為復雜,但同時也為有目的地調控金屬離子的分離和共沉淀提供了可能性。已有研究者對某些金屬離子在溶液中的配合行為進行了研究[13?14],分析出單一金屬在簡單配合劑作用下的平衡規律;也有不少文獻利用配合?沉淀體系制備共沉淀化合物[15?16],合成出特定比例的產物;但總體而言,配合?沉淀體系的研究還是不夠深入和全面。此外,目前大部分研究二次資源回收的文獻主要關注工藝過程的優化,對二次資源綜合回收的理論研究較少且不系統。因此,如能查明鈷鎳二次資源涉及的多金屬配合?沉淀體系中的各種化學反應熱力學平衡規律,將有利于豐富和完善二次資源綜合回收的理論框架,同時為優化二次資源回收方法提供指導。
本文作者選擇鈷鎳二次資源中最常見的4種金屬元素(Co、Ni、Mn、Fe),以 OH?、NH3為配合劑,OH?、CO32?、S2?為沉淀劑,構建多個配合?沉淀體系,應用同時平衡原理對體系中的化學平衡進行熱力學計算,繪制不同條件的多種熱力學平衡圖,全面、系統地揭示溶液中Co、Ni、Fe、Mn金屬離子的沉淀分離條件及限度,從而為鈷鎳二次資源的綜合回收提供理論依據。
1 配合?沉淀體系中的金屬離子狀態
1.1 Me-OH?體系lg[Me]—pH圖
在Me-H2O體系中,Me(Co、Ni、Fe、Mn)作為待分離的金屬元素,OH?既可以作為弱配合劑又可以作為沉淀劑。根據表1所列化學反應及平衡常數[17]結合質量守恒定律及同時平衡原理,可以建立體系中各反應物種的平衡關系式(1)~(12)。
由水的電離平衡可得到式(1)和(2):

由金屬離子生成氫氧化物的沉淀反應可以得到式(3)~(7):
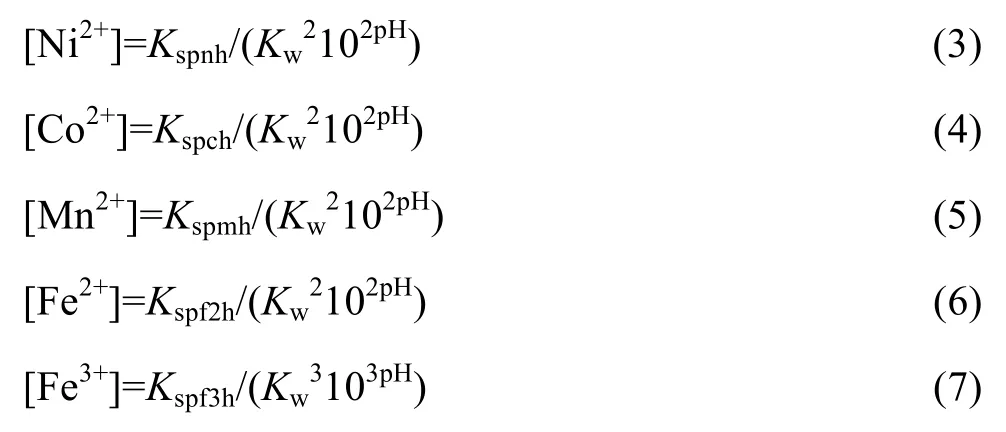
在溶液中,金屬離子能夠與OH?發生配合作用,從而得到溶液中各金屬離子總濃度的表達式(8)~(12):
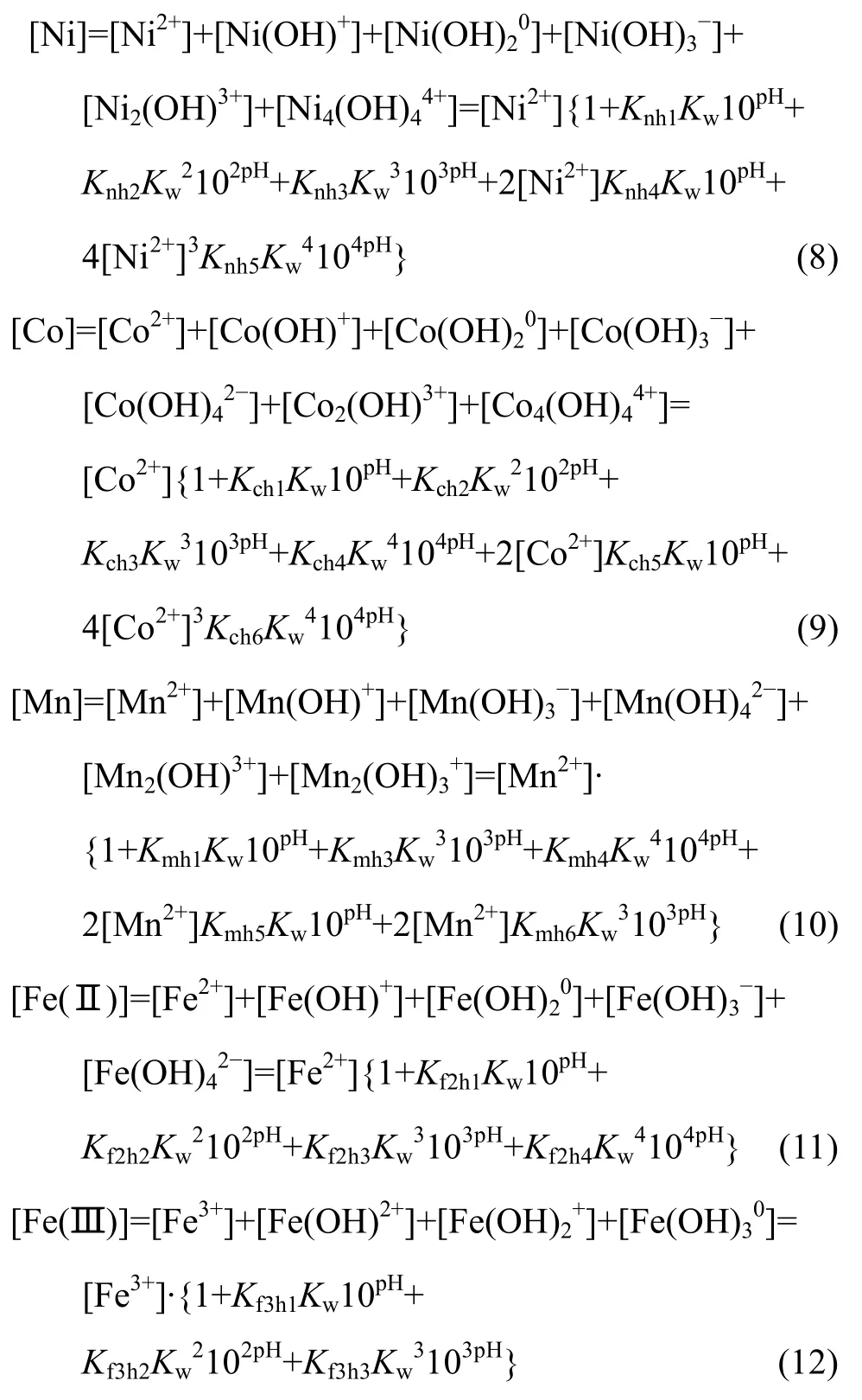
聯立式(1)~(12)可以得到溶液中各金屬離子總濃度與pH值的關系,作lg[Me]—pH圖如圖1所示。從圖1可以看出,隨著pH值的升高,各金屬離子在水中的總濃度下降,到 pH=9.5時不變,說明此時溶液中所有金屬達到沉淀最大值。對于Fe3+,在pH=3時已基本沉淀完全,而其他金屬離子還大量保留在溶液中。因此,理論上可以采用水解的方法在pH=3時預先沉淀Fe(OH)3分離Fe,而其他金屬離子不能通過簡單的水解沉淀加以分離。
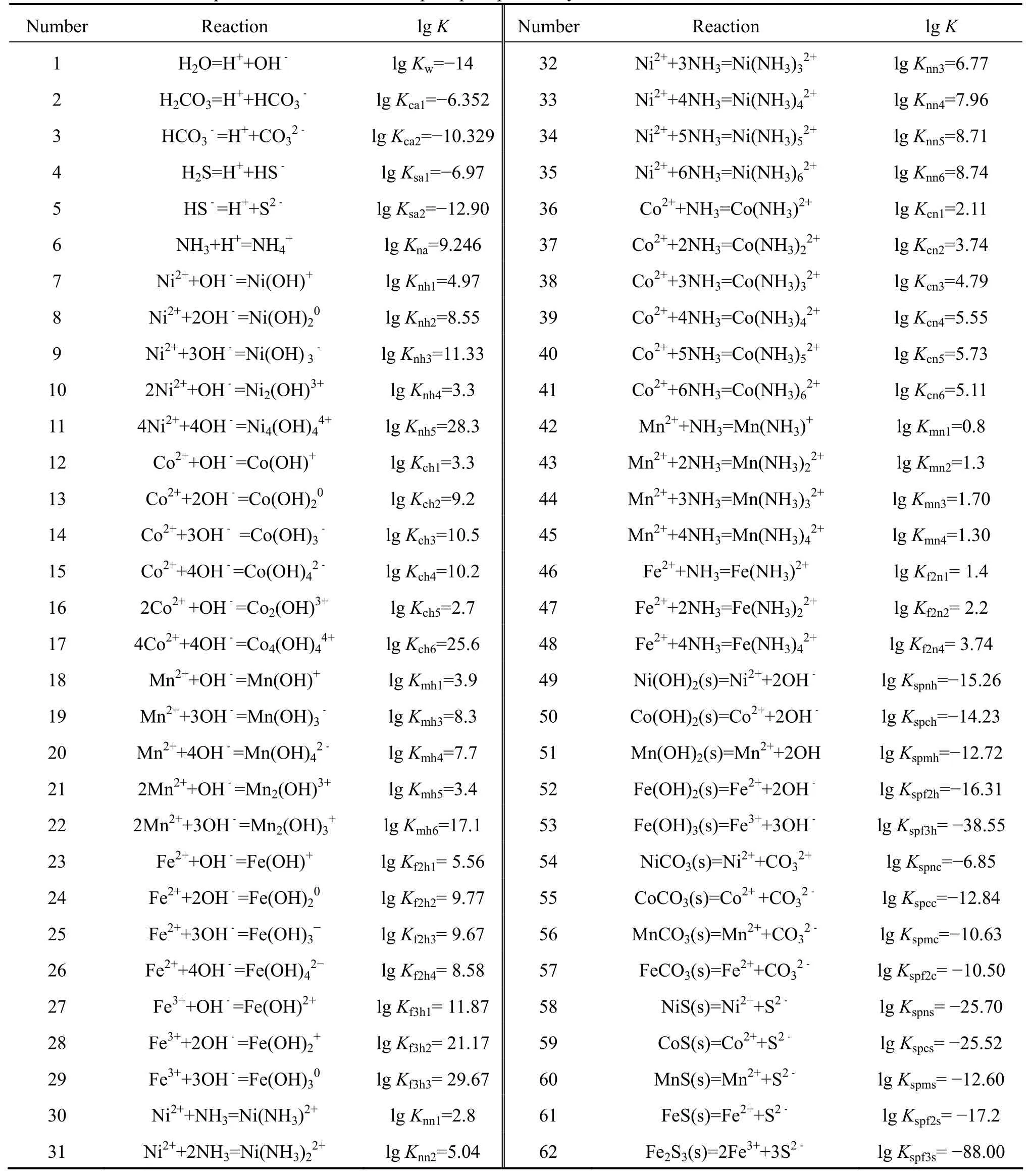
表1 配合?沉淀體系涉及的化學反應及平衡常數[17]Table 1 Reactions and equilibrium constants in complex-precipitation system[17]
1.2 Me-OH?-CO32?體系 lg[Me]—pH 圖
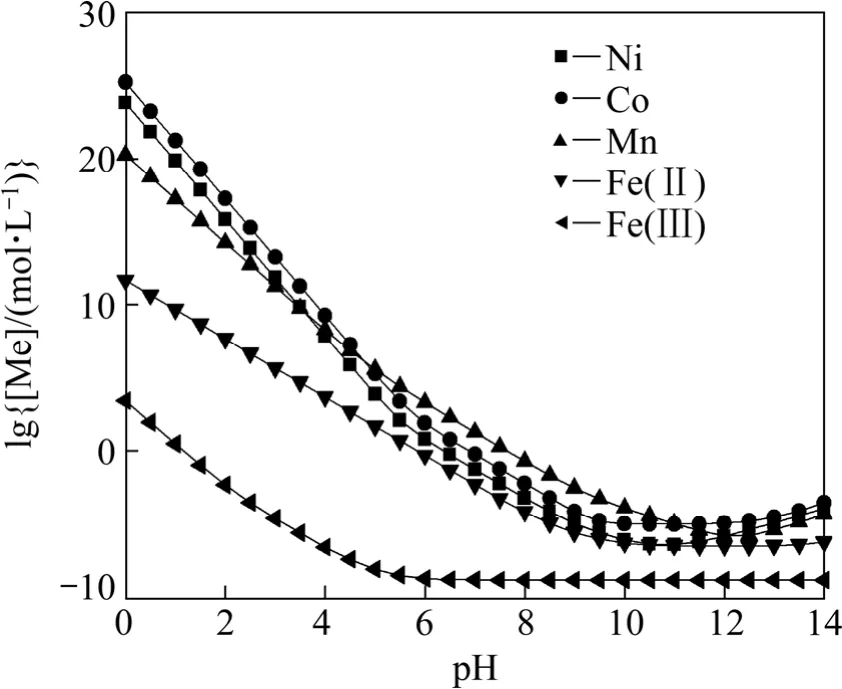
圖1 Me-OH?體系lg[Me]—pH曲線Fig.1 lg[Me]—pH curves in Me-OH? system
在 Me-OH?體系中,OH?既是配合劑,又是沉淀劑,但其沉淀作用對于Ni、Co、Mn、Fe均很接近,故金屬離子未能被選擇性分離,而是共沉淀。為此,可以在體系中再引入沉淀劑 CO32?,考察不同金屬離子的沉淀效果。在Me-OH?-CO32?體系中考慮碳酸的電離,可以得到式(13):
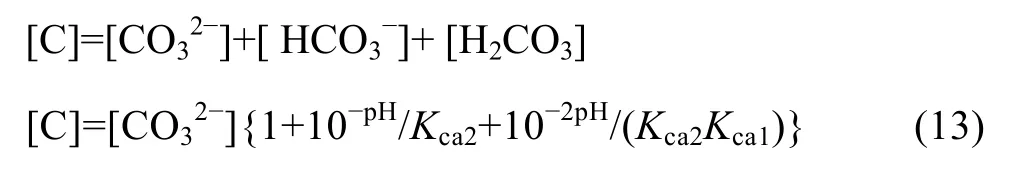
在Me-OH?-CO32?體系中,由于同時有氫氧化物沉淀和碳酸鹽沉淀生成,故溶液中游離金屬離子濃度為該兩種沉淀反應所得離子濃度的最小值:
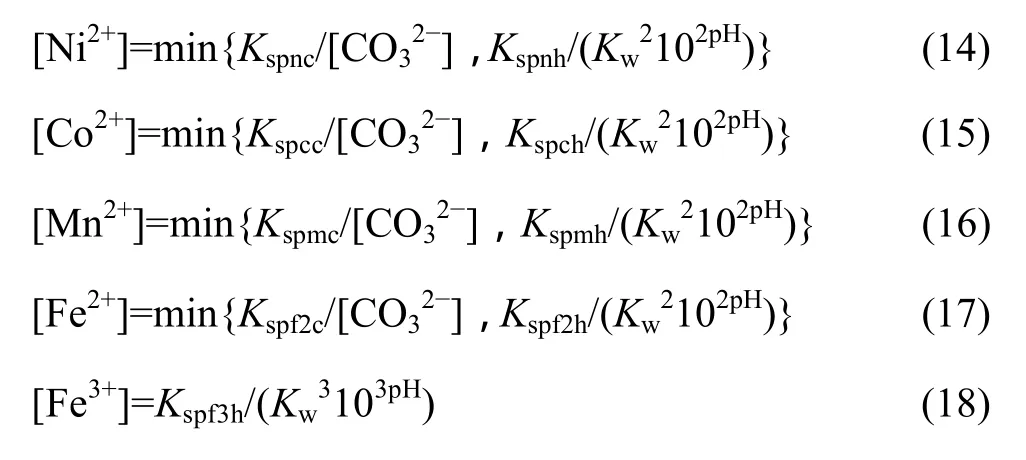
聯立式(1)~(18),在碳酸根總濃度[C]=1 mol/L時可以得到溶液中各金屬離子總濃度與 pH值的關系,作lg[Me]—pH圖如圖2所示。從圖2可以看出,隨著pH值的增加,溶液中的金屬離子濃度先下降后升高,由于各金屬離子在 Me-OH?-CO32?體系中的沉淀趨勢不同,在pH值為6~13范圍內,金屬離子濃度曲線普遍出現一個波谷,其中沉淀趨勢最大的是 Co而最難沉淀的是Ni。由于各金屬離子均能較大程度的沉淀下來,故很難在該體系中直接分離這些金屬。
1.3 Me-OH?-S2?體系 lg[Me]—pH 圖
在 Me-OH?體系的基礎上引入沉淀劑 S2?,得到Me-OH?-S2?體系,考慮體系中 HS的電離,可以得到式(19):
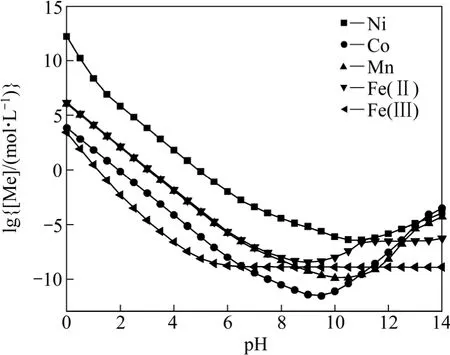
圖2 Me-OH?-CO32?體系 lg[Me]—pH 曲線([C]=1 mol/L)Fig.2 lg[Me]—pH curves in Me-OH?-CO32? system ([C]=1 mol/L)
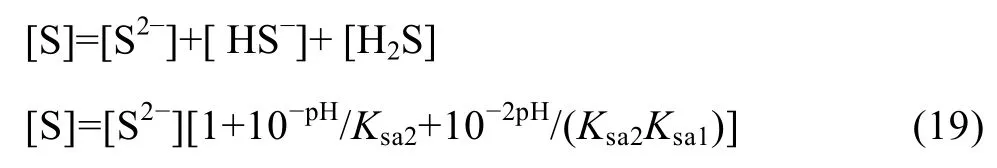
在Me-OH?-S2?體系中,由于同時存在氫氧化物和硫化物沉淀生成,故溶液中游離金屬離子濃度為該兩種沉淀反應所得離子濃度的最小值:
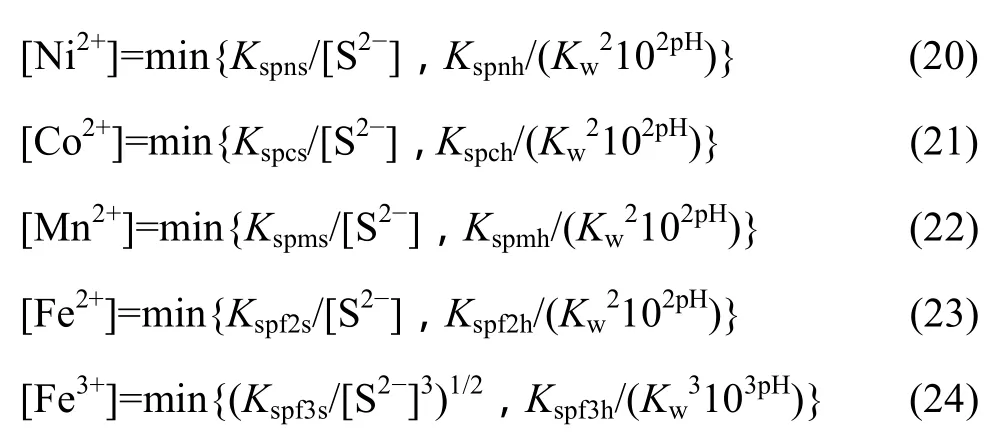
聯立式(1)~(12)、(19)和(20)~(24),可以得到 S2?總濃度[S]=1 mol/L時溶液中各金屬離子總濃度與pH值的關系,作lg[Me]—pH圖如圖3所示。從圖3可以看出,隨著 pH值的增加,溶液中的金屬離子濃度下降。Fe3+平衡濃度最小,最低僅約為 10?26mol/L,說明其硫化物沉淀趨勢最大;其次是 Ni2+和 Co2+,在pH=0時即可沉淀完全。而Fe2+在pH=4,Mn2+在pH=6時才沉淀完全。因此,在Me-OH?-S2?體系中通過控制條件,一定范圍內可以將 Co、Ni和 Fe、Mn進行分離。
1.4 Me-OH?-NH3體系 lg[Me]—pH 圖
在Me-OH?體系中,OH?既是沉淀劑又是配合劑,但OH?配合作用較弱,導致金屬離子容易共沉淀而不易分離。為此,在該體系中引入配合作用較強的配合劑NH3,構建Me-OH?-NH3體系,考察各金屬離子的分離行為的變化。在Me-OH?-NH3體系中存在氨的電離,可以得到式(25)和(26):
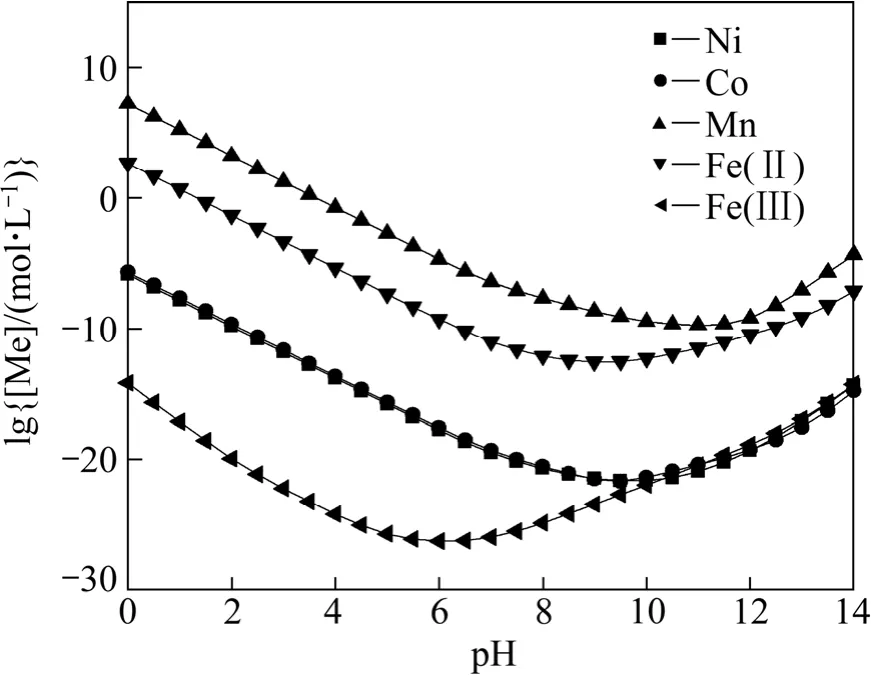
圖3 Me-OH?-S2?體系 lg[Me]—pH 曲線([S]=1 mol/L)Fig.3 lg[Me]—pH curves in Me-OH?-S2? system ([S]=1 mol/L)

在Me-OH?-NH3體系中,金屬離子能夠與OH?、NH3同時發生配合作用,從而得到溶液中金屬離子總濃度的表達式(27)~(31):
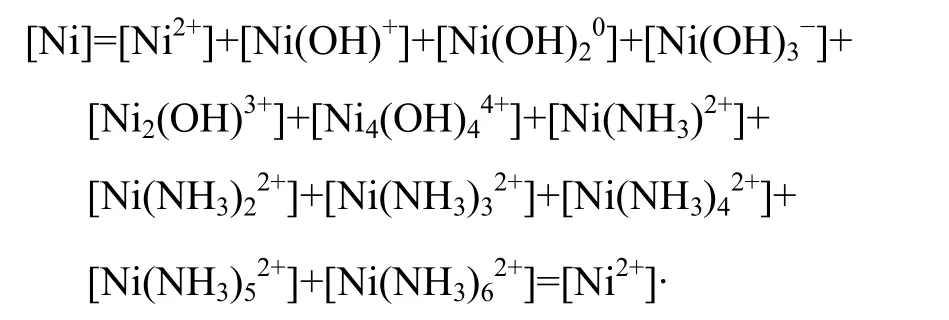

聯 立式(1)~(7)和 (25)~(31)可以得到氨總濃度[N]=1 mol/L時溶液中各金屬離子總濃度與pH值的關系,作lg[Me]—pH圖如圖4所示。從圖4可以看出,氨能夠配合大部分 Ni2+、Co2+、Mn2+,對 Ni2+的配合作用最明顯,而幾乎不配合Fe3+。由此可以認為,金屬元素Ni、Co、Mn、Fe中的Fe,可以以Fe3+的形式在 Me-OH?體系或 Me-OH?-NH3體系中,通過預先調節pH=3初步水解分離。Ni、Co、Mn在Me-OH?-NH3體系中比在 Me-OH?體系中有更好的分離效果,然而分離程度仍然不顯著。
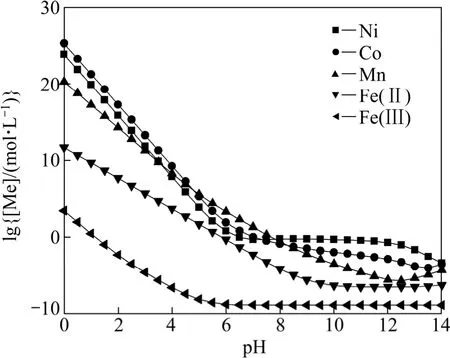
圖4 Me-OH?-NH3體系lg[Me]—pH曲線([N]=1 mol/L)Fig.4 lg[Me]—pH curves in Me-OH?-NH3 system ([N]=1 mol/L)
1.5 Me-OH?-NH3-CO32?體系中的金屬離子狀態
1.5.1 lg[Me]—pH圖
為了進一步探討配合?沉淀體系中 Ni、Co、Mn的分離性能,Me-OH?-CO32?體系中 Ni的沉淀趨勢最小、Co的沉淀趨勢最大、Mn居中,而在Me-OH?-NH3體系中,也是Ni的沉淀趨勢最小。因此,將上述兩個體系復合成 Me-OH?-NH3-CO32?體系,應能增加金屬元素的分離程度。由于該復合體系較為復雜,作為簡化手段,本文作者忽略可能出現的復雜配合物及復鹽。聯立式(13)、(14)~(18)、(26)~(29),得到[C]=1 mol/L、[N]=1 mol/L時金屬離子總濃度lg[Me]與pH的關系,如圖5所示。從圖5可以看出,在pH值約為9~10時,Ni在溶液中濃度最大,Co、Mn濃度最小,Ni與Co、Mn分離趨勢最大。
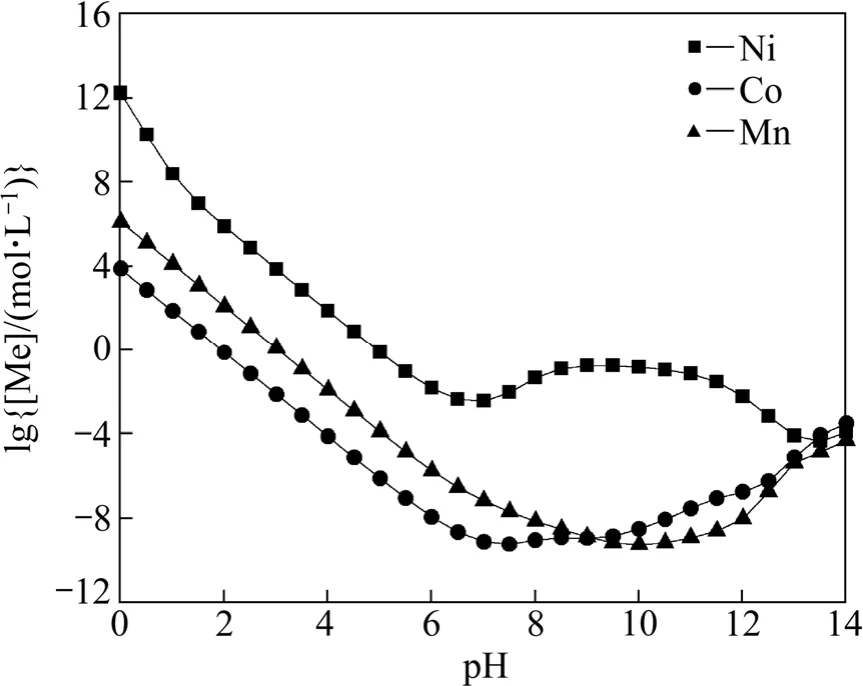
圖5 Me-OH?-NH3-CO32?體系 lg[Me]—pH 曲線([C]=1 mol/L,[N]=1 mol/L)Fig.5 lg[Me]—pH curves in Me-OH?-NH3-CO32? system([C]=1 mol/L, [N]=1 mol/L)
1.5.2 lg[Me]—pH—C圖
由于 Me-OH?-NH3-CO32?體系中沉淀劑和配合劑較多,各為兩種,各沉淀劑和配合劑對溶液中的金屬離子濃度都有影響,故有必要采用三維曲面圖,對不同影響因素進行綜合考慮。圖6所示為[N]=1 mol/L時Me-OH?-NH3-CO32?體系的 lg[Me]—pH—C 曲面圖。從圖6可以看出,當 pH值一定時,隨著[C]增大,Ni濃度基本不變,而Co、Mn濃度輕微減小;當[C]≥1 mol/L時,Co、Mn的濃度也基本不變。當[C]一定時,pH對各金屬離子總濃度的影響較大,大致在pH值為8~12時Ni濃度達到最高峰值而Co、Mn濃度達到最低值,Ni與Co、Mn具有較大的分離趨勢。
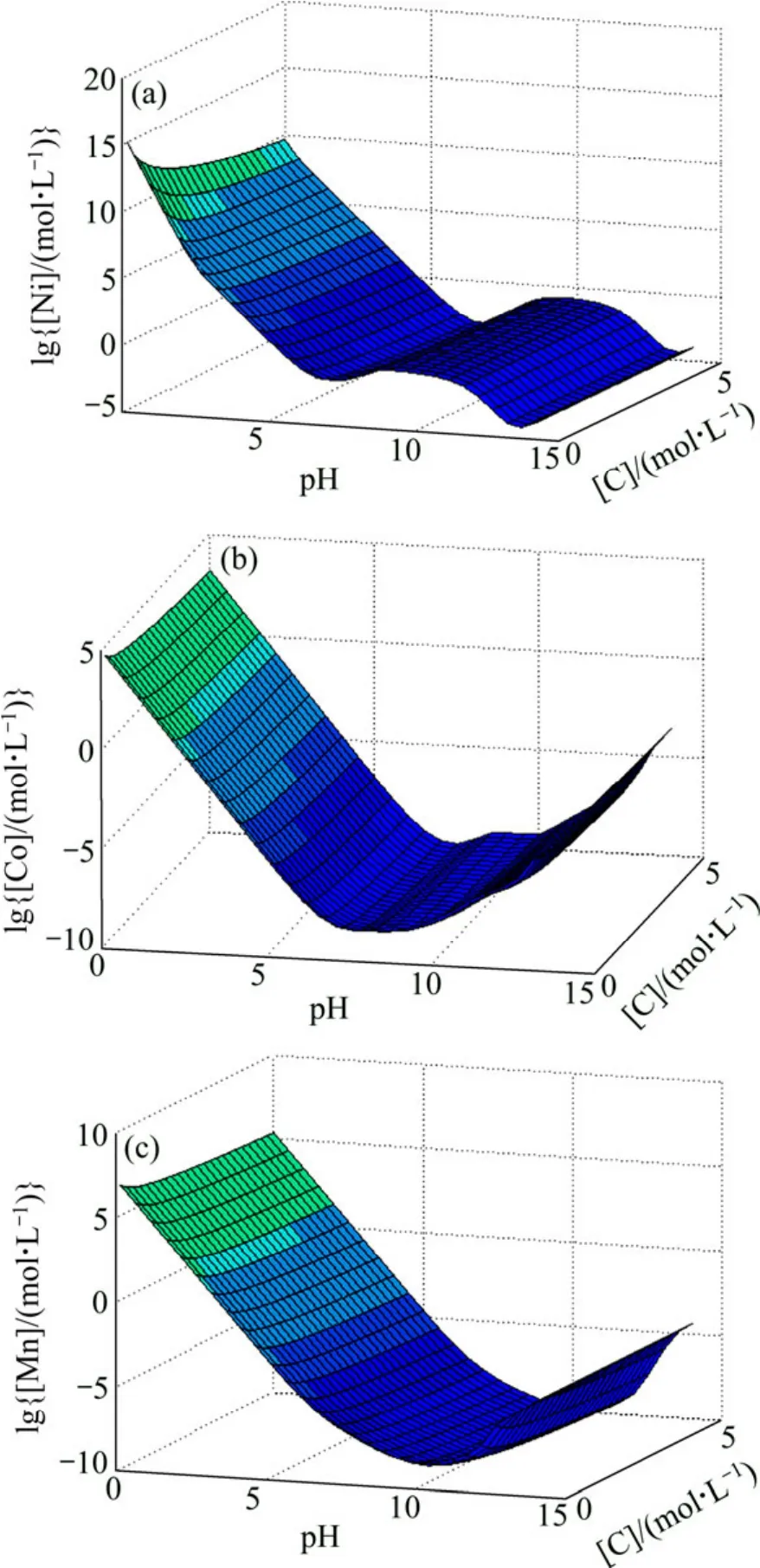
圖6 Me-OH?-NH3-CO32?體系 lg[Me]—pH—C 曲面 ([N]=1 mol/L)Fig.6 lg[Me]—pH—C surfaces in Me-OH?-NH3-CO32?system ([N]=1 mol/L)
1.5.3 lg[Me]—pH—N圖
同時考慮pH和[N]的變化對金屬離子總濃度的影響,得到[C]=1 mol/L 時 Me-OH?-NH3-CO32?體系的lg[Me]—pH—N曲面圖(見圖7)。從圖7可以看出,當pH值一定時,隨著[N]增大各金屬離子濃度有增大的趨勢,[N]≥2 mol/L時,金屬離子濃度基本不變。當[N]一定時,pH值對各金屬離子總濃度的影響較大,當pH值為8~12時,Ni與Co、Mn分離趨勢較大。值得一提的是,金屬離子被大量配合在溶液中的 pH范圍會隨[N]的變化而變化:對于Ni而言,在[N]變大的情況下,其被大量配合在溶液中的pH值范圍變寬,pH值由9~10變至8~12;Co和Mn與Ni的規律類似,但程度依次減小。
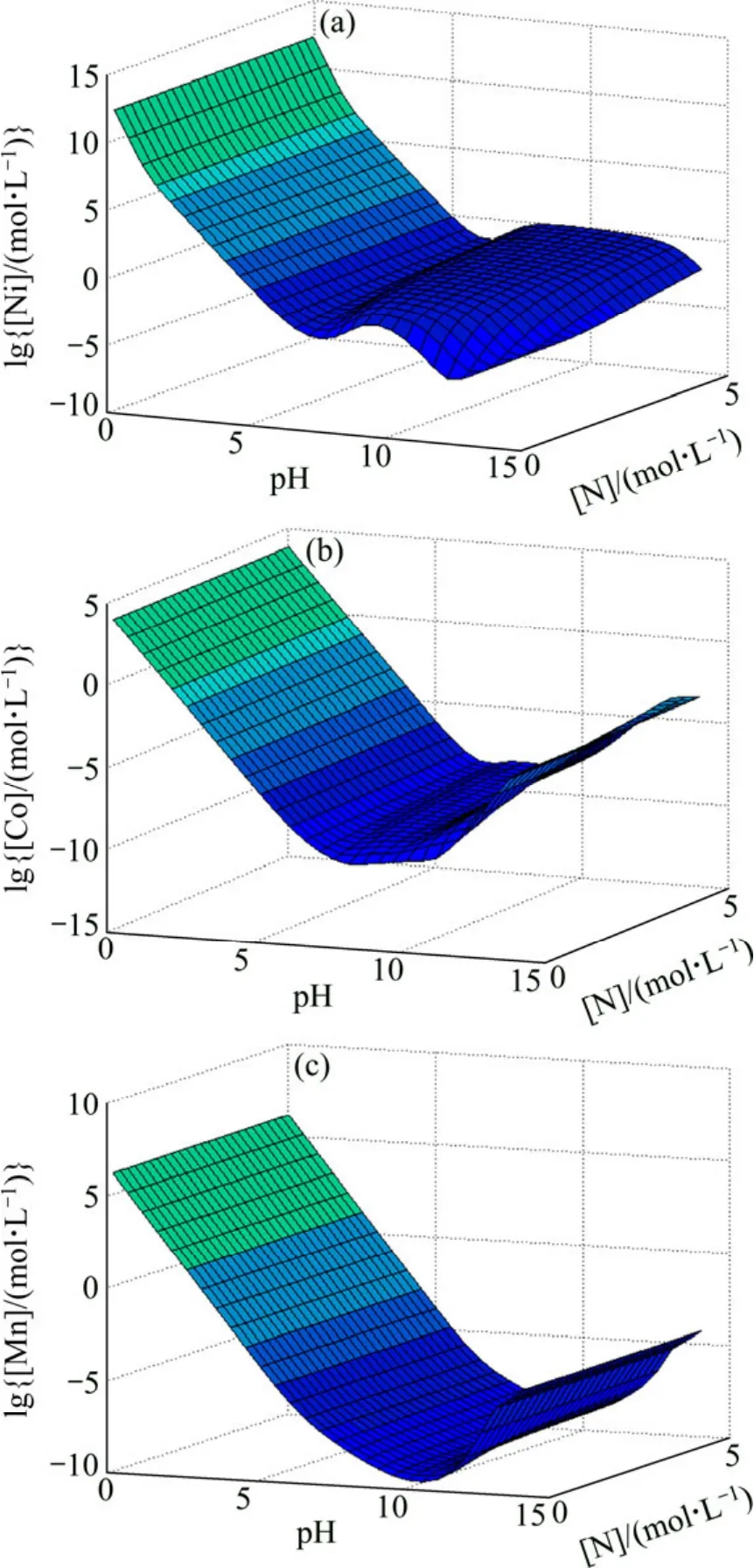
圖7 Me-OH?-NH3-CO32?體系 lg[Me]—pH—N 曲面 ([C]=1 mol/L)Fig.7 lg[Me]—pH—N surfaces in Me-OH?-NH3-CO32?system ([C]=1 mol/L)
1.5.4 α—pH 圖
Me-OH?-NH3-CO32?體系中 Ni、Co、Mn 在溶液中主要以游離金屬離子、羥配金屬離子和氨配金屬離子3種狀態存在。根據等式(32)~(46)即可分別計算 [C]=1 mol/L、[N]=1 mol/L時不同金屬離子的離子分率α—pH圖,如圖8所示。從圖8(a)可以看出,在不同pH 值時,Ni2+以不同形式存在,pH<6時,溶液中主要是游離 Ni2+;當 pH值為 8~12 時,溶液中無游離 Ni2+和羥合離子,主要是各級鎳氨離子,且幾乎全部為高級氨配離子[Ni(NH3)42+]、[Ni(NH3)52+]、[Ni(NH3)62+]。溶液中的Co2+與Ni2+具有類似的性質(圖8(b)),pH<7時,溶液中主要是游離Co2+;當pH值為9~11時,溶液中無游離 Co2+和羥合離子,主要以[Co(NH3)32+]、[Co(NH3)42+]、[Co(NH3)52+]3種鈷氨配合離子為主。對于溶液中的 Mn2+而言(圖8(c)),氨對其配合能力沒有對Ni2+和對Co2+那么強,游離Mn2+和羥合離子在整個 pH值范圍內都存在,錳氨離子集中出現在 pH為9~11的范圍內,且以低級錳氨配合離子[Mn(NH3)2+]、[Mn(NH3)22+]、[Mn(NH3)32+]為主。

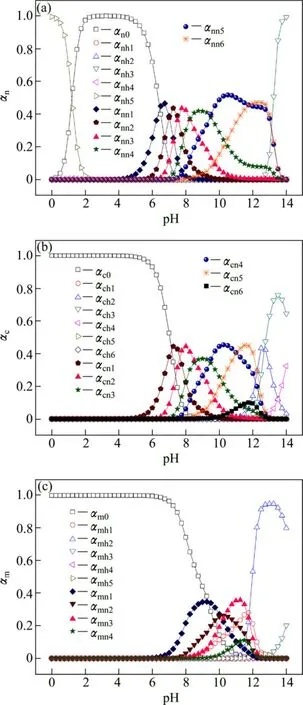
圖8 離子分率α—pH 圖Fig.8 α—pH diagrams of Ni (a), Co (b)and Mn (c)
2 Me-OH?-NH3-CO32?體系金屬離子沉淀行為
2.1 ΔG—pH圖
在 Me-OH?-NH3-CO32?體系中,進行 Ni、Co、Mn生成氫氧化物和碳酸鹽沉淀反應的熱力學計算,可以更深入地了解各金屬以何種形態實現分離,分離的趨勢和限度如何。溶液中金屬離子生成氫氧化物和碳酸鹽沉淀反應的吉布斯自由能變化如式(47)~(52)所示。根據溶度積規則[18],如果反應ΔG小于零,表明該條件下沉淀生成可行;ΔG大于或等于零,則表明沉淀不生成。
假設初始金屬離子濃度均為 0.1 mol/L,[C]=1 mol/L,[N]=2 mol/L,計算 Me-OH?-NH3-CO32?體系中Ni、Co、Mn碳酸鹽沉淀反應和氫氧化物沉淀反應的ΔG,得到圖9。
從圖9可以看出,在Me-OH?-NH3-CO32?體系中,生成NiCO3和Ni(OH)2的反應的吉布斯自由能分別在pH>9和8<pH<11時大于零,說明此條件下Ni2+被配合在溶液中不生成沉淀,且pH=10時,Ni2+最不容易沉淀。對于 Co2+而言,pH>2.5時,生成 CoCO3的反應的吉斯自由能小于零;pH>10時,生成Co(OH)2反應的吉布斯自由能小于零。說明在這兩個 pH值范圍內,Co2+容易生成沉淀。對于 Mn2+而言,pH>3.5時,生成 MnCO3沉淀;pH>8時,生成Mn(OH)2沉淀。圖9表明,pH=10時,理論上能最大程度將Ni2+保留在溶液之中,而充分沉淀Mn2+和Co2+,且沉淀形式以MnCO3和CoCO3為主。
2.2 ΔG—pH—C圖
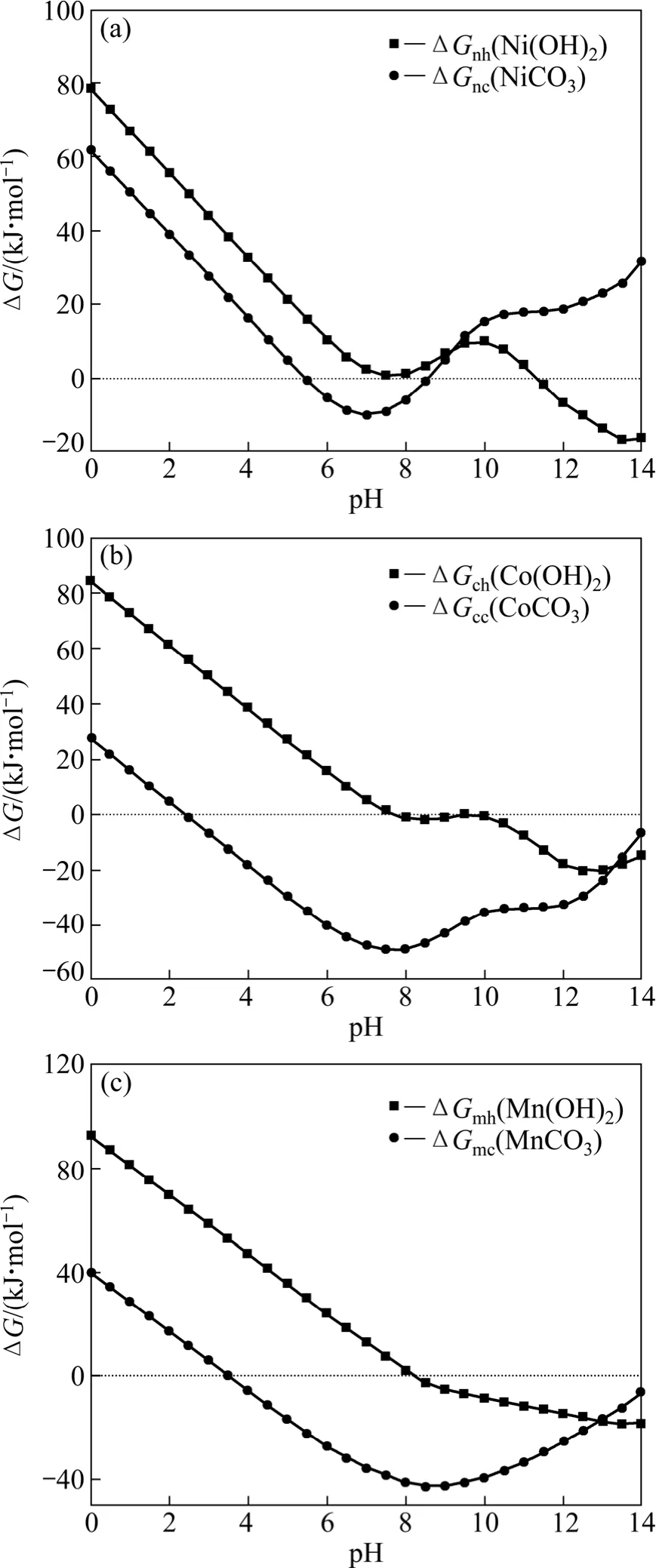
圖9 Me-OH?-NH3-CO32?體系碳酸鹽沉淀反應和氫氧化物沉淀反應的ΔG—pH曲線([C]=1 mol/L,[N]=2 mol/L)Fig.9 ΔG—pH curves of carbonates and hydroxides in Me-OH?-NH3-CO32? system ([C]=1 mol/L, [N]=2 mol/L)
類似lg[Me]—pH圖,綜合考慮沉淀劑、配合劑對溶液中的金屬碳酸鹽沉淀反應和氫氧化物沉淀反應的ΔG的影響,得到[Me]=0.1 mol/L、[N]=2 mol/L、[C]為 0~2 mol/L的三維 ΔG—pH—C圖(見圖10)。從圖10(a)可以看出,pH值對Ni沉淀反應的影響明顯:在[C]相同的條件下,隨著pH值的增加,Ni(OH)2生成反應的ΔG先增大后減小,NiCO3生成反應的ΔG不斷增大;約pH=10時,Ni(OH)2和NiCO3生成反應的ΔG達到最大正值,沉淀反應不發生。[C]對Ni沉淀反應的影響相對不明顯:在pH值相同的條件下,隨著[C]的增加,Ni(OH)2生成反應的ΔG輕微增大,NiCO3生成反應的ΔG輕微減小;當[C]≥1 mol/L時,Ni(OH)2和NiCO3生成反應的ΔG基本不變,且為正值,Ni的沉淀反應不發生。
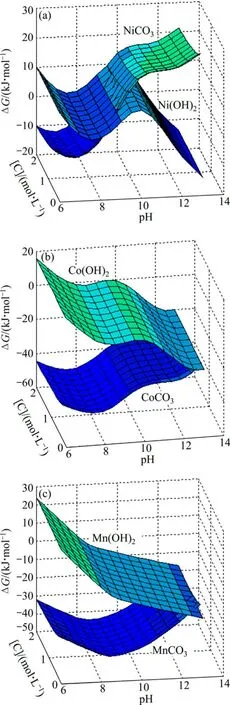
圖10 Me-OH?-NH3-CO32?體系沉淀反應的 ΔG—pH—[C]曲面([N]=2 mol/L)Fig.10 ΔG—pH—[C]surfaces of precipitation reactions in Me-OH?-NH3-CO32? system ([N]=2 mol/L)∶ (a)Ni(OH)2,NiCO3; (b)Co(OH)2, CoCO3; (c)Mn(OH)2, MnCO3
從圖10(b)可以看出,pH值對Co沉淀反應的影響明顯:相同[C]條件下,隨著pH值的增加,Co(OH)2生成反應的ΔG減小,CoCO3生成反應的ΔG增大;當pH>8時,Co(OH)2和CoCO3生成反應的ΔG均為負值,沉淀產生。[C]對Co沉淀反應的影響相對不明顯:在pH值相同的條件下,隨著[C]的增加,Co(OH)2生成反應的ΔG輕微增大,CoCO3生成反應的ΔG輕微減小;當[C]≥1 mol/L時,Co(OH)2和CoCO3生成反應的ΔG基本不變,且為負值,Co的沉淀反應發生。
從圖10(c)可以看出,pH值對Mn沉淀反應的影響明顯:在[C]相同的條件下,隨著 pH值的增加,Mn(OH)2生成反應的ΔG減小,MnCO3生成反應的ΔG增大;當pH>8時,Mn(OH)2和MnCO3生成反應的ΔG均為負值,沉淀產生。[C]對 Co沉淀反應的影響相對不明顯:在pH值相同的條件下,隨著[C]的增加,Mn(OH)2生成反應的ΔG輕微增大,MnCO3生成反應的 ΔG 輕微減小;當[C]≥1 mol/L時,Mn(OH)2和MnCO3生成反應的ΔG基本不變,且為負值,Mn的沉淀反應發生。
2.3 ΔG—pH—N圖
綜合考慮pH值和[N]對各金屬離子濃度的影響,得到[Me]=0.1 mol/L、[C]=1 mol/L、[N]為 0~6 mol/L的三維ΔG—pH—N圖(見圖11)。從圖11(a)可以看出,pH值對Ni沉淀反應的影響較大:在[N]相同的條件下,隨著pH值的增加,Ni(OH)2生成反應的ΔG先增大后減小,NiCO3生成反應的ΔG不斷增大,當pH≈10時,Ni(OH)2和NiCO3生成反應的ΔG共同達到最大正值,沉淀反應不發生。[N]對Ni沉淀反應的影響也顯著:在 pH值相同的條件下,隨著[N]的增加,Ni(OH)2和NiCO3生成反應的ΔG增大,[N]越高越有利于Ni配合在溶液中不被沉淀。
從圖11(b)可以看出,pH值對Co沉淀反應的影響較大:在[N]相同的條件下,隨著pH值的增加,Co(OH)2生成反應的ΔG整體呈減小趨勢,CoCO3生成反應的ΔG整體呈增大趨勢。[N]對 Co沉淀反應的影響也顯著:在pH值相同的條件下,隨著[N]的減小,Co(OH)2和CoCO3生成反應的ΔG均減小;當[N]≤2 mol/L時,Co(OH)2和CoCO3生成反應的ΔG均為負值,Co能夠充分沉淀。
從圖11(c)可以看出,pH值對Mn沉淀反應的影響較大:在[N]相同的條件下,隨著 pH值的增加,Mn(OH)2生成反應的ΔG減小,MnCO3生成反應的ΔG增大,pH>8時,二者ΔG均為負值,Mn能夠充分沉淀。[N]對Mn沉淀反應的影響不顯著:在pH值相同的條件下,隨著[N]的減小,Mn(OH)2和 MnCO3生成反應的ΔG均輕微減小,Mn更容易沉淀。
由以上分析可知,通過同時控制[C]、[N]和pH值,可以得到分離 Ni、Co、Mn不同狀態,其中當[C]=1 mol/L、[N]=2 mol/L、pH=10時能夠充分保留Ni在
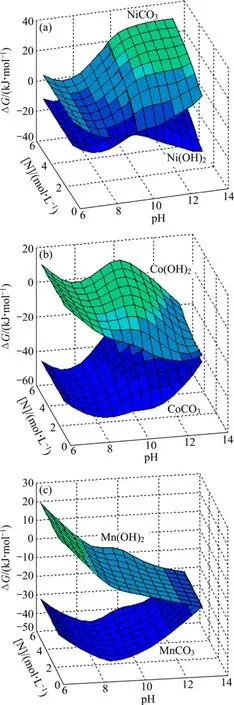
圖11 Me-OH?-NH3-CO32?體系沉淀反應的 ΔG—pH—N 曲面([C]=1 mol/L)Fig.11 ΔG—pH—N surfaces of precipitation reactions in Me-OH?-NH3-CO32? system ([C]=1 mol/L)∶ (a)Ni(OH)2,NiCO3; (b)Co(OH)2, CoCO3; (c)Mn(OH)2, MnCO3
溶液中而沉淀Co、Mn,沉淀形式以MnCO3、CoCO3為主。Co和Mn的后續分離可采用 Me-OH?-S2?體系調節pH<6以沉淀Co。依據上述配合?沉淀分離模型,可以得到的分離Co、Ni、Fe、Mn的初步工藝流程,如圖12所示。在流程中運用多個配合?沉淀體系,每個體系的分離程度和分離效果均能通過建立理論模型進行預測和調控,從而為鈷鎳二次資源綜合回收鈷鎳、制備鈷鎳產品,提供系統性地理論指導。
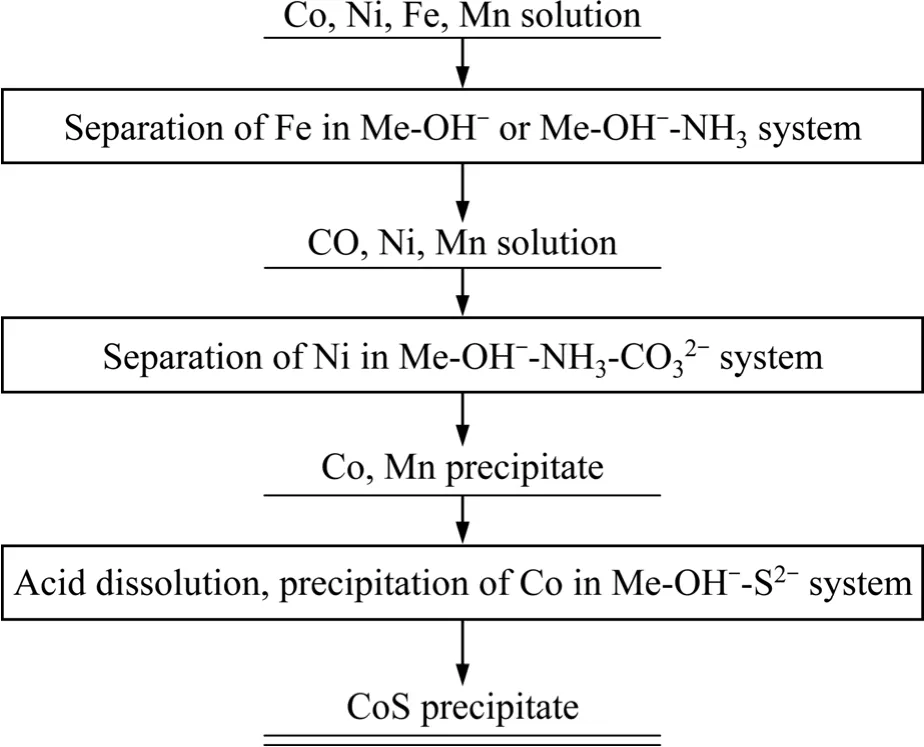
圖12 配合?沉淀體系分離金屬流程Fig.12 Metal separation flow for complexation-precipitation system
3 結論
1)以Me為Co、Ni、Fe、Mn為金屬元素,OH?、NH3為配合劑,OH?、S2?、CO32?為沉淀劑,建立Me-OH?、Me-OH?-CO32?、Me-OH?-S2?、Me-OH?-NH3、Me-OH?-NH3-CO32?等多個配合?沉淀體系的熱力學平衡模型,繪制 lg[Me]—pH 曲線,發現 Fe3+可以在Me-OH?、Me-OH?-NH3體系中通過調節pH=3預先沉淀分離,Ni2+可Me-OH?-NH3-CO32?體系中與 Co、Mn分離,Mn2+可在Me-OH?-S2?體系中通過調節pH<6從溶液中與Co分離。
2)Co、Ni、Mn 在 Me-OH?-NH3-CO32?體系中的沉淀行為受 pH值、配合劑、沉淀劑濃度共同影響,在pH值為9~10時,Ni在溶液中濃度最大,存在形式幾乎全部為高級氨配離子[Ni(NH3)42+]、[Ni(NH3)52+]、[Ni(NH3)62+];Co、Mn濃度最小,主要以[Co(NH3)32+]、[Co(NH3)42+]、 [Co(NH3)52+]、 [Mn(NH3)2+]、[Mn(NH3)22+]、[Mn(NH3)32+]幾種氨配合離子形式存在。
3)經過熱力學計算繪制 Co、Ni、Mn在Me-OH?-NH3-CO32?體系中的沉淀反應吉布斯自由能變ΔG單因素二維曲線及雙因素三維曲面發現,當pH值為8~12及[CO32?]增大有利于Co、Mn沉淀,[NH3]增大不利于生成 Co、Ni、Mn沉淀,通過控制[C]=1 mol/L、[N]=2 mol/L、pH=10能夠充分沉淀Co、Mn而將大部分Ni保留在溶液中,沉淀形式主要為MnCO3和 CoCO3。
[1]WANG R C, LIN Y C, WU S H.A novel recovery process of metal values from the cathode active materials of the lithium-ion secondary batteries[J].Hydrometallurgy, 2009, 99(3/4)∶194?201.
[2]FERREIRA D A, PRADOS L M Z, MAJUSTE D.Hydrometallurgical separation of aluminium, cobalt, copper and lithium from spent Li-ion batteries[J].Journal of Power Sources,2009, 187(1)∶ 238?246.
[3]VALVERDE I M J, PAULINO J F, AFONSO J C.Hydrometallurgical route to recover molybdenum, nickel, cobalt and aluminum from spent hydrotreating catalysts in sulphuric acid medium[J].Journal of Hazardous Materials, 2008, 160(2/3)∶310?317.
[4]FREITAS M B J G, CELANTE V G, PIETRE M K.Electrochemical recovery of cobalt and copper from spent Li-ion batteries as multilayer deposits[J].Journal of Power Sources 2010, 195(10)∶ 3309?3315.
[5]王永利, 趙麗霞.從含鈷廢料中提取鈷的研究進展[J].再生資源研究, 2005(2)∶ 29?31.WANG Yong-li, ZHAO Li-xia.The research progress of drawing the cobalt[J].Recycling Research, 2005(2)∶ 29?31.
[6]LI L, GE J, CHEN R J, WUA F, CHEN S, ZHANG X X.Environmental friendly leaching reagent for cobalt and lithium recovery from spent lithium-ion batteries[J].Waste Management,2010, 30(12)∶ 2615?2621.
[7]鐘燕萍, 王大輝, 康 龍.從廢棄鎳基電池中回收有價金屬的研究進展[J].新技術新工藝, 2009(8)∶81?85.ZHONG Yan-ping, WANG Da-hui, KANG Long.Research development of valuable metals recycling from used nickel-based batteries[J].New Technology and New Process,2009(8)∶ 81?85.
[8]陳 亮, 唐新村, 張 陽, 瞿 毅, 王志敏.從廢舊鋰離子電池中分離回收鈷鎳錳[J].中國有色金屬學報, 2011, 21(5)∶1192?1198.CHEN Liang, TANG Xin-cun, ZHANG Yang, QU Yi, WANG Zhi-min.Separation and recovery of Ni, Co and Mn from spent lithium-ion batteries[J].The Chinese Journal of Nonferrous Metals, 2011, 21(5)∶ 1192?1198.
[9]王成彥, 王含淵, 江培海, 尹 飛, 陳永強.高錳含鈷物料中鈷的回收[J].有色金屬∶ 冶煉部分, 2005(5)∶ 2?5.WANG Cheng-yan, WANG Han-yuan, JIANG Pei-hai, YIN Fei,CHEN Yong-qiang.Recovery of cobalt from cobalt ores with high manganese[J].Nonferrous Metals∶ Extractive Metallurgy,2005(5)∶ 2?5.
[10]KANG J, SOHN J, CHANG H, SENANAYAKE G, SHIN S M.Preparation of cobalt oxide from concentrated cathode material of spent lithium ion batteries by hydrometallurgical method[J].Advanced Powder Technology 2010, 21(2)∶ 175?179.
[11]SNAYL A A.Extraction and separation of Co(Ⅱ)and Ni(Ⅱ)from acidic sulfate solutions using Aliquat 336[J].Journal of Hazardous Materials 2010, 173(1/3)∶ 223?230.
[12]LI L, XU S, JU Z, WU F.Recovery of Ni, Co and rare earths from spent Ni-metal hydride batteries and preparation of spherical Ni(OH)2[J].Hydrometallurgy 2009, 100(1/2)∶ 41?46.
[13] 柴立元, 常 皓, 王云燕, 舒余德, 李 敬, 袁 林, 王 璞,方 艷, 趙 堃.Cd2+-H2O系羥合配離子配位平衡[J].中國有色金屬學報 2007, 17(3)∶ 487?491.CHAI Li-yuan, CHANG Hao, WANG Yun-yan, SHU Yu-de, LI Jing, YUAN Lin, WANG Pu, FANG Yan, ZHAO Kun.Equilibrium of hydroxyl complex ions in Cd2+-H2O system[J].The Chinese Journal of Nonferrous Metals, 2007, 17(3)∶487?491.
[14]TANG M T, YANG J G, YANG S H.Thermodynamic calculation of Sn(IV)-NH4+-Cl?-H2O system[J].Transactions of Nonferrous Metals Society of China, 2004, 14(4)∶ 802?806.
[15]蔡進紅, 代建清, 周小兵.共沉淀法合成Zn 摻雜Co2-Y 平面六角鐵氧體粉的熱力學分析[J].無機化學學報, 2008, 24(12)∶1943?1948.CAI Jin-hong, DAI Jian-qing, ZHOU Xiao-bing.Thermodynamic analysis on preparation of zinc doped Co2-Y planar hexagonal ferrite powder by chemical Co-precipitation method[J].Chinese Journal of Inorganic Chemistry, 2008, 24(12)∶1943?1948.
[16]蘇繼桃, 蘇玉長, 賴智廣, 禹 萍, 何顯達.共沉淀法制備鎳、鈷、錳復合碳酸鹽的熱力學分析[J].硅酸鹽學報, 2006,34(6)∶ 695?698.SU Ji-tao, SU Yu-chang, LAI Zhi-guang, YU Ping, HE Xian-da.Thermodynamic analysis of preparation of multiple carbonate of Ni, Co and Mn by coprecipitation method [J].Journal of the Chinese Ceramic Society, 2006, 34(6)∶ 695?698.
[17]約翰·安迪.蘭氏化學手冊[M].2版.魏俊發, 楊祖培, 高子偉,楊義芳, 胡道道, 譯.北京∶ 科學出版社, 2003.DEAN J A.Lange’s handbook of chemistry[M].2nd ed.WEI Jun-fa, YANG Zu-pei, GAO Zi-wei, YANG Yi-fang, HU Dao-dao, transl.Beijing∶ Science Press, 2003.
[18]張平民.工科大學化學(上冊)[M].長沙∶ 湖南教育出版社,2002∶ 337?338.ZHANG Ping-min.Advanced chemistry for engineering(Volume 1)[M].Changsha∶ Hunan Educational Press, 2002∶337?338.

