尤瑞克林對局灶性腦缺血大鼠神經細胞凋亡的影響
張學艷 張幽燕 常紅云
腦血管病是一種常見病和多發病,其發病率、致殘率、病死率均較高。腦缺血急性期及時恢復腦血流灌注,改善缺血區血供,一直是治療缺血性腦卒中的重點。尤瑞克林主要成分為人尿激肽原酶,能分解產生血管緩激肽和血管舒張素,實驗研究表明:應用尤瑞克林能夠減少腦梗死面積[1],減輕神經功能受損,其機制可能與促進血管新生和神經細胞增殖、遷移、分化、減少細胞凋亡等有關[2]。藥效學研究顯示,尤瑞克林可選擇性擴張缺血部位細小動脈,改善梗死灶內供血[3],并促進損傷部位新生血管生成[4],從而對急性腦梗死起到治療作用。腦缺血的發病機制復雜,其中細胞凋亡仍然是腦缺血損傷機制研究的重要內容。凋亡是指機體在生理條件下受到刺激后,經過多種信號轉導引起細胞程序性死亡的過程。關于尤瑞克林從細胞凋亡角度對腦保護作用機制國內筆者很少見報道。本研究從細胞凋亡角度探討尤瑞克林的保護作用,為臨床應用尤瑞克林提供依據。
1 材料與方法
1.1 實驗動物與分組 選用成年健康SD大鼠60只,雌雄各30只,體重250~300 g。實驗動物級別:普通級。隨機分為假手術組、單純缺血組、尤瑞克林組(低劑量組、中劑量組、高劑量組),每組12只。參照文獻[5]給藥:尤瑞克林組用滅菌0.9%氯化鈉溶液分別稀釋為3.75 ×10-3、8.75 ×10-3、17.25 ×10-3PNA單位/kg,給藥量1 ml/kg,分別于缺血后30 min及23.5 h 2次經舌下靜脈給藥。余2組予同等劑量0.9%氯化鈉溶液。
1.2 試劑與儀器 注射用尤瑞克林(廣東天普生化醫藥股份有限公司提供)。bcl-2、bax蛋白測定試劑盒:武漢博士德生物工程公司。連續變倍體視顯微鏡160×:桂林儀器廠;CIAS-1000型圖像分析儀:北京大恒圖象視覺有限公司;LKBⅢ型超薄切片機:瑞典;電子天秤:上海天平儀器廠;石英自動雙重純水蒸餾器:江蘇丹陽門石英玻璃廠;烘片、烤片機:孝感市電子儀器廠。
1.3 局灶性腦缺血模型制備 參照Longa等采用線栓法[6]制備MCAO,大鼠手術前12 h禁食不禁水,健康SD大鼠稱重后,按10%水合氯醛0.3 ml/100 g腹腔注射麻醉。固定,常規消毒,取頸正中切開,剪開淺筋膜,暴露胸鎖乳突肌、右側頸總動脈、迷走神經、頸外動脈、頸內動脈、翼腭動脈,在近心端結扎頸總動脈,在頸總動脈分叉處結扎頸外動脈及翼腭動脈。距頸總動脈分叉處近心端0.5 cm處剪一小口,插入頭端燒成圓鈍形直徑為0.235 mm的尼龍魚線,進線長度18~19 mm在大腦中動脈起始端堵塞右側大腦中動脈,然后將頸總動脈連同尼龍魚線一起結扎,縫合皮膚,放回籠內單籠喂養。假手術組只分離、暴露血管,不結扎頸總動脈及頸外動脈,不插入尼龍魚線。術后保持環境溫度25~30℃。尤其要注意動物頭部的保溫。
1.4 觀察指標
1.4.1 神經行為學評分[6]:參考經典的 Longa 等[7]的方法對大鼠在MCAO術后清醒后到24 h進行3次神經功能評分,取平均值。0:無明顯神經功能喪失;1:不能完全伸展左側前爪;2:向左側旋轉,環形運動;3:行走時向左側傾倒;4:不能自行行走,意識水平下降。
1.4.2 免疫組織化學方法檢測缺血側大腦皮層 bcl-2、bax的表達:5組大鼠行MCAO,24 h后行腦灌注固定后取腦,取雙側大腦冠狀位距嗅球尖端6~11 mm腦組織塊,放入多聚甲醛液固定24 h,常規梯度脫水、透明、石蠟包埋。從冠狀面中1/3層面開始留取切片,厚度5 μm,連續切片,備用。將其進行免疫組化SABC法染色,操作嚴格參照武漢博士德公司說明書。判斷標準及方法:對于大鼠MCAO模型,Shi等[8]研究指出,缺血側大腦半球距離嗅球尖端7~11 mm、矢狀裂至外側裂上1/3的皮質組織由大腦前動脈和中動脈雙重供血,缺血較輕,表現為半暗區的變化。每只大鼠各取3張腦組織切片,在顯微鏡下定位,取缺血側(假手術組取假手術側)大腦皮層頂葉第三層外錐體細胞層,隨機采集5個高倍視野(10×40),參照Quaini等[9]采用雙盲法計算每個高倍鏡視野bcl-2及bax陽性細胞率(陽性細胞數/陽性細胞數+陰性細胞數)×100%。細胞胞質含有棕黃色顆粒的細胞為陽性細胞。
1.5統計學分析應用SPSS 16.0統計軟件,計量資料以±s表示,多組間比較采用單因素方差分析檢驗,各指標組間比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 神經功能缺損評分比較 術后大鼠多于1 h內清醒,假手術組動物均活動正常,無神經功能缺損,神經功能缺損評分為0分,單純缺血組動物神經功能缺損評分最為嚴重;與單純缺血組相比,尤瑞克林組各組均能改善局灶性腦缺血大鼠的神經行為學評分(P<0.05或<0.01)且隨劑量升高呈量效關系。其中單純缺血組及尤瑞克林中劑量組各1只大鼠死亡,剔除。見表1。
表1神經功能缺損評分比較±s

表1神經功能缺損評分比較±s
注:與單純缺血組比較,*P <0.05,#P <0.01
?
2.2 缺血側大鼠大腦皮層bcl-2、bax陽性細胞表達個數結果
尤瑞克林各劑量組bcl-2、bax陽性細胞表達率均明高于單純缺血組(P <0.05或 <0.01),且呈劑量依賴性關系。見表2,圖 1、2。

表2 5組對大腦皮層bcl-2、bax陽性細胞表達影響

圖1 大腦皮層bcl-2表達(免疫組化×400)
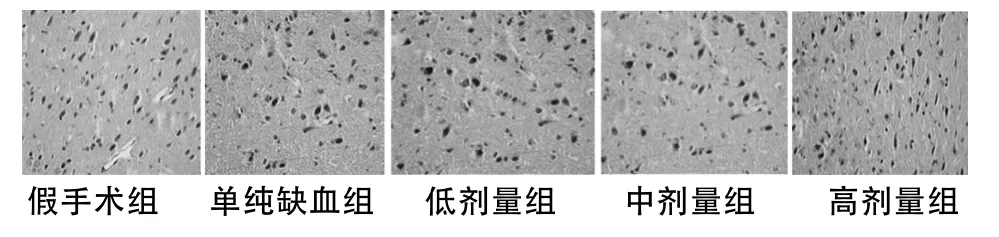
圖2 大腦皮層bax表達(免疫組化×400)
3 討論
腦缺血后,由于腦缺血缺氧致氧自由基大量生成、神經細胞凋亡、氧化應激損傷等,使腦組織損傷進行性加重。缺血性腦血管病的高致殘率及病死率與腦缺血后大量神經細胞凋亡密切相關。細胞凋亡發生機制復雜,涉及信號轉導、基因調控和凋亡效應的執行等。各種凋亡相關蛋白在調控凋亡發生的過程中起關鍵作用。有研究發現大鼠MCAO后,腦缺血半暗區的凋亡細胞在缺血1 h即可出現,隨缺血時間的延長逐漸增多,凋亡的特征性改變主要發生于缺血后12~24 h,48 h以后凋亡細胞明顯減少,72 h以后凋亡表現逐漸消失,半暗區內的神經元已基本全部死亡[10]。研究表明,bax為促進細胞凋亡;bcl-2增高抑制細胞凋亡,且bcl-2基因家族是決定細胞是否發生凋亡以及凋亡嚴重性的重要因素[11]。因此,各種藥物可以通過促進bc1-2蛋白表達,減少bax蛋白表達,來抑制細胞發生凋亡,對腦損傷起保護作用。
注射用尤瑞克林是從男性尿液中提取精制的組織型激肽原酶,能催化激肽原水解產生激肽。研究證實,組織激肽原酶能促進一氧化碳生成,改善腦組織供血,能選擇性擴張腦細小動脈,改善缺血腦組織血供和氧供,減輕氧化應激損傷,促進新生血管發生,減少細胞凋亡,從而對急性腦梗死起到治療作用[12,13]。且注射用尤瑞克林及其相關代謝產物對缺血部位的靶向性作用強,可成為缺血性腦血管病的最重要的治療藥物之一。
本研究結果顯示:腦缺血后24 h大鼠缺血性病理損傷及神經功能缺損癥狀嚴重,低、中、高劑量尤瑞克林能使神經功能缺損癥狀減輕,說明尤瑞克林對腦缺血有保護作用。尤瑞克林可促進抑凋亡基因bcl-2蛋白的表達,并下調促凋亡基因bax蛋白的表達,從而減少腦缺血后的神經細胞凋亡,且隨劑量增加治療效果越明顯,呈劑量依賴性。說明尤瑞克林對大鼠腦缺血損傷有很強的保護作用。其保護機制可能抑制腦缺血損傷中神經細胞凋亡,減輕遲發性神經元壞死,保存神經細胞功能,從而達到治療目的。
本研究還發現單純缺血組缺血側腦組織較假手術組bcl-2陽性細胞表達增多,腦缺血后bcl-2的這種變化可能是神經細胞自我保護機制之一,可防止或減少缺血時腦組織細胞凋亡的發生。
1 Emanueli C,Madeddu P.Angiogenesis therapy with human tissue kallikrein for the treatment of ischemic diseases.Arch Mal Coeur Vaiss,2004,97:679-687.
2 Chao J,Chao L.Kallikrein-kinin in stroke cardiovascular and renal disease.Exp Physiol,2005,90:291-298.
3 Xia CF,Yin H,Borlongan CV.Kallikrein gene transfer protects against ischemic stroke by promoting glial cell migration and inhibiting apoptosis.Hypertension,2004,43:452-459.
4 李昌盛,閔拮,湛彥強,等.利用激光散斑成像技術觀察尤瑞克林對腦梗死大鼠腦血流的影響.中華神經科雜志,2010,43:732-736.
5 屈志煒,蘇丹,張麗英,等.凱力康對大鼠局灶性腦缺血的實驗研究.中國處方藥,2005,44:73-75.
6 xu X,Ye L,Ruan Q.Environmental enrichment induces synaptic structural modification after transient focal cerebral ischemia inrats.Exp Biol Med(Maywood),2009,234:296-305.
7 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats.Stroke,1989,20:84-91.
8 Shi J,Panickar KS,Yang SH,et al.Estrogen attenuates over-expression of beta-amyloid precursor protein messager RNA in an animal model of focal ischemia.Brain Res,1998,810:87-92.
9 Quaini F,Cigola E,Lagrasta C,et al.End-stage cardiac failure in humans is coupled with the induction of proliferating cell nuclear antigen and nuclear mitotic division iventricular myocytes.Circ Res,1994,75:1051-1063.
10 陳元新,林祥通,沈冰.大鼠永久性腦缺血及缺血再灌注后半暗帶caspase-3mRNA表達變化.復旦學報(醫學科學版),2001,28:490-493.
11 De Bilbao F,Guarin E,Nef P,et al.Cell death is prevented in thalamic fields but not in injured neocortical areas after permanent focal ischaemia in mice overexpressing the anti-apoptotic protein Bcl-2.Etr J Neurosci,2000,12:921-934.
12 謝惠芳,徐如祥,魏繼鵬,等.大鼠腦缺血再灌注損傷后磷酸化JAK2、STAT3蛋白表達及細胞凋亡.南方醫科大學學報,2007,27:208-211.
13 Chao J,Bledsoe G,Yin H,et al.The tissue kallikrein-kinin system protects against cardiovascular and renal diseases and ischemic stroke independently of blood pressure reduction.Biol Chem,2006,387:665-675.

