黃酒對同型半胱氨酸誘導的大鼠血管內皮細胞基質金屬蛋白酶2表達的影響*
季 政, 郭航遠△, 池菊芳, 翟小亞, 劉龍斌,3, 孫 荷, 彭 放
血管內皮細胞(vascular endothelial cells,VECs)和血管平滑肌細胞(vascular smooth muscle cells,VSMCs)均為參與動脈粥樣硬化(atherosclerosis,AS)發生發展的重要細胞。絕大多數心血管危險因素會引起內皮功能障礙,且是最早可在AS演變中探測到的血管病變,與未來的心血管事件也密切相關[1]。內皮功能障礙首先主要表現為一氧化氮(nitric oxide,NO)合成下降,而NO能抑制血小板黏附、聚集及白細胞遷移入血管壁,抑制平滑肌細胞增殖等AS發生發展中的關鍵事件[1]。Chen 等[2]發現在血管內皮細胞中,NO通過活化轉錄激活因子3(activating transcription factor 3,ATF-3)干擾p53結合到啟動子區域,從而抑制基質金屬蛋白酶2(matrix metalloproteinase-2,MMP-2)的轉錄。
同型半胱氨酸(homocysteine,Hcy)是目前公認與冠狀動脈,腦動脈中AS相關的一個重要的獨立危險因素[3-4]。血漿Hcy升高涉及遺傳、藥物、營養等多方面,而維生素B12(vitamin B12,VitB12)與葉酸是Hcy代謝過程中必需的輔酶,缺乏將導致血漿總Hcy水平上升,分為輕度(15~30 μmol/L)、中度(30~100 μmol/L)和重度(> 100 μmol/L)。研究表明補充VitB6、VitB12和葉酸可降低其水平。
流行病學的研究顯示過量飲酒有損健康,但經常少量、適度飲酒與心血管風險卻始終呈負相關[5]。目前國內對黃酒的研究表明其具有抗氧化、降低血膽固醇水平和免疫調節等功效[6],但有關黃酒對心血管系統的保護效應及潛在機制的研究仍十分有限。我們前期的體外實驗表明黃酒能抑制Hcy誘導的大鼠VSMCs MMP-2的表達和活性[7],體內研究表明黃酒和紅葡萄酒能抑制低密度脂蛋白受體敲除(LDLR-/-)小鼠MMP-2表達和動脈粥樣硬化斑塊的形成[8]。鑒于VECs在AS發生發展中的重要作用,本實驗主要研究對Hcy誘導的大鼠VECs MMP-2的表達和活性的影響及少量黃酒對其的抑制作用,并探討黃酒可能的抗AS機制。
材料和方法
1 動物和試劑
SD大鼠(18 d)購自浙江省實驗動物中心。酒精度12%的黃酒、酒精購自紹興黃酒集團,酒精度12%的紅葡萄酒購自法國Languedoc-Roussillon;M199培養基、胎牛血清和0.25%胰蛋白酶-EDTA購自Gibco;Ⅰ型膠原酶、明膠和D-L-Hcy購自Sigma;血管內皮細胞生長因子(vascular endothelial growth factor,VEGF)購自 PeproTech;內皮細胞培養基(endothelial cell medium,ECM)及生長補充因子(endothelial cell growth supplement,ECGS)購自 ScienCell;兔抗大鼠Ⅷ因子Ⅰ抗、Ⅱ抗購自上海基因科技公司;MTT購自Amresco;鼠尾膠原蛋白I型購自杭州生友生物;鼠抗MMP-2單克隆抗體購自Abcam;HRP兔/鼠通用型Ⅱ抗購自DAKO;其它免疫印跡相關試劑購自江蘇碧云天;YM30蛋白濃縮膜購自Millipore;其它化學試劑均為進口或國產分析純。
2 大鼠VECs的培養、分組和干預
參考Kobayashi等[9]并作相應改良,取18 d左右SD大鼠2只,乙醚麻醉后乙醇浸泡2 min消毒,迅速在超凈工作臺中分離得到光滑完整的大鼠胸腹主動脈,顯微剪剪開主動脈內膜向下貼附在裝有少量0.1%Ⅰ型膠原酶溶液的玻璃皿上,37℃靜置消化30 min,1 000 r/min 離心 5 min 收集 VECs,0.2% 鼠尾膠原包被的6孔板中培養,3~4 d后,更換ECM,繼續培養5~6 d可見90% 以上細胞匯合成單層。玻璃探針鏡下刮除少量成纖維樣細胞進行分離純化,D-Hanks液洗滌后,胰酶消化傳代。對原代及第2代細胞進行免疫細胞化學鑒定。取第2代細胞接種于50 mL底面鋪鼠尾膠原的培養瓶中,加ECM完全培養基培養48 h,待細胞融合80%左右,換無血清ECM繼續培養12 h,使細胞增長同步后接種在含10%FBS ECM的6孔板中,細胞計數,每孔加VECs 2×105個,臺盼藍染色鏡下測得細胞存活率約98%。(1)Hcy對VECs MMP-2蛋白表達和上清液酶活性的影響:按 Hcy 濃度梯度分為 0 μmol/L、50 μmol/L、100 μmol/L、500 μmol/L、1 000 μmol/L 5 組,與VECs培養48 h,結合人體實際病理生理情況及實驗敏感性選取Hcy最適刺激濃度;(2)取最適濃度Hcy(100 μmol/L)與 VECs 培養 24 h、48 h、72 h,選取Hcy最適刺激時間;(3)黃酒和紅酒抑制Hcy誘導的MMP-2表達及活化:實驗分為 control組、Hcy組(Hcy 100 μmol/L)、Hcy+ 黃酒組(Hcy 100 μmol/L,酒精度1.4%)、Hcy+紅酒組(Hcy 100 μmol/L,酒精度 1.4%)和 Hcy+ 酒精組(Hcy 100 μmol/L,酒精度1.4%),與VECs培養48 h后,收集上清液,裂解蛋白,用于后續實驗。
3 MTT檢測酒類干預適宜濃度
消化對數期的VECs,以3×107/L接種在96孔板含10%FBS的ECM中培養,邊緣用無菌PBS填充,24 h后干預。根據預實驗結果,酒類干預濃度介于 1% ~2% 之間,實驗分為 control、Hcy、Hcy+1.0%、Hcy+1.2%、Hcy+1.4%、Hcy+1.6%、Hcy+1.8%和 Hcy+2.0%8 組,加入的 Hcy均為 100 μmol/L。每天換液,48 h后每孔加5 g/L的MTT溶液20 μL,繼續培養4 h,終止培養后吸掉培養液。每孔加入DMSO 150 μL,搖床振蕩10 min,使結晶充分溶解,490 nm處測量各孔的吸光度(A)。每組設5個復孔,2個零孔(無細胞,其余同干預組)。
4 Western blotting檢測
按照如下處理:(1)加入 0 μmol/L、50 μmol/L、100 μmol/L、500 μmol/L、1 000 μmol/L Hcy 與 VECs培養48 h;(2)加入Hcy(100 μmol/L)與 VECs培養24 h、48 h、72 h;(3)實驗分 control組、Hcy 組(Hcy 100 μmol/L)、黃酒組 (Hcy 100 μmol/L,酒精度1.4%)、紅酒組(Hcy 100 μmol/L,酒精度 1.4%)和酒精組(Hcy 100 μmol/L,酒精度 1.4%),與 VECs培養48 h后,細胞蛋白裂解上清液以BCA法進行蛋白定量后,每道40 μg蛋白上樣于(與5×上樣緩沖液充分混勻后煮沸5 min,4℃ 12 000 r/min離心5 min)SDS-PAGE中恒壓電泳,積層膠60 V,分離膠100 V。電泳結束后切下分離膠,濕轉法100 V約1.5 h轉移至PVDF膜上。電轉結束后,取下膜后先用TBS洗滌3次,每次5 min。然后置于5%脫脂奶粉封閉液中37℃封閉1 h。將膜與封閉液稀釋的Ⅰ抗4℃孵育過夜,TBST平搖洗膜3次,每次15 min,然后與相應的Ⅱ抗37℃孵育1 h。TBST洗膜3次,去除未結合的Ⅱ抗。ECL-Plus化學發光處理,于暗室中30 min內壓片曝光,顯影及定影后 Bio-Rad Quantity One 4.4軟件定量掃描分析。
5 明膠酶譜法檢測MMP-2在VECs上清液中的活性
分組及干預時間同上,收集細胞培養上清,低速離心(200×g)去除細胞碎片,上清用Millipore公司YM30蛋白濃縮膜處理后(1 500×g,4℃離心4 min),與1/2體積的樣品緩沖液混合均勻后將25 μg樣品上樣于含0.1%明膠的SDS-PAGE電泳。60 V穩壓跑濃縮膠,90 V跑分離膠,當溴酚藍遷移到分離膠下游邊緣2 cm時停止電泳。將凝膠取出,用蒸餾水漂洗數次后,移入2.5%Triton X-100溶液中(20 mmol Tris-HCl,pH 8.0;150 mmol NaCl;5 mmol CaCl2;2.5%Triton X-100)搖床上50 r/min平搖 30 min×2次洗脫SDS。蒸餾水漂洗后,加入明膠酶緩沖液,在37℃恒溫搖床中溫育42 h。用考馬斯亮藍R250染色4 h,在脫色液中脫色1~2 h,至對照出現明顯、清晰的負染酶帶后用蒸餾水漂洗、拍照,并用Quantity One 4.4軟件定量分析。
6 統計學處理
采用SPSS 18.0統計軟件處理數據,計量資料用均數±標準差(mean±SD)表示,多組均數比較采用單因素方差分析(One-way ANOVA)和LSD法。以P<0.05為差異有統計學意義。
結 果
1 大鼠VECs培養及鑒定
大鼠胸腹主動脈VECs分離純化后培養,原代細胞8~10 d長滿匯合后,形態學鑒定呈現典型的“鵝卵石”或“鋪路石”征。細胞免疫化學鑒定原代和純化后的第2代細胞特異性Ⅷ因子相關抗原,可見胞質中呈棕黃色陽性表達,經純化后的第2代細胞未見明顯陰性表達細胞。400倍鏡下可見棕色Ⅷ因子相關抗原顆粒,見圖1。
2 MTT確定酒類干預的適宜濃度
實驗表明100 μmol/L Hcy對VECs活性無顯著影響,隨著干預組酒精濃度的上升VECs活性(A值)下降;3組酒類間同一干預時A值無顯著差別,與Hcy組相比,干預濃度1.8%時黃酒和紅酒組,VECs活性顯著下降(均P<0.01);干預濃度為1.6%時酒精組VECs活性顯著下降(P<0.01)。根據上述結果統一采用1.4%酒精濃度進行干預,見表1。
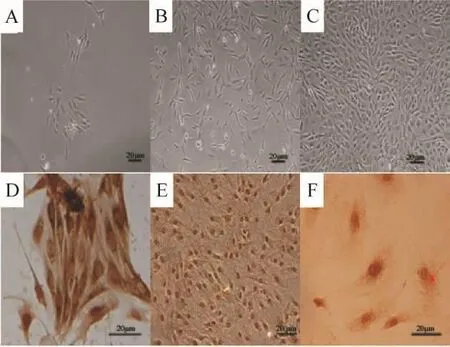
Figure 1.The primary culture and immunocytochemical staining of rat aortic vascular endothelial cells.A:a small amount of cells were observable 3 days later(×100).B:the cells were rapidly growing after replacing endothelial cell medium 6 days later(×100).C:the cells grew with the characteristic“cobblestone morphology”when reaching 90%confluence 9 days later(×100).D,E and F:the cells were immunostained with antibody of factorⅧ,the marker of endothelial cells.D:primary cells;E,F:passage 2 cells.E:×200;D,F:×400.The red arrow showed brown granules in the cytoplasm,indicating positive staining.圖1 大鼠VECs原代培養及免疫細胞化學染色
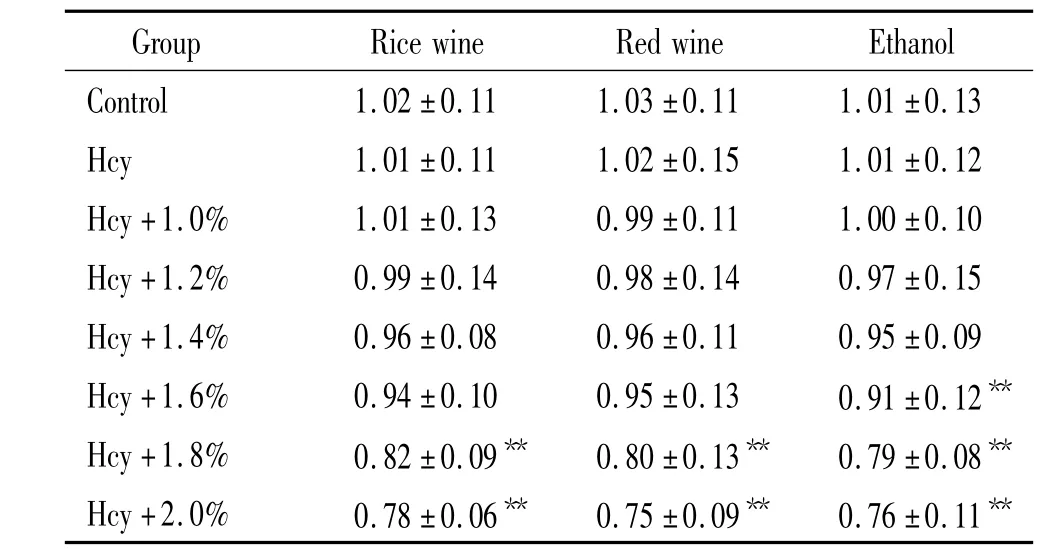
表1 黃酒、紅葡萄酒及酒精對大鼠VECs活性的影響Table 1.Effects of Chinese rice wine,red wine and ethanol on the viability of rat aortic VECs(mean±SD.n=5)
3 免疫印跡法檢測MMP-2在VECs中的表達
Hcy能夠促進VECs MMP-2蛋白的表達,呈現濃度與時間的依賴性。(1)50~500 μmol/L Hcy促進MMP-2蛋白表達上調,組間差異有統計學意義(P<0.05 或 P <0.01),見圖 2。(2)Hcy(100 μmol/L)干預24、48、72 h均能促進MMP-2蛋白表達,以48 h最明顯(P <0.01),見圖3。(3)與Hcy組比較,黃酒組和紅酒組VECs MMP-2表達分別下降了29.1%和32.6%(P <0.05),酒精組下降 5.3%(P>0.05);與酒精組比較,黃酒組與紅酒組MMP-2表達下降差異有統計學意義(P<0.05);黃酒組與紅酒組之間無顯著差異(P>0.05),見圖4。
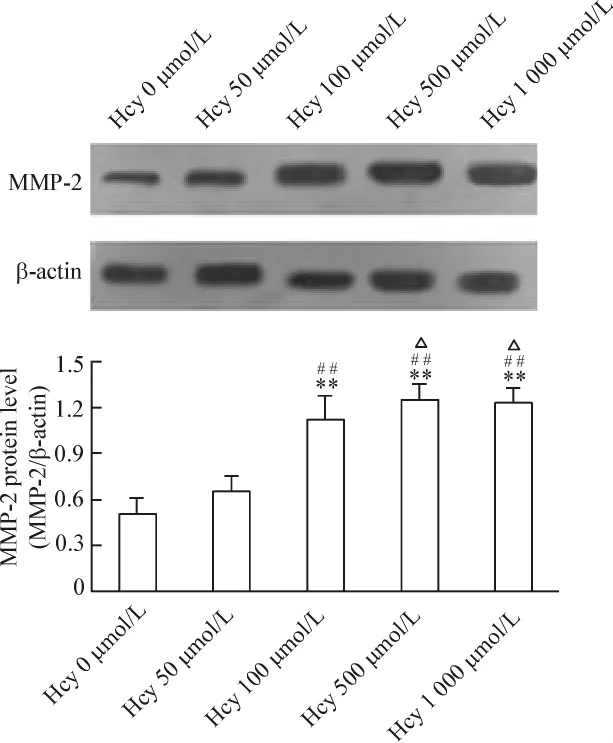
Figure 2.Effects of Hcy at different concentrations on the expression of MMP-2 in VECs.VECs were treated with Hcy at different concentrations for 48 h,and the MMP-2 protein was examined by Western blotting assay.Mean ± SD.n=5.*P < 0.05,** P < 0.01 vs control(0 μmol/L Hcy);##P < 0.01 vs 50 μmol/L Hcy;△P <0.05 vs 100 μmol/L Hcy.圖2 不同作用濃度的Hcy對MMP-2蛋白表達的影響
4 明膠酶譜法檢測MMP-2在VECs上清液中的酶解活性
50~500 μmol/L Hcy增強 MMP-2 的活性,組間差異有統計學意義(P <0.05或 P <0.01),見圖5。Hcy(100 μmol/L)干預24、48、72 h 均能促進 MMP-2活性增強,以 48 h最明顯(P<0.01),見圖 6。與Hcy組相比,MMP-2活性黃酒組和紅酒組分別下降31.2%和33.8%(P <0.05),酒精組下降4.6%(P >0.05);黃酒組和紅酒組MMP-2活性下降與酒精組相比差異有統計學意義(P<0.05);黃酒組與紅酒組之間無顯著差異(P>0.05),見圖7。
討 論
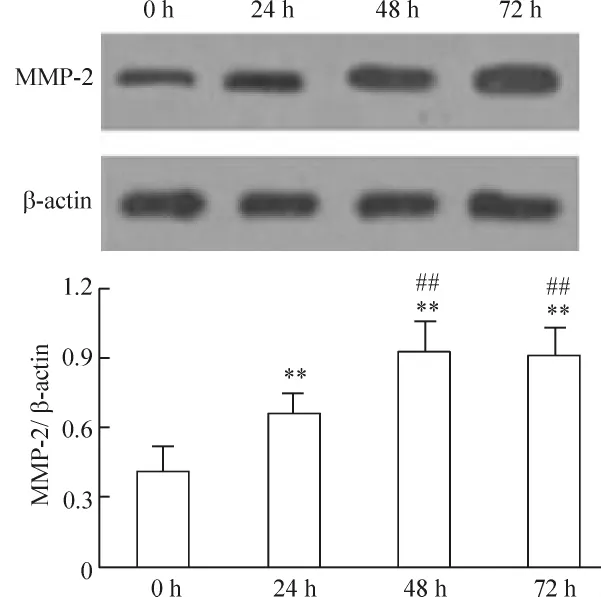
Figure 3.Effects of Hcy treatment for different time on the expression of MMP-2.VECs were incubated with 100 μmol/L Hcy for 24 h,48 h and 72 h.Mean ± SD.n=5.**P <0.01 vs control(0 h);##P <0.01 vs 24 h.圖3 Hcy作用不同時間對MMP-2蛋白表達的影響
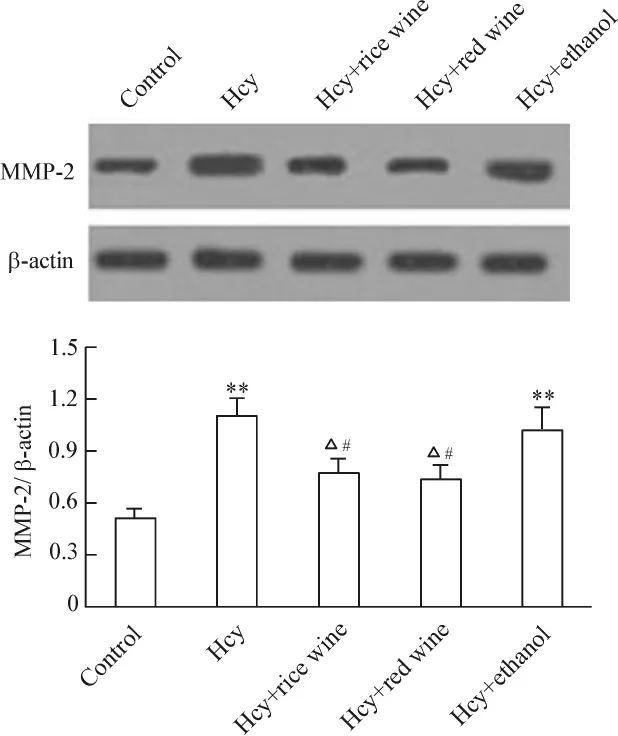
Figure 4.Effect of rice wine on expression of MMP-2 stimulated by Hcy(100 μmol/L,48 h)in cultured VECs.The MMP-2 expression was analysed by Western blotting and normalized with β-actin.Mean ± SD.n=5.**P <0.01 vs control;△P <0.05 vs Hcy;#P <0.05 vs Hcy+ethanol.圖4 黃酒對Hcy刺激下VECs MMP-2表達的影響
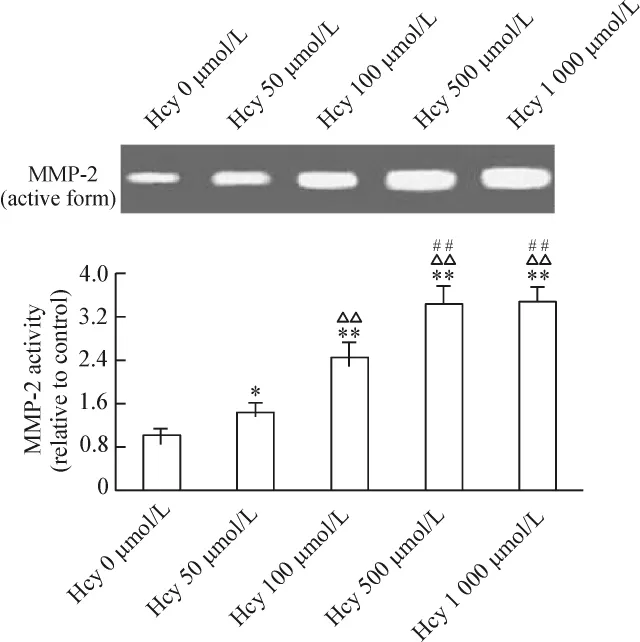
Figure 5.Effects of different concentrations of Hcy on the activity of MMP-2.VECs were treated with Hcy at different concentrations for 48 h,the MMP-2 activity was examined by gelatin zymography assay.Mean ± SD.n=5.*P <0.05,**P < 0.01 vs control(0 μmol/L Hcy);△△P <0.01 vs 50 μmol/L Hcy;##P < 0.01 vs 100 μmol/L Hcy.圖5 不同濃度Hcy對MMP-2活性的影響
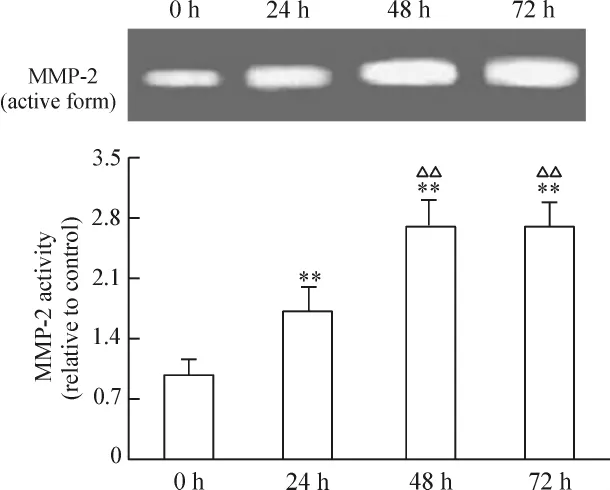
Figure 6.Effects of Hcy treatment for different time on the activity of MMP-2.VECs were treated with 100 μmol/L Hcy for 24 h,48 h and 72 h.Mean ± SD.n=5.**P <0.01 vs control(0 h);△△P < 0.01 vs 24 h.圖6 Hcy作用不同時間對MMP-2活性的影響
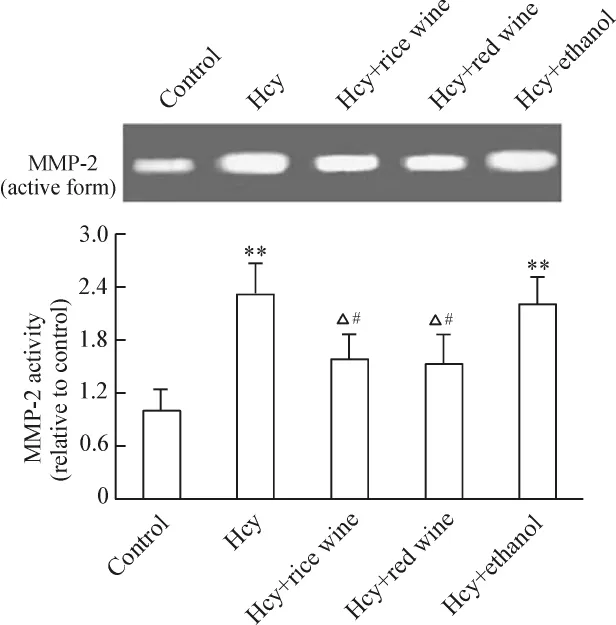
Figure 7.Effect of rice wine on the activity of MMP-2 stimulated by Hcy(100 μmol/L,48 h)in cultured VECs.The MMP-2 activity was analysed by gelatin zymography.Mean ±SD.n=5.**P <0.01 vs control;△P <0.05 vs Hcy;#P <0.05 vs Hcy+ethanol.圖7 黃酒對Hcy刺激下VECs MMP-2活性的影響
基質金屬蛋白酶(MMPs)是一類鋅離子依賴的蛋白水解酶,能裂解幾種細胞外基質成份,如膠原蛋白、酪蛋白、明膠等,參與調節細胞外基質的降解和重建[10-11]。其中以MMP-2分布最廣,主要負責降解Ⅳ型膠原和變性膠原,并且 AS斑塊的形成需要MMP-2介導的細胞外基質重建,其表達上升促進VSMCs增殖和遷移至血管內膜下,參與AS發生發展的過程。在正常血管中,VECs及VSMCs不斷產生MMP-2[7,10-11]。對人類血管的研究表明,與正常區域相比MMP-2一般在脂紋和AS斑塊處高表達,此外還顯示,脂紋、出血和鈣化的纖維粥樣斑塊以及完全閉塞的病變中富含MMP-2[10]。所有這些研究表明,MMP-2在AS病變的發生和進展中起著及其重要的作用。
Hcy增加心血管事件的風險與濃度相關,其通過一個涉及激活 MAPK和PI3K-Akt通路增強VSMCs中MMP-2的合成、分泌和活性。這表明Hcy直接參與導致斑塊不穩定和重塑的機制。Bescond等[12]的研究表明 Hcy直接激活 proMMP-2可能是Hcy相關AS中參與ECM降解的機制之一。Hcy已被確認是AS的獨立危險因子之一,國內外大量研究已經證實其可以通過多種機制引起血管內皮功能損傷和障礙,刺激MMP-2的表達,促進AS的發生[13]。本實驗用不同濃度Hcy刺激體外培養的大鼠VECs,發現Hcy在50~500 μmol/L時呈濃度依賴性地促進MMP-2表達和增強其活性,在48 h時作用最明顯(100 μmol/L),這表明 Hcy可增強 VECs MMP-2 的表達和活性,促進AS的發生。血漿正常Hcy參考范圍為5~15 μmol/L,參考人體實際病理生理情況(中、重度高Hcy血癥≥100 μmol/L)及實驗敏感性,選取100 μmol/L的Hcy作為刺激和造模濃度。
上世紀80年代有國外學者發現,盡管同樣在日常飲食中攝入了大量的飽和脂肪酸,但法國民眾心血管疾病發病率和死亡率卻明顯低于歐美其他國家,此即著名的“法國悖論”。1992年,Renaud等[14]經過研究后提出,法國民眾愛飲紅酒正是導致人群心血管事件發病率下降的主要原因,但具體機制未明。此后,大量對適量飲用紅葡萄酒心血管保護作用機制的研究進一步闡明,其中富含的多酚是紅酒發揮心血管保護作用的主要有效成分[15-16],包括兒茶素、表兒茶素、沒食子酸、阿魏酸、咖啡酸、花青素以及白藜蘆醇等多種酚類[16],具有改善血脂、調節血管內皮、改善內皮祖細胞功能、增加血管內皮NO的合成、抗凝、抑制VSMCs增殖和遷移以及抑制炎癥因子等作用,能顯著延緩甚至抑制粥樣斑塊的進展,最終可以有效減少心肌梗死等嚴重心血管事件的發生[15],其在體外能顯著抑制 MMP-2,MMP-9 在VSMCs的表達和激活,目前認為抑制MMP-2,MMP-9的表達可能是紅酒心血管保護作用的機制之一[17]。由于紅葡萄酒主要通過紅酒多酚來抑制AS的進程,而黃酒同樣富含多酚,其主要來自糯米和小麥,包括兒茶素、丁香酸、綠原酸、表兒茶素、阿魏酸、咖啡酸、沒食子酸、p-香豆酸等9種酚類,總酚含量高達1.023 g/L,與紅酒多酚在種類上幾乎相同且在含量上不相上下[18]。因此我們推測,黃酒可能也是通過黃酒多酚來發揮其對AS病變的抑制作用。
目前國內謝廣發等[18]的研究發現紹興黃酒中不僅含有豐富的多酚類物質,還含有功能性低聚糖、B族維生素、生物活性肽類等多種有益心腦血管健康的成分。功能性低聚糖具有多種重要的生理功能,由于人體不具備分解此糖的酶系,在攝入后不易消化吸收,但它有利于腸道中雙歧桿菌等益生菌的增殖,改善腸道的微生態環境,促進B族維生素的合成吸收。而研究證實VitB6和VitB12能顯著降低血漿Hcy水平,我們在前期體內研究少量飲用黃酒對LDLR-/-小鼠MMP-2表達和AS斑塊形成作用的影響實驗中發現,黃酒組小鼠(高脂飼料+3%黃酒)血漿Hcy濃度較control組(高脂飼料+無菌水)、紅酒組(高脂飼料+3%紅酒)和酒精組(高脂飼料+3%酒精)顯著下降[8]。這表明黃酒具有降低血漿Hcy濃度的功能,鑒于Hcy在AS及MMP-2合成分泌激活中的重要作用,提示我們小劑量黃酒可能通過降低血漿Hcy濃度從而起到對MMP-2表達和活性的抑制作用。本實驗中與Hcy組相比,黃酒組和紅酒組一樣MMP-2蛋白表達和活性明顯下降,酒精組MMP-2蛋白表達及活性盡管有所下降,但均無顯著差異。這與Walter等[19]發現紅葡萄酒對冠心病的保護效應可能涉及紅酒多酚對MMP-2表達的抑制作用有關相一致,表明小劑量黃酒能抑制Hcy刺激下MMP-2表達的上升,說明黃酒也可能通過與紅葡萄酒相類似的機制即酒精以外的保護性成分抑制了MMP-2的表達,起到對心血管系統的保護作用。以上結果都支持少量黃酒能抑制MMP-2表達和具有抗AS作用,并與前期研究的結論一致[7-8]。我們結合前期體內外實驗推測,少量飲用黃酒對粥樣斑塊的抑制作用可能是通過降低血脂和血漿Hcy水平,進而抑制參與AS中的兩種主要細胞 VECs和VSMCs中MMP-2的表達及其外分泌MMP-2的激活來實現的[7-8],并且我們大膽推斷黃酒可能也是通過一種與紅葡萄酒極其相似的機制即黃酒中的黃酒多酚成分來發揮其對AS病變進程的抑制作用。針對黃酒多酚中具體單體成分抗AS作用的研究將在本系列實驗的下一步中展開。
[1] Flammer AJ,Lüscher TF.Three decades of endothelium research:from the detection of nitric oxide to the everyday implementation of endothelial function measurements in cardiovascular diseases[J].Swiss Med Wkly,2010,140:w13122.
[2] Chen HH,Wang DL.Nitric oxide inhibits matrix metalloproteinase-2 expression via the induction of activating transcription factor 3 in endothelial cells[J].Mol Pharmacol,2004,65(5):1130-1140.
[3] Das RR,Seshadri S,Beiser AS,et al.Prevalence and correlates of silent cerebral infarcts in the Framingham offspring study[J].Stroke,2008,39(11):2929-2935.
[4] Noll C,Raaf L,Planque C,et al.Protection and reversal of hepatic fibrosis by red wine polyphenols in hyperhomocysteinemic mice[J].J Nutr Biochem,2011,22(9):856-864.
[5] Costanzo S,Di Castelnuovo A,Donati MB,et al.Wine,beer or spirit drinking in relation to fatal and non-fatal cardiovascular events:a meta-analysis[J].Eur J Epidemiol,2011,26(11):833-850.
[6] 倪 莉,呂旭聰,黃志清,等.黃酒的生理功效及其生理活性物質研究進展[J].中國食品學報,2012,12(3):1-7.
[7] Guo H,Wang P,You B,et al.Chinese yellow wine inhibits production of homocysteine-induced extracellular matrix metalloproteinase-2 in cultured rat vascular smooth muscle cells[J].Clin Nutr,2007,26(3):348-354.
[8] Guo H,Liu L,Shi Y,et al.Chinese yellow wine and red wine inhibit matrix metalloproteinase-2 and improve atherosclerotic plaque in LDL receptor knockout mice[J].Cardiovasc Ther,2010,28(3):161-168.
[9] Kobayashi M,Inoue K,Warabi E,et al.A simple method of isolating mouse aortic endothelial cells[J].J Atheroscler Thromb,2005,12(3):138-142.
[10] B?ck M,Ketelhuth DF,Agewall S.Matrix metalloproteinases in atherothrombosis[J].Prog Cardiovasc Dis,2010,52(5):410-428.
[11] Ketelhuth DF,B?ck M.The role of matrix metalloproteinases in atherothrombosis[J].Curr Atheroscler Rep,2011,13(2):162-169.
[12] Bescond A,Augier T,Chareyre C,et al.Influence of homocysteine on matrix metalloproteinase-2:activation and activity[J].Biochem Biophys Res Commun,1999,263(2):498-503.
[13] 劉玉暉,游 宇.同型半胱氨酸硫內酯損傷血管內皮細胞的機制研究[J].中國病理生理雜志,2011,27(10):1879-1884.
[14] Renaud S,de Lorgeril M.Wine,alcohol,platelets,and the French paradox for coronary heart disease[J].Lancet,1992,339(8808):1523-1526.
[15] Gresele P,Cerletti C,Guglielmini G,et al.Effects of resveratrol and other wine polyphenols on vascular function:an update[J].J Nutr Biochem,2011,22(3):201-211.
[16] Leifert WR,Abeywardena MY.Cardioprotective actions of grape polyphenols[J].Nutr Res,2008,28(11):729-737.
[17] Oak MH,El Bedoui J,Anglard P,et al.Red wine polyphenolic compounds strongly inhibit pro-matrix metalloproteinase-2 expression and its activation in response to thrombin via direct inhibition of membrane type 1-matrix metalloproteinase in vascular smooth muscle cells[J].Circulation,2004,110(13):1861-1867.
[18] 謝廣發,徐 榕,樊阿萍,等.古越龍山黃酒中有益心血管健康的成分分析[J].釀酒,2011,38(5):64-66.
[19] Walter A,Etienne-Selloum N,Sarr M,et al.Angiotensin II induces the vascular expression of VEGF and MMP-2 in vivo:Preventive effect of red wine polyphenols[J].J Vasc Res,2008,45(5):386–394.

