臨產后子宮體部平滑肌高表達HSP27和 αB-crystallin*
馬 薇, 周昌菊, 張衛社
分娩發動的特征性表現是子宮平滑肌的規律收縮和宮頸口的進行性擴張[1]。這一特征目前公認是由多因素作用、多途徑調節、多分子參與、多階段變化的交互作用過程。交互作用的最終靶器官為子宮平滑肌。在宮縮誘導因素的刺激下,子宮平滑肌產生協調、規律、有力的收縮,引起宮腔內壓力升高,啟動分娩。研究臨產前后人子宮體部平滑肌蛋白質表達的變化,既能反映分娩啟動后基因組被激活時蛋白的表達情況,又能反映子宮平滑肌從靜息狀態到收縮狀態的分子轉變結果,對于探討分娩啟動后子宮平滑肌的收縮機制和早產的診治具有重要意義。
本研究擬以人子宮體部平滑肌為研究材料,應用比較蛋白質組學技術篩選出臨產前后子宮體部平滑肌熱休克蛋白27(heat-shock protein 27,HSP27)和α-晶體蛋白 B 鏈(α-crystallin B chain,αB-crystallin)的表達變化,探討小熱休克蛋白(small HSPs)與臨產后子宮平滑肌的收縮關系及可能機制。
材料和方法
1 標本來源及分組
本研究通過醫學倫理委員會認證、經受試對象書面同意,選擇2005年11月至2006年11月在湘雅三醫院及湘雅醫院住院分娩初產婦12例,年齡22~34歲,平均年齡(28.0±5.7)歲。單胎,無妊娠合并癥,孕齡38~41周,因胎位異常或胎兒窘迫在硬膜外麻醉下行剖宮產術。分為:(1)未臨產(not-in-labor,NIL)組:胎兒電子監護儀示無宮縮,陰道檢查宮口未開;(2)自然臨產(in-labor,IL)組:自然臨產、規律宮縮,宮口擴張≥5 cm。每組6例,所有經催產素或/和米索前列醇引產者一律排除。子宮體部組織取材于宮底前壁下1 cm,18號腎活檢穿刺針抽取10 mm厚組織,局部注射縮宮素20 U,壓迫片刻,如出血以3-0可吸收線8字縫合止血。標本經冷生理鹽水漂洗,液氮凍存備用。
2 主要試劑
尿素、二硫蘇糖醇(DTT)、硫脲、碘乙酰胺、固相pH梯度干膠條和考馬斯亮藍G250均為瑞典Amersham Biosciences產品;瓊脂糖、過硫酸銨、丙烯酰胺、甲叉雙丙烯酰胺、甘氨酸、硫代硫酸鈉、碳酸氫銨、四甲基乙二胺、三羥甲基氨基甲烷(Tris)、十二烷基硫酸鈉(SDS)和基質α-氰基-4-羥基肉桂酸(CCA)均為Sigma-Aldrich產品;Trizol試劑、Reverse Transcription Kit和 PCR Kit為 Promega產品;DEPC為 Sigma產品;HSP27羊抗人單克隆抗體和β-actin羊抗人單克隆抗體購自Santa Cruz;硝酸纖維素膜為Schleicher&Schuell產品;化學發光試劑為Pierce產品。RNeasy Mini試劑盒和OneStep RT-PCR試劑盒均為Qiagen產品;其它生化試劑均為進口分裝或國產分析純。所用引物由上海生工生物工程公司根據設計合成,見表1。
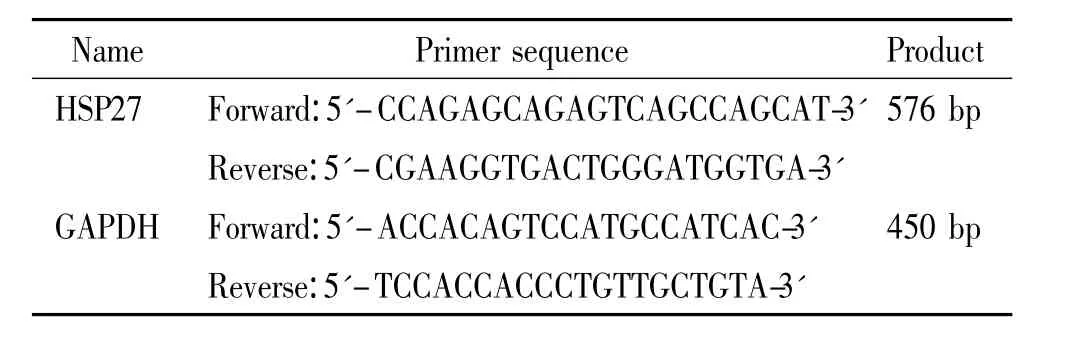
表1 引物序列Table 1.Sequences of the primers
3 生物信息學軟件
Lab Scan掃描軟件和Data Explorer質譜分析軟件為Applied Biosystem產品;ImageMaster 2D Platinum雙向凝膠圖譜分析軟件為Amersham Biosciences產品和Mascot Distiller質譜信號峰識別軟件、Mascot肽質量指紋圖數據庫查詢軟件和Mascot MS/MS數據庫查詢軟件均為Matrixscience產品。
4 主要方法
4.1 組織總蛋白質的提取 80 mg組織樣品加入800 μL組織裂解液的比例加入組織裂解液(7 mol/L尿素、2 mol/L 硫脲、100 mmol/L DTT、4%CHAPS、0.5 mmol/L EDTA、40 mmol/L Tris、2% 兩性載體蛋白質pH 3~10)混合,液氮充分研磨。室溫放置1 h。離心,取上清液即得蛋白質樣品。Bradford法[2]測定蛋白濃度后分裝,-80℃凍存。
4.2 雙向凝膠電泳(two-dimensional gel electrophoresis,2-DE) 第一向固相pH梯度等電聚焦:取900 μg組織總蛋白質(3個同組樣本混合,每個樣本300 μg)與水化液(8 mol/L 尿素、4%CHAPS、40 mmol/L Tris、40 mmol/L DTT、0.5%IPG buffer pH 3 ~10)充分混合,使上樣總體積為450 μL,采用 pH 3~10,4 cm線性IPG預制膠條,水化和聚焦在20℃自動進行,30 V 水化 13 h后,依次經 100 V 0.5 h、500 V 1 h、1 000V 1 h、5 000 V 1 h、8 000 V 8.5 h 進行等電聚焦,總電壓時間積為74 940 Vh。聚焦后先置于平衡 I液(50 mmol/L Tris-HCl、6 mol/L 尿素、30% 甘油、1%SDS、0.2%DTT)中,搖床上平衡 15 min。再在平衡II液(3%碘乙酰胺替代0.2%DTT,其余組分同平衡I液)中平衡15 min。然后進行第二向垂直SDS-PAGE電泳,分離膠濃度為12.5%。
4.3 考馬斯亮藍染色 雙蒸水漂洗后,考馬斯亮藍G250染色,雙蒸水漂洗至背景清楚。
4.4 凝膠圖像分析 凝膠經Image Scanner掃描儀及LabScan掃描軟件掃描,ImageMaster 2D Platinum圖像分析軟件依次進行點檢測、背景消減、匹配、量化比較從而獲取斑點的相關信息。差異點標準:以NIL組2-DE圖譜為參考膠,與IL組子宮體部平滑肌組織的平均膠進行兩兩匹配比較。以蛋白質表達水平(相對體積)增加2倍及2倍以上為差異有統計學意義。
4.5 基質輔助激光解吸電離 -飛行時間質譜(MALDI-TOF-MS) 分析切割差異蛋白質點于1.5 mL EP管中,50%乙腈和50 mmol/L碳酸氫銨脫色,乙腈脫水,真空冷凍離心抽干,胰蛋白酶(0.1 mg/L)酶解,萃取,真空冷凍離心濃縮,然后與基質液CCA混合,點樣于不銹鋼板。最后經MALDI-TOF-MS質譜儀質譜分析,獲得肽質量指紋圖譜(peptide mass finger printing,PMF)。經 Mascot查詢系統,檢索SWISS-PROT和NCBI蛋白質數據庫。搜索結果如果Mascot分數>64分(P<0.05)則認為得到陽性鑒定,否則視為未得到鑒定。
4.6 半定量RT-PCR檢測 采用常規Trizol試劑提取臨產和未臨產子宮體部平滑肌組織總RNA。逆轉錄反應具體操作如下:總RNA與適量DEPC水和Oligo(dT)混合使其體積達12 μL,輕輕混勻70℃孵育5 min,立即置于冰上冷卻5 min,然后配制以下混合物(體積為7 μL):10 ×反應緩沖液 4 μL,RNA 抑制酶 1 μL 和10 mmol/L dNTPs 2 μL;將7 μL 混合物加入到12 μL總RNA混合物中,37℃孵育5 min;最后加入1 μL逆轉錄酶,使其終體積達20 μL。42℃孵育60 min,70℃孵育10 min。PCR反應體系為20 μL,以GAPDH作為內參照,設置PCR反應條件為95℃ 2 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 40 s,共35 個循環。1.5%瓊脂糖分離 PCR產物,凝膠成像儀(Dolphin DOC,Wealtec)分析圖像。
4.7 免疫印跡驗證 取出凍存子宮體部平滑肌組織,以 1∶6 加入組織裂解液(1 mmol/L Tris-HCl、0.5 mmol/L EDTA、2%SDS、5 mmol/L DTT、10 mmol/L PMSF),冰內勻漿 10 min,靜置1 h,30 s超聲粉碎,4℃、12 000×g離心40 min,收集上清液,Bradford法測蛋白濃度。50 μg蛋白再經濃縮膠、分離膠SDSPAGE電泳分離,電轉移至硝酸纖維素膜,5%脫脂奶粉封閉非特異性蛋白結合位點,然后膜與相應HSP27抗體4℃孵育12 h,洗滌;Ⅱ抗室溫孵育1 h,洗滌,加入化學發光底物,暗室X光片曝光、顯影、定影顯示條帶。
4.8 免疫組織化學驗證 新鮮標本迅速用4%多聚甲醛固定24 h,組織脫水、包埋,切片機切4 μm的石蠟切片,50℃烤片30 min,經脫蠟處理和胰酶修復后加Ⅰ抗,分別滴加1∶100稀釋的HSP27抗體,37℃ 1 h,PBS洗3次,每次3 min。加生物素標記Ⅱ抗,37℃ 1 h,PBS洗3次,每次3 min。滴加SABC:20~37℃,20 min,PBS洗4次,每次5 min。DAB顯色:1 mL蒸餾水中加DAB顯色液A、B、C各一滴,充分混勻、顯色、復染、照相。由2個觀察者對切片進行盲式閱片,顯微鏡下隨機選取5個視野,Motic顯微圖像攝像系統攝像,北航MIAS生物醫學圖像分析管理系統測定產物的吸光度,以此反映陽性產物的相對表達量。
5 統計學處理
用SPSS 16.0統計學軟件進行分析。數據采用均數±標準差(mean±SD)表示。2-DE圖譜采用ImageMaster 2D Platinum軟件進行分析,兩兩匹配比較,以蛋白質表達水平(相對體積)增加≥2倍為差異有統計學意義。
結 果
1 比較蛋白質組學2-DE圖譜鑒定結果
通過2-DE獲得NIL和IL組的子宮體部平滑肌2-DE圖譜,經蛋白質斑點脫色、還原、烷基化、胰酶酶解、萃取、脫鹽后,MALDI-TOF-MS分析,以基質峰和酶自動降解片段峰進行校正,去除角蛋白和胰酶自切峰,精確標定強度為基質峰強度2倍以上的峰,HSP27和αB-crystallin均獲得PMF譜,將PMF譜數據輸入Mascot查詢系統,檢索SWISS-PROT和NCBI蛋白質數據庫。圖1為臨產后子宮體部平滑肌2-DE圖譜(右側)和局部放大的差異蛋白HSP27(Spot B)和αB-crystallin(Spot E),2個蛋白在臨產后子宮體部平滑肌表達上調(P<0.05)(左側)。同時發現:臨產前后子宮平滑肌2-DE圖譜均存在4個分子量相等、等電點不同的HSP27蛋白斑點(Spot A、Spot B、Spot C和Spot D),但2組經ImageMaster 2D Platinum軟件分析比較,僅Spot B具有顯著差異(P<0.05),其它3個蛋白斑點無顯著差異,見表2。圖2是Spot B經MALDI-TOF-MS分析得到的PMF譜。
2 HSP27 mRNA的RT-PCR檢測結果
以HSP27引物對未臨產和臨產的子宮體部平滑肌組織進行RT-PCR擴增,HSP27 mRNA在臨產后子宮體部平滑肌組織表達明顯增高,NIL組和IL組的相對表達量依次為0.4801±0.0453和0.8320±0.0981,差異顯著(P <0.01),見圖3。
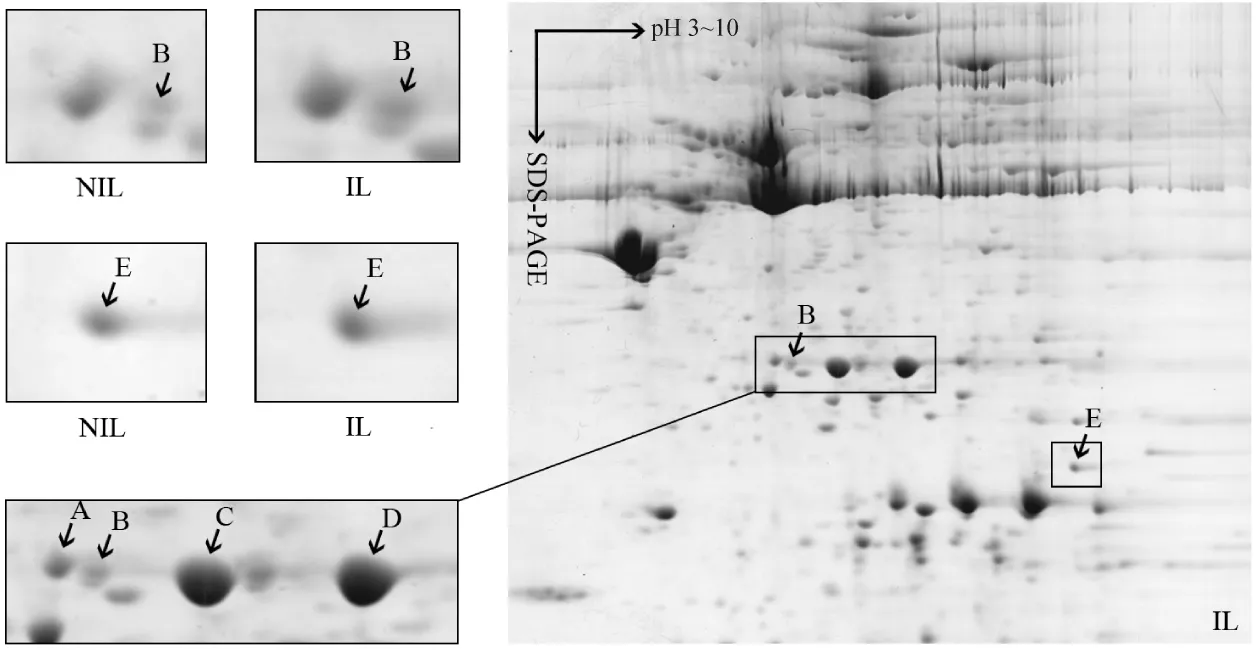
Figure 1.Representative 2-DE map of corpus uteri myometrium in in-labor situation(right).HSP27(Spot B)and αB-crystallin(Spot E)proteins were up-regulated in copus uteri myometrium in in-labor situation(P <0.05).Close-up images of Spot B and Spot E from not-in-labor(NIL,n=6)and in-labor(IL,n=6)2-DE profiles were on the left.Spot A,Spot C and Spot D were also HSP27 identified by MALDI-TOF-MS,but they had no significant difference between IL group and NIL group(P >0.05).圖1 臨產后子宮體部平滑肌2-DE圖譜

表2 MALDI-TOF-MS鑒定的臨產前后子宮體部平滑肌蛋白質點Table 2.Protein spots in in-labor(IL)and not-in-labor(NIL)group identified by MALDI-TOF-MS
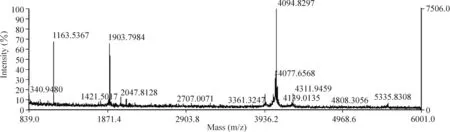
Figure 2.A representative peptide mass fingerprint of spot B.圖2 B點蛋白質的PMF圖
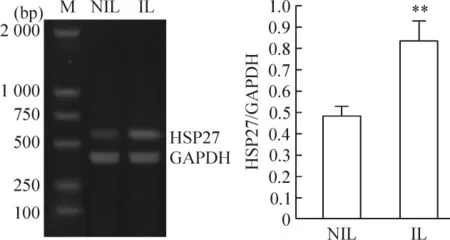
Figure 3.RT-PCR for HSP27 mRNA expression in corpus uteri myometrium in in-labor(IL)and not-in-labor(NIL)groups.M:DNA marker.Mean ± SD.n=6.**P <0.01 vs NIL.圖3 臨產前后子宮體部平滑肌組織HSP27 mRNA表達的比較
3 HSP27蛋白的免疫印跡分析
免疫印跡結果顯示,HSP27蛋白在臨產后子宮體部平滑肌組織表達明顯上調,與蛋白質組學的結果一致。另外,NIL組和IL組表達的HSP27的印跡均為2條,提示HSP27在妊娠晚期和臨產后子宮體部平滑肌內的表達可能存在特殊的構象變化,見圖4。

Figure 4.Western blotting analysis of HSP27 protein in corpus uteri myometrium in in-labor(IL)and not-in-labor(NIL)groups.β-actin was a loading control.圖4 HSP27蛋白免疫印跡分析
4 HSP27蛋白的免疫組化表達
HSP27蛋白陽性表達定位于胞漿。NIL組HSP27陽性表達面積較少,部分胞漿著色;IL組HSP27陽性表達面積較多,胞漿廣泛著棕黃色。NIL組和IL組HSP27陽性產物表達的平均吸光度分別為0.2290 ±0.0419 和 0.6360 ±0.1083,差異顯著(P<0.01),與蛋白質組學的結果一致,見圖5。
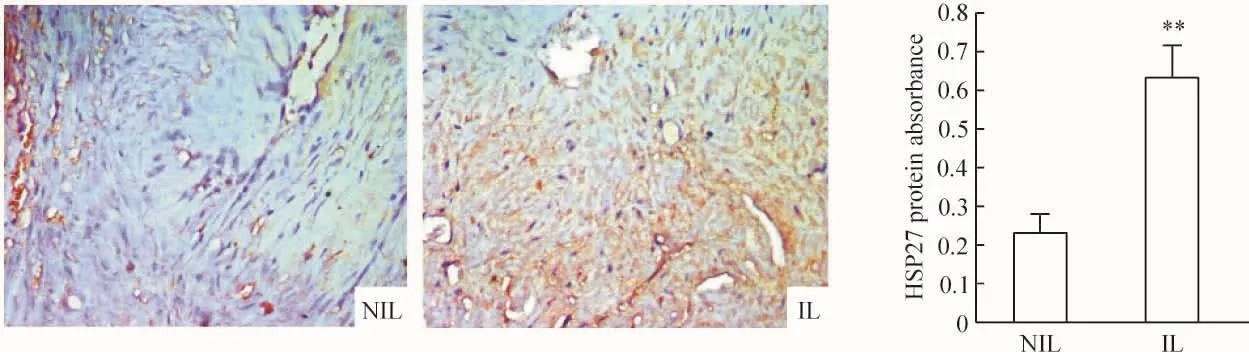
Figure 5.Expression of HSP27 in corpus uteri myometrium in in-labor(IL)and not-in-labor(NIL)groups(immunohistochemical staining,×400).Mean ±SD.n=6.**P <0.01 vs NIL.圖5 臨產前后子宮體部平滑肌HSP27蛋白的表達和吸光度值比較
討 論
1 臨產后子宮體部平滑肌高表達HSP27和αB-crystallin
應用比較蛋白質組學技術,我們成功地鑒定出臨產后子宮體部平滑肌高表達HSP27和αB-crystallin兩個small HSPs,通過半定量RT-PCR、免疫印跡和免疫組化實驗均證實了HSP27蛋白的表達變化與蛋白質組學研究結果高度一致。這與我們之前報道[3]的自然臨產后HSP27的基因HSPB1表達上調了4.09倍,催產素誘導的臨產子宮體部平滑肌HSPB1上調了4.76倍的結果相一致,提示無論是從基因水平還是蛋白質水平,small HSPs確實參與了臨產后子宮體部平滑肌收縮事件。Salintnone等[4]報道small HSPs可以通過分子伴侶變性蛋白、維持細胞間氧化還原狀態以及修飾絲狀肌動蛋白的聚合作用來調節平滑肌細胞的收縮、遷徙和存活。體外實驗[5]也證實熱休克蛋白可增加線粒體及收縮蛋白的功能,雌激素在轉錄及翻譯過程中可調節熱休克蛋白表達與合成,證實熱休克蛋白是一類受雌激素調節、具有增強平滑肌收縮功能的蛋白質。
2 HSP27和αB-crystallin參與子宮平滑肌收縮的可能機制
Bitar等[6]發現HSP27抗體可抑制蛙皮素誘導的小腸平滑肌細胞的收縮作用,最早提出HSP27參與平滑肌收縮的觀點。HSP27可以通過改變平滑肌細胞F-actin的穩定性和微絲結構來調節細胞骨架的動力學[7]。人血小板中HSP27能促進F-actin的形成[8]。Bitar等[9]發現兔結腸平滑肌 HSP27 的磷酸化對于平滑肌細胞內部HSP27的結構重組非常必要,且與蛋白激酶C信號轉導通路直接相關。興奮劑誘導HSP27發生磷酸化,而磷酸化的HSP27又通過調節原肌球蛋白(tropomyosin)的細肌絲來調節actin-myosin的交互作用。Somara等[10]報道HSP27可與 actin、tropomyosin、鈣調蛋白(calmodulin,CaM)產生免疫共沉淀。磷酸化HSP27調節磷酸化的CaM-tropomyosin的交互作用,結腸平滑肌細胞微絲通過磷酸化結合或解離收縮蛋白產生收縮或舒張效應。HSP27受熱休克以及細胞因子、生長因子、激素肽等應激刺激發生磷酸化,而磷酸化的HSP27可以改變actin的細胞骨架以及影響依賴actin的細胞事件。細胞骨架的結構改變是平滑肌收縮的物質基礎。
Gerthoffer等[11]指出HSP27的磷酸化作用是actin-myosin發生交互作用誘發平滑肌收縮的先決條件。磷酸化可以誘導small HSPs的三級分子結構發生改變,形成同源/異源寡聚體,從而與actin的細胞骨架發生親和作用,如磷酸化可以誘導αB-crystallin和HSP27多聚體解離成單聚體及二聚體亞單位。人平滑肌HSP27磷酸化的3個主要位點:Ser-15、Ser-78和Ser-82,與甘氨酸結合可以阻止HSP27寡聚體的形成,抑制 HSP27介導的 F-actin蓄積[12],支持HSP27磷酸化具有穩定actin微絲的作用。MacIntyre等[13]報道臨產前HSP27與αB-crystallin主要定位于人子宮下段平滑肌細胞的胞核周圍和胞漿,而臨產后HSP27則遷移至人子宮平滑肌細胞F-actin束中,且與HSP27-Ser15的磷酸化增加及HSP27-Ser82脫磷酸化同步發生。White等[14]報道妊娠晚期大鼠子宮平滑肌的張力促進HSP27蛋白表達的增加,分娩時磷酸化HSP27(Ser15)由孕鼠子宮平滑肌細胞胞膜位置遷至胞漿,提示HSP27表達增加和移位是其對晚期妊娠至分娩啟動的轉化過程中子宮張力增加的機械應激反應。Gaestel等[15]認為HSP27的翻譯后修飾作用除了磷酸化之外,還可能發生脫酰胺作用或酰化作用、氧化作用以及糖基化作用。本實驗中NIL組和IL組子宮體部平滑肌2-DE圖譜均發現4個分子量相等、等電點不同的HSP27蛋白點,2組比較僅有1個HSP27蛋白斑點在臨產后表達增加。蛋白印跡實驗也證實2組子宮體部平滑肌HSP27的印跡表達均為2條,提示HSP27可能通過特定的翻譯后修飾作用發生了分子構象變化,協助維持妊娠晚期平滑肌的細胞結構。一旦應激,表達迅速增加,通過與平滑肌細胞收縮裝置(actin和/或tropomyosin)發生交聯,參與臨產后子宮平滑肌細胞的收縮活動。
臨產后人子宮體部平滑肌αB-crystallin表達上調。目前αB-crystallin在平滑肌組織中的功能尚不十分清楚,有報道[16]細胞受到壓力刺激時,B-crystallin可作為分子伴侶來阻止變性蛋白發生凝集和增加細胞對壓力的耐受。亦有證據[17]提示αB-crystallin對肌細胞的中間絲具重要的調節作用。αB-crystallin基因突變可致中間絲斷裂凝集、骨骼肌發育障礙和心肌病的發生[18]。Sugiyama 等[19]發現培養的小鼠成肌細胞誘導分化的肌小管中存在αB-crystallin與HSP27的特殊交互作用,二者共同定位于發育良好的肌小管actin束上,但成肌細胞HSP27表達缺失,提示small HSPs參與肌小管中最初的肌原纖維組裝。MacIntyre等[13]報道臨產前人子宮下段平滑肌中HSP27與αB-crystallin發生交聯,臨產后該交聯作用下降。人子宮平滑肌αB-crystallin和HSP27之間的交聯機制尚不明確,可能通過分子伴侶協同作用和/或參與細胞骨架塑形來誘發平滑肌細胞收縮。
3 子宮體部和子宮下段αB-crystallin參與平滑肌收縮的功能可能不同
本研究中臨產后子宮體部平滑肌αB-crystallin表達顯著上調,而MacIntyre等[13]報道臨產后子宮下段平滑肌αB-crystallin表達顯著下調,提示αB-crystallin在臨產后子宮體部和子宮下段收縮中承擔的功能可能不同。由于子宮體部和子宮下段的組織結構、妊娠晚期受到的內分泌環境和機械應激刺激不同,二者在分娩啟動中扮演的角色也不同。接受應激信號后,子宮體部表現以功能增加為主,而子宮下段則表現以功能抑制為主。此種反方向的作用機制,為分娩發動中子宮體部平滑肌收縮與子宮下段平滑肌舒張的協調奠定了分子基礎[20]。對于臨產后αB-crystallin蛋白表達上調而子宮下段其表達下調機制的深入研究有助于我們更進一步理解分娩啟動后的子宮平滑肌的收縮機制,改善不良妊娠結局。
Small HSPs作為免疫佐劑和腫瘤治療的靶點,可以改變細胞或組織的應激能力,增加藥物的療效等都展現了廣闊的前景。利用本研究發現的子宮體部平滑肌具有的small HSPs分子靶點及臨產時上調的規律,將small HSPs與宮縮劑結合,對于臨床治療梗阻性難產、協調宮縮、增加療效、減少藥物用量等方面提供了新的思路。
(致謝:感謝中南大學湘雅醫院衛生部蛋白質組學重點實驗室肖志強教授對于本課題的意見!)
[1] Havelock JC,Keller P,Muleba N,et al.Human myome-trial gene expression before and during parturition[J].Biol Reprod,2005,72(3):707-719.
[2] Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Chem,1976,72:248-254.
[3] 張衛社,吳新華,伍招娣,等.自然臨產及縮宮素誘導臨產子宮體部平滑肌差異基因表達譜分析[J].現代婦產科進展,2007,16(3):206-209.
[4] Salinthone S,Tyagi M,Gerthoffer WT.Small heat shock proteins in smooth muscle[J].Pharmacol Ther,2008,119(1):44-54.
[5] Papaconstantinou AD,Goering PL,Umbreit TH,et al.Regulation of uterine hsp90α,hsp72 and HSF-1 transcription in B6C3F1 mice by β-estradiol and bisphenol A:involvement of the estrogen receptor and protein kinase C[J].Toxicol Lett,2003,144(2):257-270.
[6] Bitar KN,Kaminski MS,Hailat N,et al.HSP27 is a mediator of sustained smooth muscle contraction in response to bombesin[J].Biochem Biophys Res Commun,1991,181(3):1192-1200.
[7] Quinlan R.Cytoskeletal competence requires protein chaperones[J].Prog Mol Subcell Biol,2002,28:219-233.
[8] Butt E,Immler D,Meyer HE,et al.Heat shock protein 27 is a substrate of cGMP-dependent protein kinase in intact human platelets.Phosphorylation-induced actin polymerization caused by Hsp27 mutants[J].J Biol Chem,2001,276(10):7108-7113.
[9] Bitar KN.HSP27 phosphorylation and interaction with actin-myosin in smooth muscle contraction[J].Am J Physiol Gastrointest Liver Physiol,2002,282(5):G894-G903.
[10] Somara S,Bitar KN.Phosphorylated HSP27 modulates the association of phosphorylated caldesmon with tropomyosin in colonic smooth muscle[J].Am J Physiol Gastrointest Liver Physiol,2006,291(4):G630-G639.
[11] Gerthoffer WT,Gunst SJ.Invited review:focal adhesion and small heat shock proteins in the regulation of actin remodeling and contractility in smooth muscle[J].J Appl Physiol,2001,91(2):963-972.
[12]Lavoie JN,Gingras-Breton G,Tanguay RM,et al.Induction of Chinese hamster HSP27 gene expression in mouse cells confers resistance to heat shock.HSP27 stabilization of the microfilament organization[J].J Biol Chem,1993,268(5):3420-3429.
[13]MacIntyre DA,Tyson EK,Read M,et al.Contraction in human myometrium is associated with changes in small heat proteins[J].Endocrinology,2008,149(1):245-252.
[14] White BG,MacPhee DJ.Distension of the uterus induced HspB1 expression in rat uterine smooth muscle[J].Am J Physiol Regul Integr Comp Physiol,2011,301(5):R1418-R1426.
[15] Gaestel M. sHsp-phosphorylation:enzymes, signaling pathways and functional implications[J].Prog Mol Subcell Biol,2002,28:151-169.
[16] Chávez Zobel AT,Loranger A,Marceau N,et al.Distinct chaperone mechanisms can delay the formation of aggresomes by the myopathy-causing R120G αB-crystallin mutant[J].Hum Mol Genet,2003,12(13):1609-1620.
[17] Perng MD,Cairns L,van den IJssel P,et al.Intermediate filament interactions can be altered by HSP27 and αB-crystallin[J].J Cell Sci,1999,112(Pt 13):2099-2112.
[18] Vicart P,Caron A,Guicheney P,et al.A missense mutation in the αB-crystallin chaperone gene causes a desminrelated myopathy[J].Nat Genet,1998,20(1):92-95.
[19]Sugiyama Y,Suzuki A,Kishikawa M,et al.Muscle develops a specific form of small heat shock protein complex composed of MKBP/HSPB2 and HSPB3 during myogenic differentiation[J].J Biol Chem,2000,275(2):1095-1104.
[20]張衛社,郭海燕,謝慶生,等.分娩活躍期子宮體部與子宮下段平滑肌差異基因表達譜的篩選[J].國際病理科學與臨床雜志,2007,27(5):388-392.

