尼古丁對人牙周膜成纖維細胞超微結構及分泌細胞因子的影響*
陳慧中, 卜欠欠, 孔衛東, 曾慧蘭, 李 陽, 劉宏偉
牙周膜成纖維細胞(periodontal ligament fibroblasts,PDLFs)是牙周膜中數量最多、功能最重要的細胞之一,參與膠原蛋白的合成與吸收,與基質形成、骨質形成有關。吸煙是牙周病尤其是重度牙周病的高危因素,尼古丁占煙草生物堿總量約95%以上,近年來尼古丁對牙周組織再生和修復的毒性研究引起關注[1],而其作用機制尚未十分明確,許多學者從尼古丁對PDLFs的堿性磷酸酶變化、蛋白質合成、尼古丁型乙酰膽堿受體及細胞外基質影響等方面進行研究,證實尼古丁從多方面影響牙周病的發生、發展和預后[2-4]。本研究擬探討尼古丁對PDLFs的細胞形態、增殖、細胞周期、凋亡及細胞因子生成的影響,以進一步闡明尼古丁致病機制。
材料和方法
1 材料
1.1 主要試劑與儀器 人牙周膜成纖維細胞株(上海拜力生物科技有限公司);尼古丁(北京伊普瑞斯公司);DMEM/F12培養基和澳洲胎牛血清(fetal bovine serum,FBS;Gibco);青霉素和鏈霉素(華北制藥公司);MTT、胰酶、碘化丙啶(propidium iodide,PI;Sigma);PI-Annexin V雙染試劑盒(北京寶賽生物技術公司);CO2培養箱(Thermo Forma);原子力顯微鏡(Thermo);酶標儀(BioTek);流式細胞檢測儀(BD);透射電鏡(Philips);轉化生長因子β1(transforming growth factor β1,TGF-β1)、細胞間黏附分子 1(intercellular adhesion molecule 1,ICAM-1)、血管內皮生長因子(vascular endothelial growth factor,VEGF)和血管細胞黏附分子1(vascular cell adhesion molecule 1,VCAM-1)酶聯免疫試劑盒(武漢博士德生物工程有限公司);堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF)和胰島素樣生長因子 I(insulin-like growth factor I,IGF-I)酶聯免疫試劑盒(華美生物工程有限公司)。
1.2 細胞培養 PDLFs按(1.0~1.5)×106/L的密度接種于T-25培養瓶,含15%FBS的DMEM/F12進行培養。細胞達80%融合時,0.25%胰蛋白酶消化細胞,1∶2或1∶3比例傳代,每3~4 d換液。取3~7代細胞實驗。實驗組加15%FBS的DMEM/F12培養液配制的不同濃度尼古丁,對照組加含15%FBS的DMEM/F12培養液。
2 方法
2.1 細胞形貌及超微結構觀察 (1)細胞爬片后,實驗組加0.6 g/L尼古丁孵育24 h,取出蓋玻片,2.5%戊二醛固定10 min,漂洗,風干,原子力顯微鏡觀察;(2)PDLFs以6×108/L接種培養,細胞達80%融合,實驗組加0.8 g/L 尼古丁,孵育 24 h,2.5%戊二醛固定4 h,1%鋨酸固定1~2 h,脫水、包埋、切片,3%醋酸鈾-枸櫞酸鉛雙染色,透射電鏡觀察。
2.2 MTT法測細胞增殖抑制率 細胞以3×107/L接種于96孔板,每孔100 μL,培養24 h。實驗組加尼古丁(0.5、0.8、1.0、1.5 g/L)作用 24、48、72 h,每孔加20 μL MTT,孵育4 h,每孔加=甲基亞砜(dimethyl sulfoxide,DMSO)150 μL,酶 標 儀 測 吸 光 度(A490)。計算細胞增殖抑制率進行細胞活性評價,細胞生長增殖抑制率(%)=(1-實驗組 A490/正常對照組A490)×100%。
2.3 PI法測細胞周期 細胞以2×108/L接種于6孔板培養 24 h,實驗組加尼古丁(0.2、0.4、0.6 g/L)孵育24 h,冰乙醇固定,PI染色,流式細胞儀檢測,BD FAC Sort Cell Quest軟件分析結果。
2.4 Annexin V-FITC/PI雙染測細胞凋亡率 實驗組加尼古丁(0.5、1.0、1.5 g/L)孵育 24 h,洗滌,離心,加 200 μL 結合緩沖液,分別加 2 μL Annexin VFITC 和2 μL PI,流式細胞儀檢測。
2.5 ELISA法檢測培養上清細胞因子水平 細胞以2×108/L接種于6孔板培養24 h,實驗組加尼古丁(0.4、0.6、1.0 g/L),24 h 收上清液 -80 ℃冷藏,按ELISA試劑盒步驟操作,酶標儀測吸光度(A450),CurveExpert 1.3軟件計算細胞因子ICAM-1、VCAM-1、VEGF、TGF-β1、IGF-I和 bFGF 濃度。
3 統計學處理
采用SPSS 13.0軟件,計量資料以均數±標準差(mena±SD)表示,組間均數比較采用單因素方差分析,以P<0.05為差異有統計學意義。
結 果
1 尼古丁對PDLFs表面形貌和超微結構的影響
原子力顯微鏡下見正常細胞呈長梭形,胞質與胞核邊界清晰,細胞骨架明顯,表面較粗糙,向四周延伸出數量不等的偽足樣突起,見圖1A。尼古丁作用后,細胞縮小,胞質中見大量空泡,核膜破壞,胞質與胞核邊界模糊,見圖1B。透射電鏡下,正常PDLFs呈圓形或類圓形,細胞膜完整,表面有較多微絨毛和突起,細胞核有單核或多核,形狀不規則,核膜清晰,1個或多個核仁,核質比例大,胞漿含散在粗面內質網和核糖體,線粒體嵴清晰連續,見圖2A、B、E、G。尼古丁作用后,細胞表面突起和微絨毛增多,胞內大量空泡,水腫明顯。胞核固縮崩解,染色質濃縮邊集,見圖2C、D。粗面內質網擴張成池,內充以低電子密度物質,見圖2F。線粒體嵴擴張,見圖2H,基質電子密度增高,部分水腫,余細胞器未見明顯變化。

Figure 1.Effect of nicotine on surface morphology of PDLFs observed by atomic force microscopy.A1~A3:control group;B1~B3:nicotine(1.0 g/L)group.1:the overall surface morphology;2,3:the enlarged areas.圖1 尼古丁對PDLFs表面形貌的影響
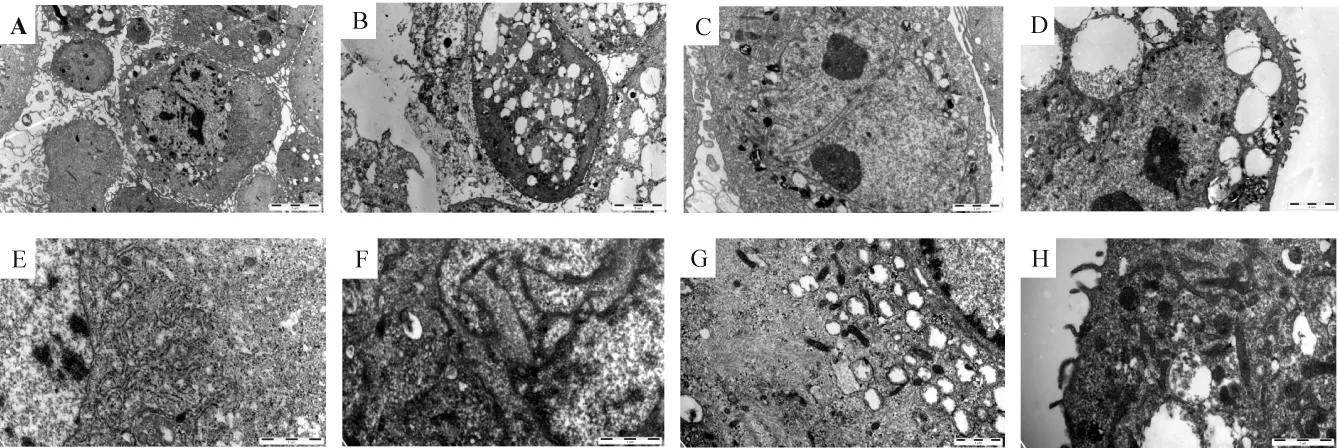
Figure 2.Ultrastructure of PDLFs observed by transmission electron microscopy.A,B:overall morphology in control group.C,D:overall morphology in nicotine group;E:mitochondria in control group;F:mitochondria in nicotine group;G:endoplasmic reticulumin in control group;H:endoplasmic reticulum in nicotine group.A,C:×3 700;B,D:×8 900;E,F:×17 500;G,H:×24 000.圖2TEM觀察PDLFs超微結構
2 尼古丁對PDLFs增殖抑制率的影響
不同濃度尼古丁(0.5、0.8、1.0、1.5 g/L)作用24、48、72 h,均抑制細胞增殖,呈時間和濃度依賴性(P <0.05),見表1、2。
3 尼古丁對PDLFs細胞周期的影響
0.2 、0.4、0.6 g/L 尼古丁作用24 h 后,隨濃度增高,各組細胞G0/G1期比例逐漸增高(P<0.05),S期和G2期比例則呈下降趨勢,見圖3、表3。
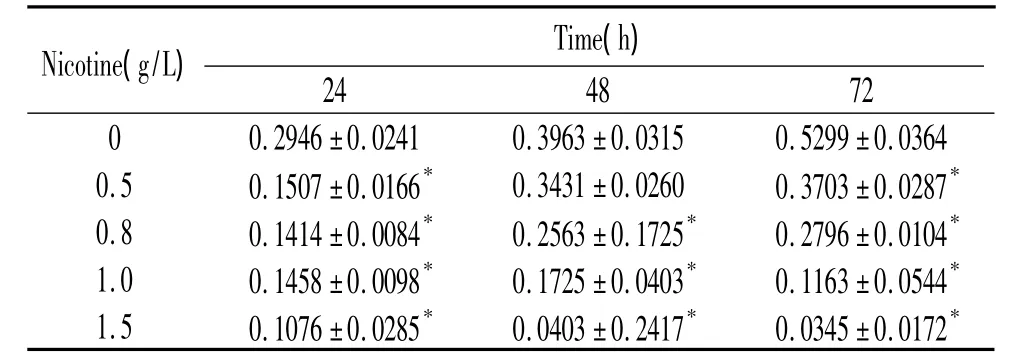
表1 不同濃度尼古丁對PDLFs增殖的影響Table 1.Effects of different concentrations of nicotine on proliferation of PDLFs(A490.Mean ± SD.n=3)
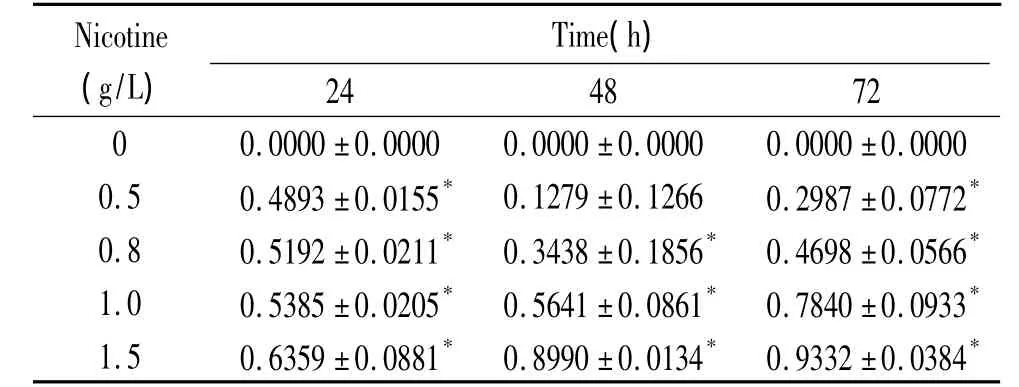
表2 不同濃度尼古丁作用PDLFs的抑制率Table 2.Inhibitory rate of PDLFs after treatment with nicotine at different concentrations(mean±SD.n=3)
4 尼古丁對PDLFs凋亡率的影響
0.5 、1.0、1.5 g/L尼古丁作用細胞24 h后,細胞凋亡率均高于對照組。對照組早期凋亡比率為(0.700±0.566)%;0.5 g/L組、1.0 g/L組與1.5 g/L組早期凋亡比率分別為(0.750±0.495)%、(0.750±0.495)%和(1.600±0.990)%,雖然高于對照組,但差異無統計學意義(P>0.05),見圖4。
5 尼古丁對細胞因子分泌水平的影響
不同濃度尼古丁細胞作用后,bFGF水平下降,0.6 g/L尼古丁組與對照組相比有統計學意義(P<0.05);IGF-I水平下降,呈濃度依賴性(P <0.05);ICAM-1水平上升(P <0.05),見表4。VCAM-1水平上升,但差異無統計學意義(P >0.05);TGF-β1水平上升,1.0 g/L尼古丁組與對照組相比有統計學意義(P<0.05),VEGF水平上升,但差異無統計學意義(P >0.05),見表 5。
討 論
牙周膜是位于牙骨質和牙槽骨之間的纖維連接組織。PDLFs具多種生物學功能,不僅合成膠原、基質、彈力纖維和糖蛋白,還可分化為成牙骨質細胞、成骨細胞,形成牙骨質、牙槽骨等,尚有吸收膠原吞噬異物的能力,對平衡牙周膜結構和功能,維持、再生和損傷修復牙齒支持組織起重要作用。PDLFs的數量、形態、增殖是其生物學活性如黏附、生物合成和分化等的必要保證。煙草中含4 000多種毒素,如尼古丁、CO、亞硝基胺等,其中主要成分尼古丁對PDLFs的氧化損傷引起關注。吸煙后牙周局部尼古丁濃度增高[5],使細胞內活性氧自由基陡增,消耗GSH 等抗氧化物質[6],致細胞凋亡[7]。吸煙者牙周炎區段數高于非吸煙者,且煙量可影響牙周病,即重度吸煙者的牙周炎區段數高于輕、中度吸煙者[8-9]。本研究顯示尼古丁抑制細胞增殖,促進其凋亡主要以影響PDLFs膜性結構(線粒體和內質網)破壞為主,導致細胞蛋白合成和有氧呼吸功能受損,影響細胞活性與功能,造成不可逆損傷,從而減弱PDLFs黏附遷移能力,導致牙周病。而細胞內骨架改變可反映外部的刺激作用[9],至于尼古丁對細胞周期和凋亡率的影響,雖然DNA合成阻滯于G0/G1期,并呈劑量依賴性,但與對照組相比,差異無統計學意義(P>0.05),所以,影響凋亡主要以致膜性結構破壞為主。
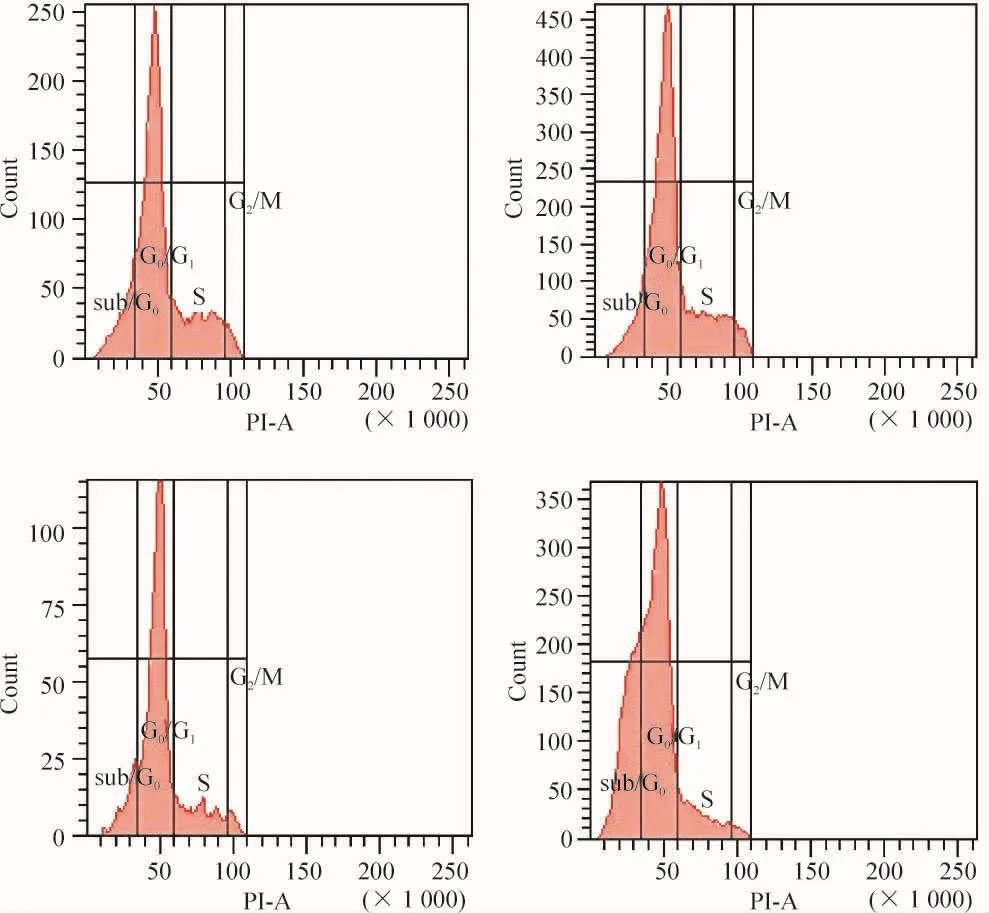
Figure 3.Cell cycle distribution of PDLFs treated with nicotine for 24 h.A:control group;B:nicotine(0.2 g/L)group;C:nicotine(0.4 g/L)group;D:nicotine(0.6 g/L)group.圖3 尼古丁作用PDLFs 24 h后細胞周期的變化

表3 不同濃度的尼古丁干預PDLFs 24 h后細胞周期的變化Table 3.Cell cycle distribution of PDLFs treated with nicotine at various concentrations for 24 h(%.Mean±SD.n=3)
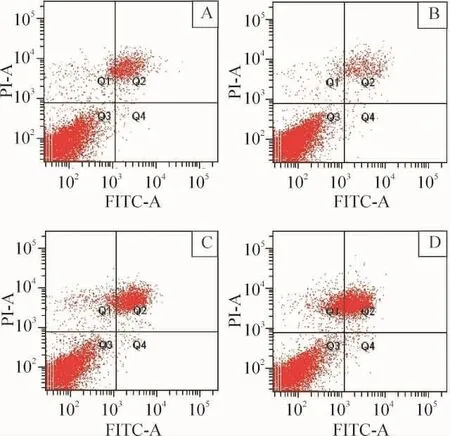
Figure 4.Apoptotic rate of PDLFs treated with nicotine at various concentrations for 24 h.A:control group;B:nicotine(0.5 g/L)group;C:nicotine(1 g/L)group;D:nicotine(1.5 g/L)group.圖4 不同濃度尼古丁作用PDLFs 24 h后的凋亡率
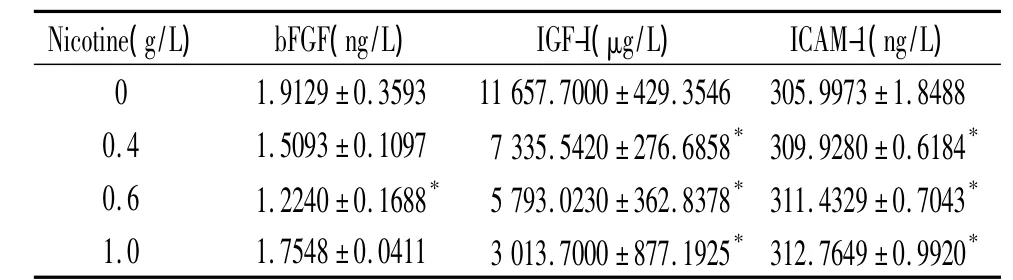
表4 尼古丁對PDLFs分泌bFGF、IGF-I和ICAM-1的影響Table 4.Effects of nicotine on secretion of bFGF,IGF-I and ICAM-1 in PDLFs(mean±SD.n=3)
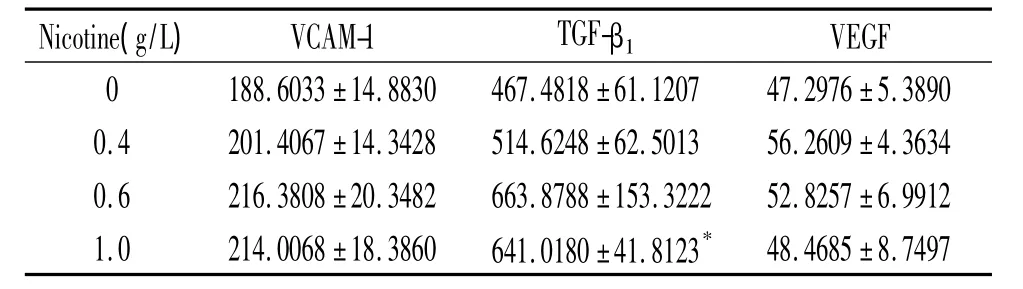
表5 不同濃度尼古丁對PDLFs分泌VCAM-1、TGF-β1和VEGF的影響Table 5.Effects of nicotine on secretion of VCAM-1,TGF-β1and VEGF in PDLFs(ng/L.Mean±SD.n=3)
尼古丁尚可在細胞水平干擾損害免疫細胞功能,影響牙周病進程。bFGF可促進牙周細胞增殖,促進牙周創傷愈合早期血管網的形成[10]。其分泌水平下降,牙周組織修復受到抑制。杜克難等[11]報道bFGF可誘導胚胎早期中胚層的生長,有促進口腔唇部軟組織創傷愈合的作用。IGF-I有多種生物學活性,包括促進細胞生長、分化及創口愈合等,有強烈的促進PDLFs分裂、增殖作用[12],其機制可能通過牙周膜表面的IGF型受體發揮作用[13]。本實驗表明,尼古丁使PDLFs分泌bFGF和IGF-I水平均下降,抑制了PDLFs分裂和增殖。
ICAM-1是免疫球蛋白超家族成員,調節炎癥信號轉導,在與白細胞結合和向炎癥區域轉移中具重要作用[14]。周衛輝等[15]報道尼古丁可增加內皮細胞ICAM-1表達,促進中性粒細胞與內皮細胞黏附,在慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)慢性炎癥發病中起重要作用。VCAM-1激活血管內皮細胞表達血管黏附分子,與單核細胞和淋巴細胞結合,從血管內壁移行至炎癥部位,促發炎癥。本實驗結果顯示尼古丁使PDLFs分泌ICAM-1和VCAM-1水平上升,提示尼古丁可能促進牙周炎癥發生。
TGF-β1能調節牙周組織的免疫應答,促進牙周膜細胞增殖,增加成纖維細胞合成膠原及纖維黏連素,減少基質金屬蛋白酶和纖溶酶激活劑的合成和結締組織的破壞,使牙周軟、硬組織修復再生[16]。炎癥刺激可使VEGF分泌增加,促進局部血流和自身分泌,促血管增殖。但吸煙者的牙周處于缺氧狀態,VEGF的高表達雖可促進血管生成,但正調節的VEGF mRNA及其蛋白又可募集破骨細胞,加速牙槽骨吸收[17]。本實驗顯示TGF-β1和VEGF濃度上升,有利于牙周組織修復。VEGF變化的意義尚需進一步研究。
綜上所述,尼古丁改變PDLFs細胞形態及超微結構,抑制細胞增殖,促進凋亡,影響其黏附功能;使PDLFs分泌bFGF和IGF-I水平下降,抑制PDLFs增殖;使ICAM-1和VCAM-1分泌增加,破壞牙周組織;而TGF-β1和VEGF等在炎癥刺激后分泌增加則有助于修復牙周組織。研究顯示VEGF存在雙重作用,在不同環境中表達水平有差異,其表達變化的意義尚待探討。
[1] Baek O,Zhu W,Kim C,et al.Effects of nicotine on the growth and protein expression of Porphyromonas gingivalis[J].J Microbiol,2012,50(1):143-148.
[2] Hanioka T,Ojima M,Tanaka K,et al.Relationship between smoking status and tooth loss:findings from national databases in Japan[J].J Epidemiol,2007,17(4):125-132.
[3] Kim SY,Kang KL,Lee JC,et al.Nicotinic acetylcholine receptor α7 and β4 subunits contribute nicotine-induced apoptosis in periodontal ligament stem cells[J].Mol Cells,2012,33(4):343-350.
[4] Malhotra R,Kapoor A,Grover V,et al.Nicotine and periodontal tissues [J].J Indian Soc Periodontol,2010,14(1):72-79.
[5] Hoffmann D,Adams JD.Carcinogenic tobacco-specific N-nitrosamines in snuff and in the saliva of snuff dippers[J].Cancer Res,1981,41(11 Pt 1):4305-4308.
[6] Chang YC,Hsieh YS,Lii CK,et al.Induction of c-fos expression by nicotine in human periodontal ligament fibroblasts is related to cellular thiol levels[J].J Periodontal Res,2003,38(1):44-50.
[7] 陳 瑗,周 玫.自由基醫學基礎與病理生理[M].第1版.北京:人民衛生出版社,2002:65-73.
[8] 伍協階,李 霞,唐西清,等.MMP-2在吸煙牙周炎患者牙齦組織中的表達[J].口腔醫學研究,2006,22(5):489-491.
[9] Kidoaki S,Matsuda T.Shape-engineered fibroblasts:cell elasticity and actin cytoskeletal features characterized by fluorescence and atomic force microscopy[J].J Biomed Mater Res A,2007,81(4):803-810.
[10]張韶君,梁益慧,楊丕山.堿性成纖維細胞生長因子對人牙周膜細胞生長的影響[J].上海口腔醫學,2001,10(2):135-137.
[11]杜克難.堿性成纖維細胞生長因子對小鼠口腔唇部創傷的促愈合作用[J].中國病理生理雜志,1993,9(2):244-247.
[12]吉建新,廖偉嬌,邱志輝,等.堿性成纖維細胞生長因子和胰島素樣生長因子-1對牙周膜細胞增殖的影響[J].廣東醫學,2001,26(5):606-608.
[13]羅云綱,劉曉秋,朱孝民,等.胰島素樣生長因子I對人牙周膜成纖維細胞增殖的影響[J].吉林大學學報:醫學版,2008,34(5):829-832.
[14]周曉慧,牛成偉,曹 凱,等.丹皮酚通過抑制NF-κB信號通路下調高脂血清誘導的人臍靜脈內皮細胞黏附分子的表達[J].中國病理生理雜志,2011,27(2):249-253.
[15]周衛輝,陳祥銀,余麗君,等.尼古丁對中性粒細胞活化及細胞間粘附分子基因表達的影響[J].中國病理生理雜志,2000,16(9):779-782.
[16]胡江天,余 兵,沈紹瑩,等.CTGF對人牙周膜成纖維細胞VEGF表達影響[J].昆明醫學院學報,2009,9(30):6-9.
[17]侯 超,唐開亮,楊丕山,等.乏氧對人牙周膜細胞HIF-1α及VEGF表達的影響[J].上海口腔醫學,2010,19(3):329-334.

