siRNA沉默WT1對小鼠足細胞Wnt/β-catenin和nephrin表達的影響*
周 靜, 袁偉杰△, 謝院生, 陳香美
流行病學調查顯示,與1988~1994年間相比,2005~2010年間美國慢性腎臟病(chronic kidney disease,CKD)的患病率由 12.3% 增加至 14.0%;與2009年相比,2010年末美國發生終末期腎臟病(endstage renal disease,ESRD)的患者年發生率增加了約4%[1]。蛋白尿是 CKD患者的常見臨床表現。其中,腎小球濾過屏障受損尤其是裂孔隔膜受損是蛋白尿發生的主要原因。Nephrin作為免疫球蛋白超家族的跨膜成分,是腎小球裂孔隔膜的重要組成部分。損傷性刺激如糖代謝紊亂等可抑制腎小球nephrin的表達并誘導蛋白尿的發生,而維持足細胞nephrin的正常表達則可阻斷糖尿病腎病的進展[2-3]。有證據表明,Wnt/β-catenin通路異常激活可誘導足細胞nephrin分子表達下調和蛋白尿的發生,阻斷該通路的表達則會減輕足細胞損傷[4]。新近研究發現,Wnt/β-catenin通路的表達變化主要由WT1的負調控作用所致[5]。因此,本研究旨在進一步探討WT1與Wnt/β-catenin通路在足細胞損傷中的作用及關系。
材料和方法
1 細胞
條件永生化小鼠足細胞是從H-2Kb-tsA58轉基因小鼠腎臟中分離后建立的細胞系,由美國Mount Sinai醫學院Mundel教授贈送。
2 主要試劑
RPMI-1640培養液(Gibco),胎牛血清(fetal bovine serum,FBS;Gibco),I型膠原蛋白(Sigma),小鼠重組干擾素 γ(interferon-γ,IFN-γ;PeproTech),JetPRIMETM轉染試劑 (Polyplus),兔抗小鼠單克隆WT1抗體(Abcam),siRNA靶序列和siRNA對照序列(上海吉瑪),羊抗小鼠多克隆nephrin抗體(RD),兔抗小鼠單克隆Wnt1抗體(嘉美生物),小鼠抗人多克隆β-catenin抗體 (Santa Cruz),兔抗小鼠單克隆 p-βcatenin抗體 (Cell Signaling),辣根過氧化物酶標記的山羊抗兔IgG、山羊抗小鼠IgG和驢抗山羊IgG(上海碧云天生物技術有限公司),Trizol試劑(Invitrogen)。
3 主要方法
3.1 足細胞培養 足細胞培養方法參照文獻[6]。用含10%FBS的RPMI-1640培養基(添加小鼠重組IFN-γ)33℃條件下傳代培養足細胞,以含10%FBS的RPMI-1640培養基(不含IFN-γ)在37℃條件下誘導足細胞分化。
3.2 足細胞轉染及分組 轉染WT1 siRNA:將足細胞接種于25 cm2的培養瓶中,當細胞融合度達到50%~60%時進行轉染。足細胞分成以下3組:未轉染組:未經任何處理的足細胞;陰性對照組:轉染negative control組;轉染組:轉染WT1 siRNA組。利用JetPRIMETM進行轉染。轉染方法參照JetPRIMETM轉染試劑的說明書。轉染24 h及48 h后,分別采用real-time qRT-PCR和Western blotting法檢測WT1 mRNA和蛋白的表達情況,從而明確WT1 siRNA的轉染效率。陰性對照序列:正義鏈 5'-UUCUCCGAACGUGUCACGUTT-3',反 義 鏈 5'-ACGUGACACGUUCGGAGAATT-3';WT1 siRNA的序列:正義鏈 5'-CUACAGCAGUGACAAUUUATT-3',反義鏈 5'-UAAAUUGUCACUGCUGUAGTT-3',均由上海吉瑪公司負責合成。
3.3 Real-time qRT-PCR 用Trizol試劑(Invitrogen)抽提細胞總RNA,用逆轉錄試劑盒(Promega)進行逆轉錄反應合成cDNA,以此cDNA為模板,進行擴增。采用熒光染料法,按照說明書進行操作,以GAPDH為內參照。引物設計參照GenBank中的mRNA序列,由北京賽百盛基因技術有限公司合成見表1。采用ΔΔCt法進行相對定量。
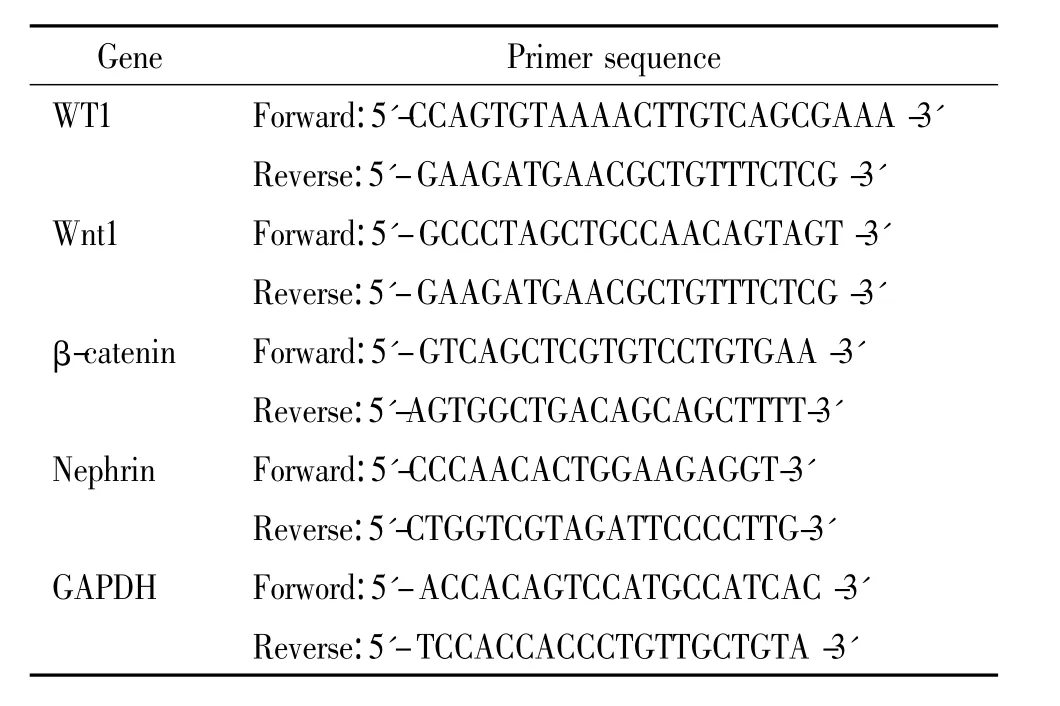
表1 引物序列Table 1.Sequences of the primers
3.4 Western blotting RIPA裂解液裂解細胞,4℃12 000×g離心30 min,提取細胞總蛋白。BCA試劑盒測定蛋白濃度,每組取60 μg蛋白上樣于10%SDS-PAGE電泳分離,電轉至PVDF膜,1×casein封閉約 1 h,分別加入 I抗(WT1、Wnt1、β-catenin、p-βcatenin及nephrin),4℃過夜。辣根過氧化物酶標記的II抗37℃孵育1 h。利用UVP化學熒光成像系統(ChemiDoc-ItTM600 Imaging System)進行化學發光顯影,以β-actin作為內參校正。
3.5 MTT檢測細胞活力 收集對數生長期細胞,按4 400 cells/well接種于96孔板,各組干預方法同上述實驗。培養板充分吸盡上清后,每孔加入10 μL MTT溶液,繼續培養4 h后終止培養。每孔加入100 μL二甲基亞砜,置搖床上低溫振蕩10 min,酶標儀測量各孔A490。
4 統計學處理
計量資料采用均數±標準差(mean±SD)表示,組間比較采用單因素方差分析。采用 SPSS 13.0統計軟件進行統計學處理,以P<0.05為差異有統計學意義。
結 果
1 WT1 siRNA轉染足細胞的效率
轉染12 h后,與未轉染組和對照組細胞相比,siRNA沉默WT1基因組細胞內mRNA水平顯著下降(P<0.05),轉染陰性對照組和未轉染組的胞內WT1 mRNA的水平無顯著差異。與未轉染組細胞相比,WT1 mRNA 下降了約 69.6%(P <0.05),見圖 1;轉染24 h后,siRNA沉默WT1基因組細胞內WT1蛋白表達水平與未轉染組和陰性對照組相比顯著下降(P<0.05),轉染陰性對照組和未轉染組的胞內WT1蛋白表達水平無明顯差異。與未轉染組細胞相比,轉染組細胞WT1蛋白的表達水平下降了約61%(P<0.05),見圖 1、2。
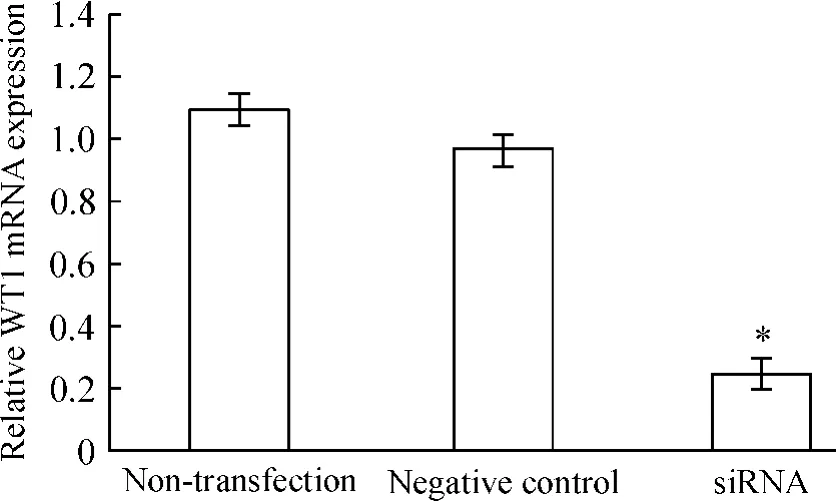
Figure 1.Effect of RNA interference on WT1 mRNA expression detected by real-time qRT-PCR.Mean±SD.n=3.*P <0.05 vs non-transfection.圖1 轉染siRNA對WT1 mRNA表達的影響
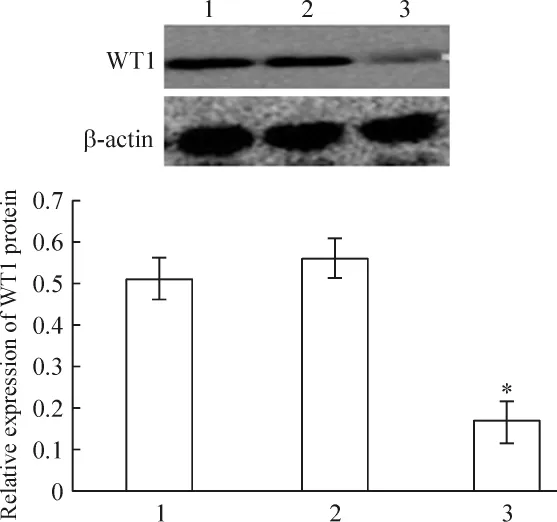
Figure 2.Effect of RNA interference on WT1 protein expression detected by Western blotting.1:non-transfection;2:negative control;3:siRNA transfection.Mean±SD.n=3.*P <0.05 vs 1.圖2 轉染siRNA對WT1蛋白表達的影響
2 siRNA沉默對胞內Wnt1水平的影響
未轉染組、陰性對照組和siRNA轉染組的小鼠足細胞轉染36 h后,Wnt1 mRNA表達水平較未轉染組細胞有顯著增加(P<0.05);轉染48 h后,Wnt1蛋白表達水平較未轉染組細胞有顯著增多(P<0.05),見圖3、4。

Figure 3.Effect of RNA interference on Wnt1 mRNA expression detected by real-time qRT-PCR.Mean±SD.n=3.*P <0.05 vs non-transfection.圖3 WT1沉默對足細胞Wnt1 mRNA水平的影響
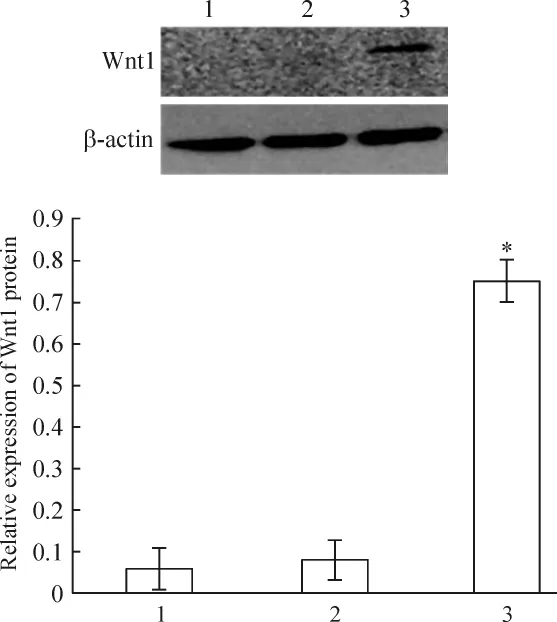
Figure 4.Effect of RNA interference on Wnt1 protein expression detected by Western blotting.1:non-transfection;2:negative control;3:siRNA transfection.Mean±SD.n=3.*P <0.05 vs 1.圖4 WT1沉默對Wnt1蛋白水平的影響
3 siRNA沉默WT1基因對胞內β-catenin水平的影響
未轉染組、陰性對照組和siRNA轉染組的小鼠足細胞轉染36 h后,β-catenin mRNA表達水平無明顯改變;轉染48 h后,p-β-catenin蛋白的表達水平較未轉染組細胞有顯著下降(P<0.05),見圖5~7。
4 siRNA沉默對足細胞活力的影響
siRNA沉默WT1基因的小鼠足細胞在轉染24 h后,siRNA轉染組與未轉染組相比,細胞活力無明顯變化;在轉染48 h后,與未轉染組細胞相比,轉染組細胞活力明顯下降(P<0.05),見表2。
5 WT1沉默對小鼠足細胞nephrin mRNA的影響
siRNA沉默WT1基因的小鼠足細胞在轉染36 h后,nephrin mRNA表達水平較未轉染組細胞有顯著下降(P <0.05),見圖8。
6 WT1沉默對nephrin蛋白水平的影響
siRNA沉默WT1基因的小鼠足細胞在轉染48 h后,nephrin蛋白表達水平較未轉染組細胞有顯著下降(P <0.05),見圖9。
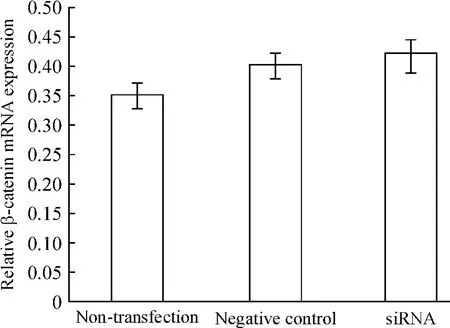
Figure 5.Effect of RNA interference on β-catenin mRNA expression detected by real-time qRT-PCR.Mean±SD.n=3.圖5 WT1沉默對足細胞β-catenin mRNA水平的影響
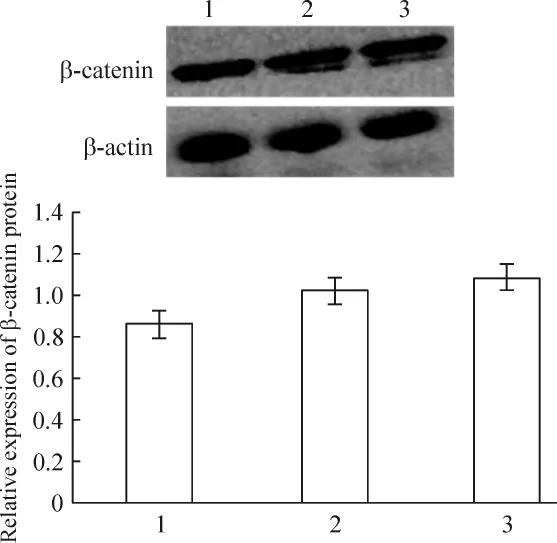
Figure 6.Effect of RNA interference on β-catenin protein expression detected by Western blotting.1:non-transfection;2:negative control;3:siRNA transfection.Mean±SD.n=3.圖6 WT1沉默對足細胞β-catenin蛋白水平的影響
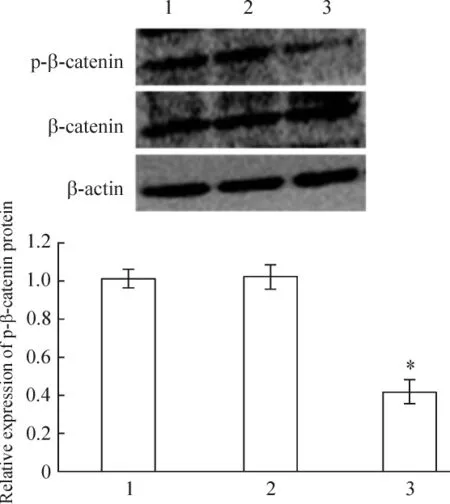
Figure 7.Effect of RNA interference on p-β-catenin protein expression detected by Western blotting.1:non-transfection;2:negative control;3:siRNA transfection.Mean±SD.n=3.*P <0.05 vs 1.圖7 WT1沉默對足細胞p-β-catenin蛋白水平的影響
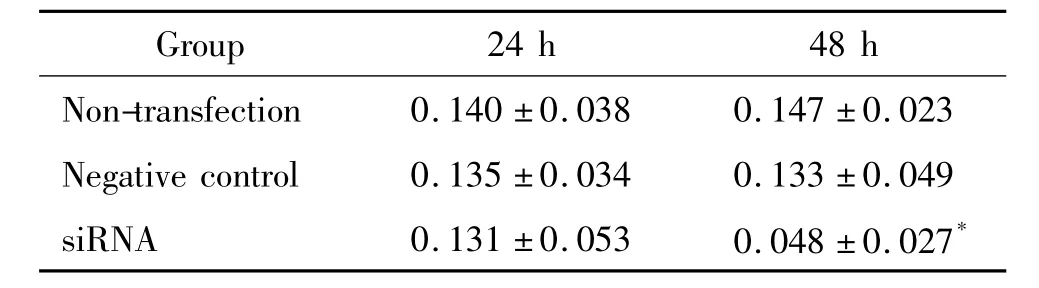
表2 MTT法檢測WT1沉默后足細胞的活力Table 2.Effects of WT1 siRNA on podocyte vitality detected by MTT assay(mean±SD.n=3)
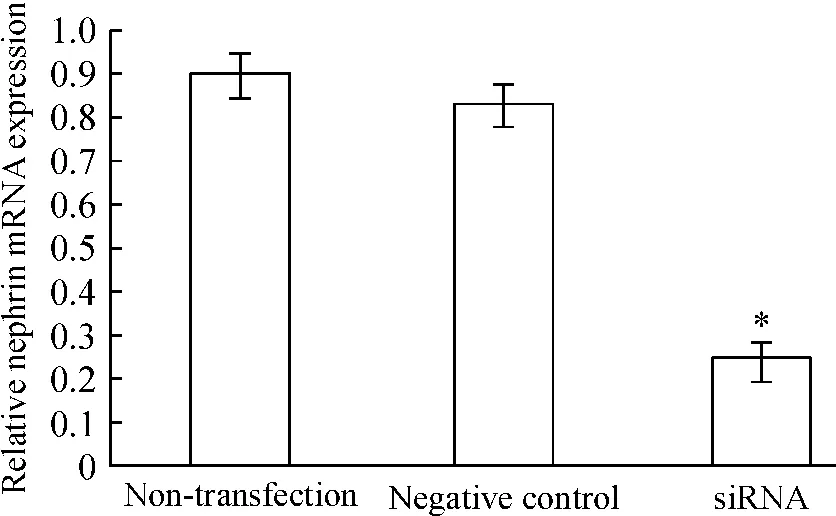
Figure 8.Effect of RNA interference on nephrin mRNA expression in mouse podocytes detected by real-time qRTPCR.Mean±SD.n=3.*P <0.05 vs non-transfection.圖8 WT1沉默對足細胞nephrin mRNA水平的影響
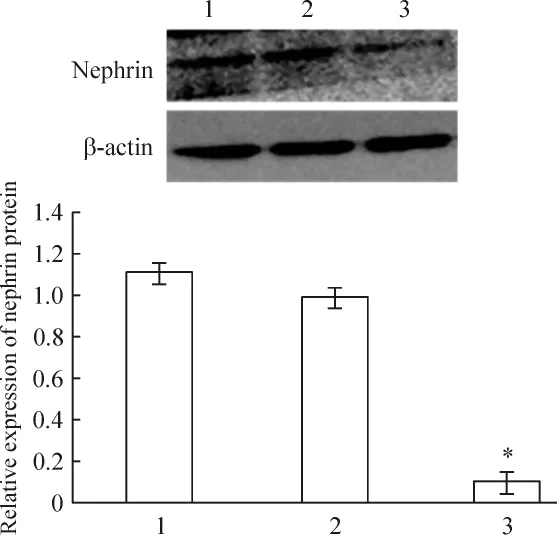
Figure 9.Effect of RNA interference on nephrin protein expression detected by Western blotting.1:non-transfection;2:negative control;3:siRNA transfection.Mean±SD.n=3.*P <0.05 vs 1.圖9 WT1沉默對足細胞nephrin蛋白水平的影響
討 論
足細胞受損是慢性腎臟病發生發展的主要原因,其損傷程度可作為判斷慢性腎臟病預后的重要指標。由于對其損傷機制研究的有限性,我們目前對于足細胞的靶向治療仍處于探索階段。現今臨床常用治療方案并不能阻止腎臟疾病的進展。因此,闡明足細胞損傷修復的分子機制具有重要的臨床意義和實用價值。
WT1基因是一種具有雙重作用的轉錄調控因子,除參與腫瘤的發生外,其在足細胞發生發育及足細胞功能的維持上發揮重要作用[7]。研究發現,WT1可通過負調控Wnt/β-catenin通路的表達發揮其病理生理作用[5]。Wnt/β-catenin通路作為一條比較保守的信號通路可參與腫瘤的發生[8]。近年來,其慢性腎臟病發生發展中的作用逐漸被人們所認識。有證據表明,在糖尿病腎病或局灶階段性腎小球硬化的患者足細胞中可見Wnt1和β-catenin的高表達,異常升高的Wnt1或β-catenin可抑制nephrin的表達誘導足細胞損傷[9-10]。本研究結果顯示,在沉默WT1的表達后,足細胞內Wnt1分子表達明顯上調,提示Wnt/β-catenin通路可能處于激活狀態。
既往人們對腎母細胞瘤的研究中發現,WT1基因突變常伴有β-catenin在胞核內的大量蓄積[11]。β-catenin作為Wnt/β-catenin通路的關鍵調控因子,其表達水平主要受胞漿內破壞復合體(destruction complex)的調控。當Wnt/β-catenin通路處于激活狀態時,破壞復合體解離,β-catenin可在胞漿內大量蓄積,啟動下游基因的表達[12]。研究發現,β-catenin在正常足細胞結構與功能維持中發揮的作用較小,但其在介導阿霉素誘導小鼠足細胞損傷過程中至關重要[13]。在本實驗中,與未轉染組細胞相比,siRNA干擾組細胞內 β-catenin水平無明顯變化,而 p-βcatenin水平降低,提示β-catenin的降解減少并在胞漿內積聚并進入細胞核調控下游基因的表達,這一發現進一步說明了足細胞內Wnt/β-catenin信號通路在siRNA沉默WT1基因表達后處于激活狀態。為明確足細胞損傷程度,我們進一步檢測了足細胞活力與裂孔隔膜相關分子nephrin的表達水平變化,結果表明,與未轉染組細胞相比,轉染組細胞活力明顯下降;同時,其足細胞內nephrin mRNA和蛋白的表達水平均明顯下調。如前文所述,Wnt/β-catenin通路激活后可誘導腫瘤細胞增殖,但本研究并未發現足細胞增殖能力增強,可能與分化成熟的足細胞分裂增生能力有限或足細胞內nephrin分子表達下調后其結構或功能受損所致。因此,我們可以推測,轉錄因子WT1可通過負調控Wnt/β-catenin通路的表達誘導足細胞損傷。
綜上所述,通過siRNA沉默WT1基因的表達后會使其對Wnt/β-catenin通路的抑制作用減弱,誘導處于靜息狀態的Wnt/β-catenin通路異常激活從而導致足細胞損傷及裂孔隔膜分子nephrin的表達下降。這一發現為慢性腎臟病的早期診斷和治療開辟了新思路,同時也為新藥研發或有效信號轉導分子的干預研究提供了理論依據。
[1] US Renal Data System,USRDS 2012 Annual Data Report:Atlas of Chronic Kidney Disease and End-Stage Renal Disease in the United States,National Institutes of Health,National Institute of Diabetes and Digestive and Kidney Diseases,Bethesda,MD,2012.
[2] 覃喬靜,鄧華聰,曹文富.糖尿病腎病腎小球nephrin表達的變化[J].中國病理生理雜志,2007,23(2):391-392.
[3] 李志杰,張 悅,劉煜敏,等.黃芪多糖對早期糖尿病腎病大鼠足細胞nephrin和podocin表達的影響[J].中國病理生理雜志,2011,27(9):1772-1776.
[4] He W,Kang YS,Dai C,et al.Blockade of Wnt/β-catenin signaling by paricalcitol ameliorates proteinuria and kidney injury[J].J Am Soc Nephrol,2011,22(1):90-103.
[5] Kim MS,Yoon SK,Bollig F,et al.A novel Wilms tumor 1(WT1)target gene negatively regulates the WNT signa-ling pathway[J].J Biol Chem,2010,285(19):14585-14593.
[6] Mundel P,Reiser J,Zú~niga MeJ'ia Borja A,et al.Rearrangements of the cytoskeleton and cell contacts induce process formation during differention of conditionally immortalized mouse podocytes cell lines[J].Exp Cell Res,1997,236(1):248-258.
[7] Kreidberg JA.Podocyte differention and glomerulogenesis[J].J Am Soc Nephrol,2003,14(3):806-814.
[8] 李海英,張 力,潘歡樂,等.Wnt信號通路在食管癌細胞放射抗拒性形成中的作用[J].中國病理生理雜志,2012,28(9):1623-1626.
[9] Wang D,Dai C,Li Y,et al.Canonical Wnt/β-catenin signaling mediates transforming growth factor-β1-driven podocyte injury and proteinuria[J].Kidney Int,2011,80(11):1159-1169.
[10] Dai C,Stolz DB,Kiss LP,et al.Wnt/β-catenin signaling promotes podocyte dysfunction and albuminuria [J].J Am Soc Nephrol,2009,20(9):1997-2008.
[11] Maiti S,Alam R,Amos CI,et al.Frequent association of β-catenin and WT1 mutations in Wilms tumors[J].Cancer Res,2000,60(22):6288-6292.
[12] Willert K,Jones KA.Wnt signaling:is the party in the nucleus?[J].Genes Dev,2006,20(11):1394-1404.
[13] Heikkila E,Juhila J,Lassila M,et al.β-catenin mediates adriamycin-induced albuminuria and podocyte injury in the adult mouse kidneys[J].Nephrol Dial Transplant,2010,25(8):2437-2446.

