組織因子途徑抑制物2在胃間質瘤組織中的表達及臨床意義
鄧蓓蓓,王貴軍,王玉彬,李迪諾,李 諶
1遼寧醫學院附屬第一醫院 婦科,遼寧錦州 121001;2遼寧醫學院附屬第一醫院 普外科,遼寧錦州 121001;3遼寧醫學院附屬第一醫院 遼寧省醫學組織工程重點實驗室,遼寧錦州 121001
胃腸道間質瘤(gastrointestinal stromal tumors,GISTs)是胃腸道最常見的間葉源性腫瘤,占胃腸道腫瘤1%~4%,近十年來,無論是基礎研究還是臨床治療領域,對其臨床特點、病理改變、免疫表型、遺傳學特征已清晰。然而在腫瘤的發病機制、生物學行為預測、藥物治療等方面還有許多問題尚待解決[1],如何控制腫瘤的侵襲與轉移仍是其治療面臨的主要問題[2-3]。組織因子途徑抑制物 2(tissue factor pathway inhibitor-2,TFPI-2)在多種腫瘤中表達下調,與腫瘤的侵襲及轉移有關[4-5]。我們采用免疫組織化學、RT-PCR和Western blot方法檢測胃間質瘤組織中TFPI-2的表達,探討其與胃間質瘤侵襲轉移的關系,以期為治療胃間質瘤及改善其預后提供新思路。
材料和方法
1 標本收集 收集我院2006年1月-2012年4月手術切除的新鮮胃間質瘤標本72例,男35例,女37例,年齡33~78歲,中位年齡56.4歲;腫瘤侵襲臨近器官或組織,或有遠處轉移者20例,無侵襲轉移者52例。取材在手術標本離體30 min內進行,每例均取腫瘤中心處非壞死瘤組織、腫瘤旁組織和正常組織,標本立即置于-80 ℃冰箱保存。胃間質瘤診斷標準:常規形態符合GISTs診斷要點,免疫組織化學CD117陽性;或常規形態符合GISTs診斷要點,CD117陰性而CD34陽性;或常規形態符合GISTs診斷要點,CD117、CD34陰性,并且平滑肌肌動蛋白(smooth muscle actin,SMA)、結蛋白(desmin)、神經脊突細胞抗原(S-100)蛋白也均陰性,排除平滑肌源性和神經源性腫瘤。依據Fletcher等[6]提出的GISTs生物學行為分級標準進行分級(NIH分級):腫瘤直徑<2 cm和核分裂相<5/50 HPF為極低度侵襲危險性(Ⅰ級);腫瘤直徑2~5 cm和核分裂相<5/50 HPF為低度侵襲危險性(Ⅱ級);腫瘤直徑5~10 cm和核分裂相<5/50 HPF或腫瘤<5cm和核分裂相6~10/50 HPF為中度侵襲危險性(Ⅲ級);腫瘤直徑>5 cm和核分裂相>5/50 HPF或腫瘤>10 cm或核分裂相>10/50 HPF為高度侵襲危險性(Ⅳ級)。本實驗經醫院倫理委員會同意。
2 免疫組化測定 將收集的組織石蠟包埋制成4 μm厚的切片,免疫組化染色步驟按試劑盒(sp0023,北京博奧森生物技術有限公司)說明書進行。TFPI-2一抗(北京博奧森生物技術有限公司)稀釋比例為1∶400。免疫組化著色強度評分:0分為無;1分為弱;2分為強。陽性細胞評分按百分率遞增:0分為<5%;1分為≥5%,<10%;2分為≥10%,<30%;3分為≥30%,<50%;4分為≥50%。著色強度計分與陽性細胞率計分之乘積為該病例評分值,評分值≤2分為陰性;≥3分為陽性。
3 RT-PCR測定 取每部位組織200 mg,提取總RNA。取2 μg總RNA,采用一步(One Step)RT-PCR法,根據試劑盒(大連寶生物工程有限公司)說明操作,TFPI-2和β-actin的上、下游引物均由上海生工生物工程有限公司合成,人類TFPI-2的PCR上、下游引物分別為5'-TCTGCCAATGTGACTCGC TAT-3'和 5'-TATTGTCATTCCCTCCACAGC-3',合成產物為88bp,β-actin的上、下游引物分別為5'-CTGGGACGACATGGAGAAAA-3'和5'-AAGGAAGG CTGGAAGAGTGC-3',合成產物為216bp。按下述條件進行循環:50 ℃反轉錄30 min,94 ℃2 min滅活逆轉錄酶,然后進行30個周期的PCR擴增反應,每個周期為94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸1 min。TFPI-2和β-actin的反應條件相同。PCR擴增產物在含有溴化乙錠的2%瓊脂糖凝膠上電泳,紫外燈下照相并保存。
4 Western blot測定 取200 mg組織塊置于勻漿器中球狀部位,用剪刀將組織塊盡量剪碎。加400 μl裂解液,裂解30 min后在4 ℃下12 000 r/min離心5 min,取上清測蛋白濃度后分裝于0.5 ml離心管中,樣品中加入緩沖液于沸水中煮5 min使蛋白變性。SDS-PAGE凝膠電泳,濃縮膠80 V,分離膠150 V,將凝膠中的蛋白用濕轉法轉印至0.45 μm的PVDF膜上。轉膜結束后,將膜置于5%脫脂奶粉中封閉1 h,然后分別加入兔抗人的TFPI-2和β-actin抗體,置于4 ℃冰箱搖床孵育過夜。洗膜后,加入辣根過氧化物酶標記的二抗1∶1 000,于室溫孵育60 min,洗膜后放入暗盒顯色。
5 統計學分析 應用SPSS16.0軟件進行統計分析,計量數據以表示,兩樣本間均數比較采用t檢驗,多組比較采用單因素方差分析,計數數據比較采用χ2檢驗,以P<0.05為差異有統計學意義。
結 果
1 免疫組化測定 陽性反應為棕黃色顆粒,主要位于胞漿。TFPI-2蛋白在正常組織、瘤旁組織及瘤中心處組織中均有表達,但在正常組織中的表達要強于瘤旁組織及瘤中心處組織,瘤旁組織中的表達亦強于瘤中心處組織(圖1)。瘤組織中TFPI-2的陰性表達率在性別和年齡上無統計學差異,在腫瘤有無侵襲轉移上存在統計學差異(P<0.05),見表1。
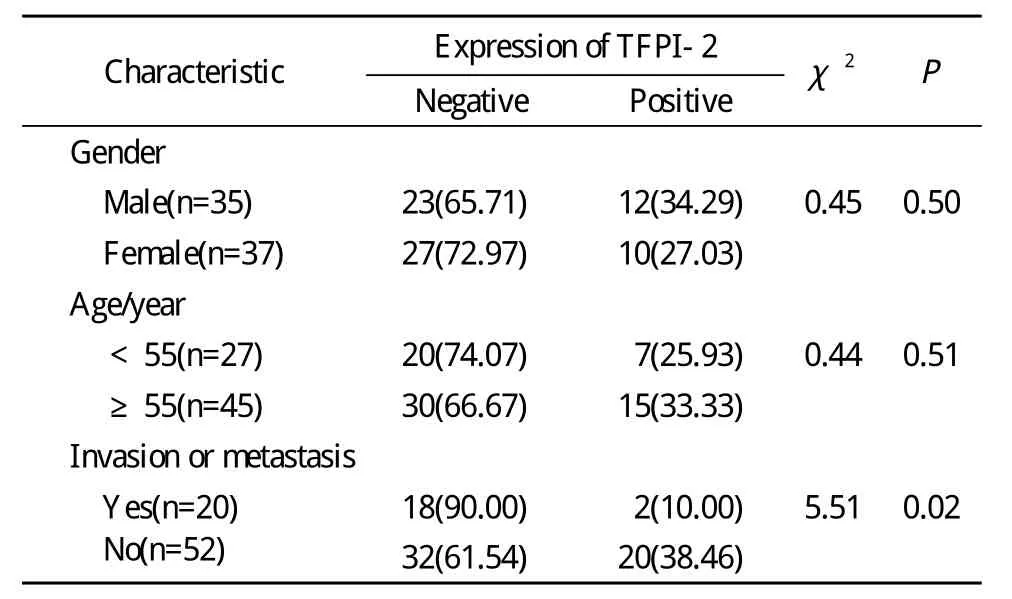
表1 TFPI-2蛋白表達與性別、年齡、腫瘤侵襲轉移的關系Tab.1 Relation of TFPI-2 protein expression with gender and age of patients, tumor invasion and metastasis(n, %)
2 RT-PCR測定 TFPI-2 mRNA在正常組織及瘤旁組織中高表達,在瘤中心組織中低表達(P<0.01,圖2,表2)。在瘤組織中的表達水平隨NIH分級增高而下調(P<0.01)。TFPI-2 mRNA表達在性別和年齡上無統計學差異,在腫瘤有無侵襲轉移上存在統計學差異(P<0.05),見表3。
3 Western blot測定 TFPI-2蛋白在正常組織及瘤旁組織中高表達,在瘤中心組織中低表達(P<0.01,圖3,表2)。在瘤組織中的表達水平隨NIH分級增高而下調(P<0.01)。TFPI-2蛋白表達在性別和年齡上無統計學差異,在腫瘤有無侵襲轉移上存在統計學差異(P<0.05),見表3。

表2 TFPI-2在不同部位的表達情況Tab.2 TFPI-2 mRNA and protein expression in different tissues
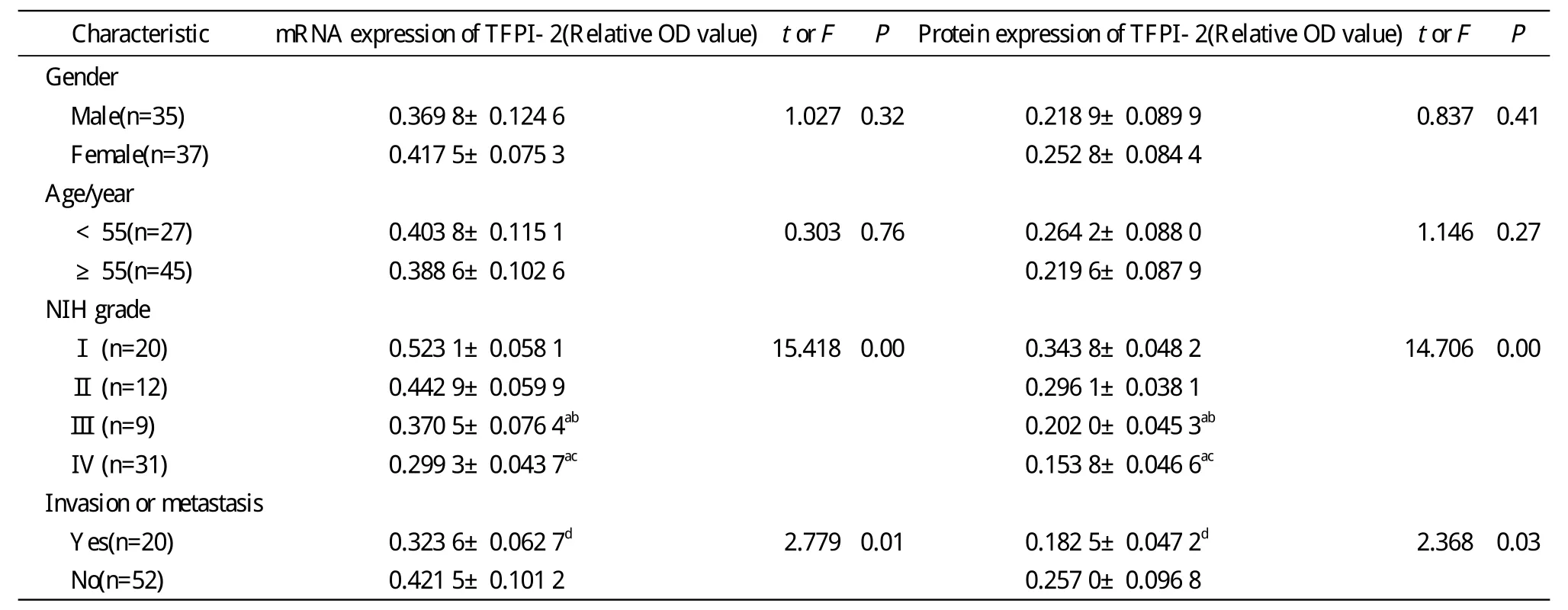
表3 瘤組織TFPI-2的表達與臨床病理特征的關系Tab.3 Relationship between TFPI-2 expression and clinicopathologic characteristics of gastric stromal tumor

圖1 TFPI-2蛋白在瘤組織、瘤旁組織和正常組織中的表達(×400) A:正常組織; B:瘤旁組織; C:瘤組織Fig.1 TFPI-2 protein expression in normal gastric tissue (A), adjacent stromal tumor tissue (B) and stromal tumor tissue (C) (×400)
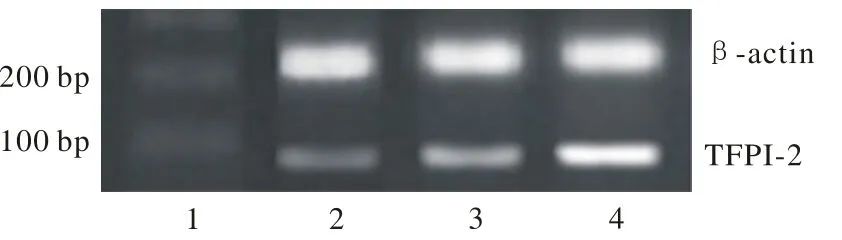
圖2 TFPI-2 mRNA在瘤組織、瘤旁組織和正常組織中的表達1: Marker; 2:瘤組織; 3: 瘤旁組織; 4: 正常組織Fig.2 TFPI-2 mRNA expression in tumor tissue, its adjacent tissue and normal tissue 1: Marker; 2:Tumor tissue; 3: Adjacent tumor tissue; 4: Normal tissue

圖3 TFPI-2蛋白在瘤組織、瘤旁組織和正常組織中的表達1: 瘤組織; 2: 瘤旁組織; 3: 正常組織Fig.3 Protein expression of TFPI-2 at center and periphery of tumor and at nearby normal tissue 1: Tumor tissue; 2: Adjacent tumor tissue;3: Normal tissue
討 論
局限性GIST的生物學行為目前主要依據腫瘤大小和核分裂象數評估其惡性危險程度,本研究采用Fletcher等提出的按危險程度分為極低、低、中和高4級分類方案。研究發現,TFPI-2不但在瘤組織、瘤旁組織和正常組織中表達有差異,在不同級別中的表達也存在統計學差異。另外,我們發現在腫瘤有無侵襲或轉移上,TFPI-2的表達也存在差異,腫瘤有侵襲或轉移者,TFPI-2的表達明顯下降。
TFPI-2是絲氨酸蛋白酶抑制物,能有效抑制基質金屬蛋白酶、纖溶酶、胰蛋白酶、糜蛋白酶、組織蛋白酶等多種蛋白水解酶的活性,已有實驗證實,TFPI-2能抑制神經膠質瘤[7]、肺癌[8]、前列腺癌[9]、喉癌[10]、胰腺癌[11]等細胞的生長、侵襲和轉移。
本研究結果表明,TFPI-2的表達在腫瘤組織及瘤旁組織中受到抑制,這一變化表明細胞外基質的穩定性可能因TFPI-2的抑制而降低。胃間質瘤中心組織TFPI-2的表達水平隨著NIH分級升高而下調,并且TFPI-2表達在腫瘤有無侵襲轉移上存在統計學差異,提示TFPI-2低表達可能促進胃間質瘤的生長、浸潤及轉移,導致預后不良。其可能的機理是,TFPI-2基因表達產物TFPI-2蛋白抑制多種蛋白水解酶的活性,降低蛋白水解酶對細胞外基質的破壞,而各種腫瘤細胞分泌的蛋白水解酶所參與的細胞外基質的降解正是腫瘤發生侵襲和轉移的關鍵步驟。另有研究[12]表明,TFPI-2基因表達對絨癌細胞的生長抑制可通過誘導細胞凋亡來實現,在胃間質瘤是否也是如此還需進一步實驗證實。
綜上所述,TFPI-2基因可能在胃間質瘤侵襲和轉移過程中起重要作用,這為我們提供新的思路來判斷胃間質瘤的惡性程度、預測轉移及評估胃間質瘤患者的預后,相信隨著研究的不斷深入、廣泛,TFPI-2在胃間質瘤的預防、診斷及基因治療中將會有更美好的前景。
1 陳貴榮.胃腸道間質瘤研究新進展[J].醫學綜述,2010,16(14):2152-2155.
2 魏志剛,韓超,李健丁.胃腸道間質瘤的診斷治療[J].世界華人消化雜志,2010,18(1):65-69.
3 師英強.復發轉移性胃腸間質瘤外科治療臨床價值[J].中國實用外科雜志,2010,30(4):257-259.
4 Nobeyama Y, Okochi-Takada E, Furuta J, et al. Silencing of tissue factor pathway inhibitor-2 gene in malignant melanomas[J]. Int J Cancer, 2007, 121(2): 301-307.
5 Yanamandra N, Kondraganti S, Gondi CS, et al. Recombinant adeno-associated virus (rAAV) expressing TFPI-2 inhibits invasion,angiogenesis and tumor growth in a human glioblastoma cell line[J].Int J Cancer, 2005, 115(6): 998-1005.
6 Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach[J]. Int J Surg Pathol, 2002, 33(5): 459-465.
7 Gessler F, Voss V, Seifert V, et al. Knockdown of TFPI-2 promotes migration and invasion of glioma cells[J]. Neurosci Lett, 2011,497(1): 49-54.
8 Gaud G, Iochmann S, Guillon-Munos A, et al. TFPI-2 silencing increases tumour progression and promotes metalloproteinase 1 and 3 induction through tumour-stromal cell interactions[J]. J Cell Mol Med, 2011, 15(2): 196-208.
9 Ma S, Chan YP, Kwan PS, et al. MicroRNA-616 induces androgenindependent growth of prostate Cancer cells by suppressing expression of tissue factor pathway inhibitor TFPI-2[J]. Cancer Res, 2011,71(2): 583-592.
10 孫亞男,劉鳴,金德均,等.TFPI-2基因表達變化與聲門上喉癌侵襲轉移及預后的相關性研究[J].腫瘤,2008,28(1):40-43.
11 Tang Z, Geng G, Huang Q, et al. Expression of tissue factor pathway inhibitor 2 in human pancreatic carcinoma and its effect on tumor growth, invasion, and migration in vitro and in vivo[J]. J Surg Res, 2011, 167(1): 62-69.
12 Zhou Q, Xiong Y, Chen Y, et al. Effects of tissue factor pathway inhibitor-2 expression on biological behavior of BeWo and JEG-3 cell lines[J]. Clin Appl Thromb Hemost, 2012, 18(5): 526-533.

