比較血沉、C反應蛋白、術中冰凍切片單獨及聯合診斷髖關節假體感染的效率
楊 瑞,陳繼營,恩 和,張 玄,李 恒,楊云建
解放軍總醫院 骨科,北京 100853
全髖關節置換(total hip arthroplasty,THA)現已成為治療各種終末期髖關節疾病的首選治療手段。然而髖關節置換術后感染依然是導致人工髖關節失敗的主要原因之一。全髖關節置換術后感染的發生率介于0.5%~1.0%[1-3]。血沉(erythrocyte sedimentation rate,ESR)、C 反應蛋白 (C reative protein,CRP)及術中冰凍是目前臨床上診斷全髖關節置換術后假體周圍感染的常規方法,但將三者聯合起來的診斷價值尚無文獻報道。本研究對116例124髖關節翻修進行回顧性分析,評價ESR、CRP、術中冰凍切片及3項聯合對人工髖關節感染的診斷價值。
資料和方法
1 資料 回顧我科2010年收治的髖關節翻修病例共116例124髖,男65例,女51例,平均年齡57.6(22~82)歲。初次置換的主要原因是股骨頭缺血性壞死和股骨頸骨折等(表1)。假體平均壽命8年3個月(6月~28年)。診斷假體感染的“金標準”[4-6]:符合下述條件之一即可診斷為感染:1)與關節腔相通的竇道形成;2)術中見假體周圍大量膿液;3)術前至少兩個標本培養為同一細菌者;4)局部明顯的感染癥狀,應用抗生素有效。病例排除標準:1)初次人工髖關節置換診斷為類風濕關節炎、強直性脊柱炎、髖部骨腫瘤;2)身體其他部位存在惡性腫瘤影響結果的;3)資料不全不利于研究的。
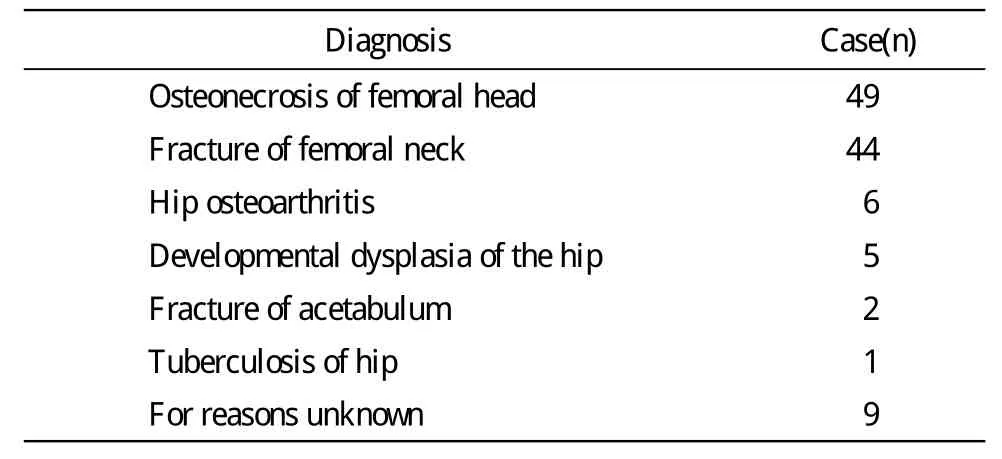
表1 116例初次行人工髖關節置換診斷Tab.1 Diagnosis of 116 patients with hip periprosthetic infection after first total hip arthroplasty
2 血沉、C反應蛋白、術中冰凍切片陽性診斷標準血沉>30 mm/h,C反應蛋白>10 mg/L,術中冰凍切片每高倍鏡視野(per high-power field,HPF×400)>10個多形核白細胞(polgmorpho nuckear leukocytes,PMN)[2,7]。3項中任意2項陽性即診斷為感染,任意2項陰性即診斷為無菌性松動[7]。
3 統計學方法 采用SPSS18.0統計軟件進行統計學分析,3項檢查方法聯合應用時的診斷結果分別與單項檢查的診斷結果進行配對設計χ2檢驗,P<0.05為差異有統計學意義。
結 果
1 三種方法單獨與聯合檢測比較 根據“金標準”,116例124髖中71例72髖被診斷為假體感染,45例52髖診斷為假體無菌性松動。聯合檢測診斷分別與ESR、CRP、術中冰凍切片診斷比較,差異有統計學意義,見表2。
2 檢測效率比較 ESR的靈敏性、特異性及準確性分別為76.39%、82.69%、79.03%;CRP的敏感性、特異性及準確性分別為81.94%、92.31%、86.29%;術中冰凍切片的敏感性、特異性及準確性分別為87.5%、94.23%、90.32%;3項聯合的敏感性、特異性及準確性分別為97.22%、98.07%、97.58%。
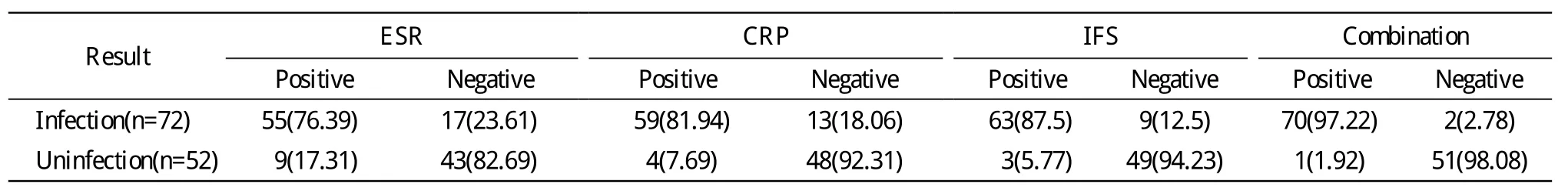
表2 3種方法單獨檢測與聯合檢測比較Tab.2 Diagnosis rate of ESR, CRP, intra-operative frozen section and their combination for hip periprosthetic infection(n, %)
討 論
感染和無菌性松動是導致人工髖關節失敗的兩大主要原因[8]。全髖關節置換術后感染,治療常需要二期手術和長期使用抗生素。而無菌性松動則通常一期翻修手術就能獲得成功。在治療方案上的巨大差異使得如何將假體感染從無菌性松動及其他導致人工髖關節失敗的原因中區別開來顯得尤為重要。在臨床中,有相當一部分髖關節置換術感染的病人其癥狀并不明顯,往往僅表現出長期的輕度髖部不適或疼痛,毫無特異性。尤其是一些慢性低毒性細菌感染的診斷更加困難。
血沉(紅細胞沉降率)快慢主要受紅細胞自身的大小、形狀以及血漿的成分、血流狀態的影響。CRP是肝細胞產生的一種急性期蛋白,正常狀態下微量存在于人血清中。炎癥、腫瘤、急性期結締組織疾病都會影響血沉和CRP,因而用血沉或CRP診斷人工髖關節感染,會出現假陽性結果。因而本研究將初次人工全髖關節置換診斷為類風濕性關節炎、強直性脊柱炎、髖部腫瘤及身體其他部位存在惡性腫瘤的疾病排除在外以提高本研究的準確性。本研究中血沉、CRP的敏感性分別為76.39%、81.94%;特異性分別為82.69%、92.31%;準確性分別為79.03%、86.29%。Spangehl等[9]對202個翻修的髖關節進行研究,將ESR>30 mm/h定位標準時,敏感性為82%,特異性為85%;CRP>10 mg/L定為標準,其敏感性為86%、特異性為92%。Toms等[10]報道CRP>10 mg/L時提示感染,其診斷敏感性為96%,特異性為92%;ESR>30 mm/L提示有感染,其診斷敏感性為82%,特異性為85%;并指出如果ESR和CRP均升高,則感染的可能性為83%,均陰性則排除感染。Costa等通過一個前瞻性研究[11]指出ESR的敏感性為89%,特異性為69%;CRP的敏感性為93%,特異性僅為40%。以上各研究結果可見依靠血沉和C反應蛋白對人工全髖關節的診斷具有一定價值,但存在較大差異,容易造成誤診和漏診,因而結合其他方法是非常必要的。
本研究中,將術中冰凍切片每高倍鏡(400倍)視野下多形核白細胞數>10個作為診斷髖關節感染的標準,其敏感性、特異性及準確性分別為87.5%、94.23%、90.32%。Nu?ez等[12]以每高倍鏡視野下多形核表細胞數≥5個作為診斷髖關節感染的標準,發現敏感性為85%,特異性為87%;Wong等[13]報道,每高倍鏡視野下多形核表細胞數≥10個作為診斷標準,則敏感性和特異性分別為86%、85%。這與我們的研究結果相似。因為炎癥并非一致地分布在假體周圍,因而取標本時應從假體周圍的不同位置獲取,這樣獲得的結果才更可靠,從而增加診斷的正確性。單個切片中見到較少的多核白細胞并不能完全排除感染。Tsaras等最新的一篇薈萃分析[14]指出術中假體周圍的組織冰凍切片能很好的明確本身存在感染的病例,但在排除感染方面的正確性相對較差。因而術中冰凍切片在術前各項檢查完成后認為潛在感染可能性較大的病例中(血沉、C反應蛋白均較高)具有更好的應用價值。同時該文章還指出運用最多的兩個臨界值即每高倍鏡視野下>5或10個多形核白細胞在診斷假體周圍感染的正確性上無統計學差異。因而,本研究將每高倍鏡視野下多形核表細胞數>10個作為診斷標準,與血沉、C反應蛋白聯合用于全髖關節置換術后感染的診斷是非常有意義的。
總之,將血沉、CRP和術中冰凍切片聯合起來能顯著提高診斷髖關節置換術后感染的價值。本研究中三項檢測聯合72髖感染僅有2髖漏診,52髖沒有感染僅有1髖誤診為感染。研究還發現,當三項檢查均為陽性時,感染的可能性非常大;當三項均為陰性時,可基本排除感染。因而,結合術前的ESR和CRP結果,再根據術中的冰凍切片結果區別感染和無菌性松動具有很高的正確性,對指導翻修手術具有較高的價值。
1 Kurtz SM, Lau E, Schmier J, et al. Infection burden for hip and knee arthroplasty in the United States[J]. J Arthroplasty, 2008, 23(7):984-991.
2 鄭稼,金毅.人工關節置換術后感染診斷及治療[J].中國矯形外科雜志,2007,15(22):1718-1720,1729.
3 Best JT. Revision total hip and total knee arthroplasty[J]. Orthop Nurs, 2005, 24(3):174-179.
4 Font-Vizcarra L, Tornero E, Bori G, et al. Relationship between intraoperative cultures during hip arthroplasty, obesity, and the risk of early prosthetic joint infection: a prospective study of 428 patients[J]. Int J Artif Organs, 2011, 34(9): 870-875.
5 儲誠兵,王繼芳,王巖,等.生化檢查對人工髖關節感染的診斷價值[J].中華醫院感染學雜志,2006,16(4):403-405.
6 Meehan AM, Osmon DR, Duffy MC, et al. Outcome of penicillinsusceptible streptococcal prosthetic joint infection treated with debridement and retention of the prosthesis[J]. Clin Infect Dis,2003, 36(7): 845-849.
7 郭旗,鄭稼,金毅,等.血沉、C反應蛋白及ECT聯合診斷假體周圍感染臨床研究[J].中華實用診斷與治療雜志,2010,24(3):255-257.
8 Sharkey PF, Hozack WJ, Rothman RH, et al. Insall Award paper.Why are total knee arthroplasties failing today?[J]. Clin Orthop Relat Res, 2002, (404):7-13.
9 Spangehl MJ, Masri BA, O’Connell JX, et al. Prospective analysis of preoperative and intraoperative investigations for the diagnosis of infection at the sites of two hundred and two revision total hip arthroplasties[J]. J Bone Joint Surg Am, 1999,81(5):672-683.
10 Toms AD, Davidson D, Masri BA, et al. The management of periprosthetic infection in total joint arthroplasty[J]. J Bone Joint Surg Br, 2006, 88(2): 149-155.
11 Costa CR, Johnson AJ, Naziri Q, et al. Efficacy of erythrocyte sedimentation rate and C-reactive protein level in determining periprosthetic hip infections[J]. Am J Orthop (Belle Mead NJ),2012, 41(4): 160-165.
12 Nu?ez LV, Buttaro MA, Morandi A, et al. Frozen sections of samples taken intraoperatively for diagnosis of infection in revision hip surgery[J]. Acta Orthop, 2007, 78(2): 226-230.
13 Wong YC, Lee QJ, Wai YL, et al. Intraoperative frozen section for detecting active infection in failed hip and knee arthroplasties[J]. J Arthroplasty, 2005, 20(8): 1015-1020.
14 Tsaras G, Maduka-Ezeh A, Inwards CY, et al. Utility of intraoperative frozen section histopathology in the diagnosis of periprosthetic joint infection : a systematic review and meta-analysis[J]. J Bone Joint Surg Am, 2012, 94(18): 1700-1711.

