我院腹腔感染需氧及兼性厭氧病原菌及藥物敏感性分析
劉 敏,雷 紅,孫敏霞,董躍明,高 慧,董 梅
解放軍第309醫院 檢驗科,北京 100091
腹腔感染是臨床上較為常見的疾病,如闌尾炎穿孔、膽管炎、感染性膽囊炎、肝膿腫、腹腔內膿腫、腹膜炎、基本外科術后感染等。引流是腹腔感染治療的重要控制措施[1],而及時、正確的抗菌藥物治療對疾病預后也有著重要的意義[2]。醫院護理相關腹腔感染的病原菌多為耐藥菌,病原菌分布除與解剖生理特點有關外,與醫院內感染流行密切相關[3]。本研究以我院近期腹腔感染患者需氧及兼性厭氧病原菌分布及其對抗菌藥物敏感性為研究對象,以期對本院臨床腹腔感染抗感染治療提供數據支持。
材料和方法
1 菌株來源 收集2011年1月-2012年5月解放軍第309醫院住院患者腹腔感染標本分離的需氧及兼性厭氧病原菌。所有病原菌已確診為腹腔感染,同一患者剔除重復分離菌株。
2 菌株鑒定及抗菌藥物敏感性測定 采用VITEK 2 COMPACT全自動微生物鑒定及藥物分析系統進行菌種鑒定及抗菌藥物MIC測定。不同菌種采用不同抗生素組合,所檢測抗生素涵蓋美國臨床及實驗室標準化學會(clinical and laboratory standards institute,CLSI)的抗菌藥物敏感性試驗執行標準第2009版推薦的A組、B組、U組和部分O組藥物,藥敏檢測方法為微量稀釋法,特殊耐藥表型采用KB法確認。藥物敏感性判斷參照CLSI第2009版抗菌藥物敏感性試驗執行標準。超廣譜β-內酰胺酶(extended spectrum beta-lactamase,ESBLs)確認參照CLSI2009雙紙片擴散法進行,頭孢他啶/克拉維酸或頭孢噻肟/克拉維酸的抑菌環較相應單藥抑菌環≥5mm即為產ESBLs菌株。
3 標準菌株 大腸埃希氏菌ATCC25922,銅綠假單胞菌ATCC27853,金黃色葡萄球菌ATCC29213,肺炎鏈球菌ATCC49619,陰溝腸桿菌ATCC700323。
4 統計學分析 采用軟件WHONET5.5進行數據分析,得出菌株來源、菌種分布及藥物敏感率和耐藥率。
結 果
1 菌株來源 共分離需氧及兼性厭氧病原菌111株,包括穿刺或引流的膽汁標本50株(45.0%),腹腔(包括累及腹膜)穿刺或引流的腹水標本61株(55.0%)。分離標本的科室以肝膽外科和普外科為首,共分離病原菌48株(43.2%);ICU次之,分離病原菌44株(39.6%);其余19株(17.1%)分離自結核病研究所7株(6.3%)、消化科5株(4.5%)、腫瘤科3株(2.7%)等。
2 菌種分布 111株需氧及兼性厭氧病原菌中,革蘭陰性桿菌78株(70.3%),革蘭陽性菌33株(29.7%)。革蘭陰性菌包括45株腸桿菌科菌(57.7%)和33株非發酵菌(42.3%)。陽性菌包括28株腸球菌(84.8%)和5株金黃色葡萄球菌(15.2%)。在所有病原菌中分離率名列前7位的分別是大腸埃希氏菌、鮑曼不動桿菌復合群、屎腸球菌、肺炎克雷伯菌、銅綠假單胞菌、糞腸球菌和金黃色葡萄球菌。未分離出凝固酶陰性葡萄球菌。具體病原菌分布見表1。
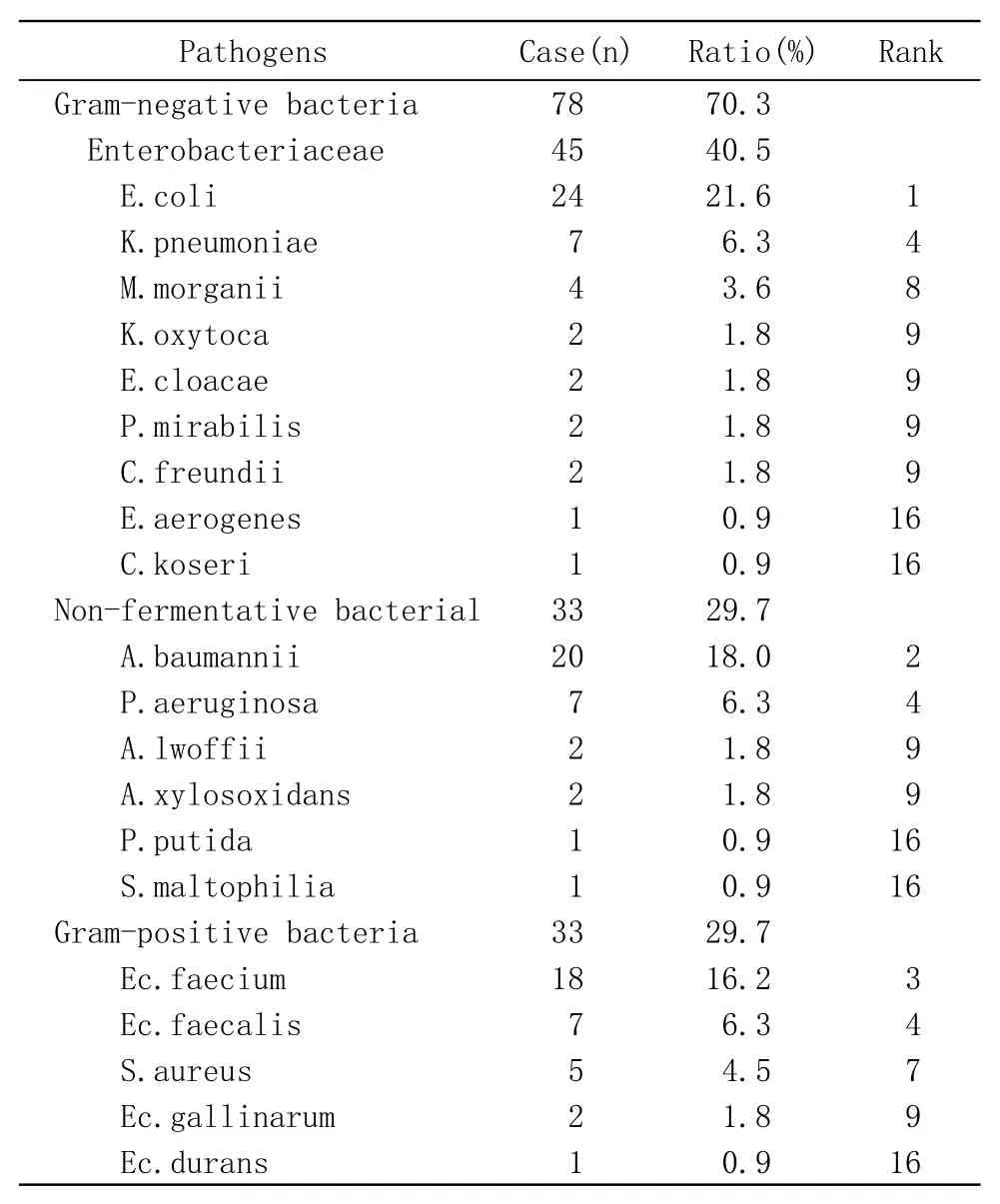
表1 腹腔感染需氧及兼性厭氧病原菌菌種分布Tab.1 Distribution of aerobic and facultative anaerobe pathogens in patients with intra-abdominal infections
3 腸桿菌科對抗菌藥物的敏感性 對腸桿菌科菌敏感性>90%的抗菌藥物有亞胺培南、厄他培南、哌拉西林/他唑巴坦、頭孢替坦,阿米卡星,所有腸桿菌科菌均對頭孢唑林耐藥。45株腸桿菌科菌中大腸埃希菌分離率最高(也是所有病原菌中分離率最高的),為53.3%,其次為肺炎克雷伯菌。大腸埃希菌和肺炎克雷伯菌中產ESBL菌株分離率分別為58.3%和57.1%。1株大腸埃希菌不確定是否產ESBL,其對頭孢噻肟和頭孢他啶均耐藥,但加克拉維酸后的抑菌圈直徑增加<5 mm,需在后續研究中證實。對于產ESBL大腸埃希菌和肺炎克雷伯菌僅對亞胺培南、厄他培南、頭孢替坦和阿米卡星敏感性大于90%,對哌拉西林/他唑巴坦大腸埃希菌較肺炎克雷伯菌敏感性更高。對于不產ESBL大腸埃希菌和肺炎克雷伯菌,除對前述5中抗菌藥物全部敏感外,對氨曲南、頭孢曲松、頭孢他啶、頭孢吡肟的敏感性均為100%。大腸埃希菌對喹諾酮類抗菌藥物的敏感性低于肺炎克雷伯菌,對復方新諾明和氨基糖苷類抗菌藥物的敏感性高于肺炎克雷伯菌。見表2。
4 非發酵菌對抗菌藥物的敏感性 鮑曼不動桿菌復合群居非發酵菌分離率之首,且90%為多重耐藥株 (multidrug resistance,MDR),60% 為泛耐藥株(extensive drug resistance,XDR),因未進行對多粘菌素敏感性的檢測,尚不明確泛耐藥株中是否存在全耐藥株(pandrug resistance,PDR);對頭孢哌酮/舒巴坦敏感率為40.8%(表3)。銅綠假單胞菌體外藥物敏感性檢測結果顯示對阿米卡星敏感率最高,妥布霉素次之,其次為美羅培南、亞胺培南、哌拉西林/他唑巴坦、環丙沙星和左氧氟沙星。對頭孢他啶和頭孢吡肟的敏感率>50%。1株銅綠假單胞菌(14.3%)為多重耐藥(MDR)。見表3。
5 腸球菌對抗菌藥物的敏感性 腸球菌中屎腸球菌占64.3%,糞腸球菌占25%。萬古霉素、利奈唑胺和替加環素對所有屎腸球菌和糞腸球菌均敏感。屎腸球菌對青霉素G和氨芐西林耐藥率達88.9%,而糞腸球菌對兩種藥物均敏感,屎腸球菌整體較糞腸球菌耐藥率高(表4)。未發現VRE等多重耐藥菌,對高濃度慶大霉素敏感腸球菌占38.9%,對高濃度鏈霉素敏感腸球菌占55.6%。
6 金黃色葡萄球菌對抗菌藥物的敏感性 由于金黃色葡萄球菌的數量較少,使得MRSA的檢出率及藥物敏感性無法精確分析。5株金黃色葡萄球菌中,3株為耐甲氧西林株(methicillin-resistant staphylococcus aureus,MRSA),2株為甲氧西林敏感株(methicillin-susceptible staphylococcus aureus,MSSA)。MRSA僅對復方新諾明、奎奴普丁/達福丁、利奈唑胺、萬古霉素和替加環素敏感;MSSA對苯唑西林、環丙沙星、左氧氟沙星、復方新諾明、奎奴普丁/達福普丁、利奈唑胺、萬古霉素和替加環素均敏感,對青霉素G耐藥。未發現耐萬古霉素金黃色葡萄球菌。
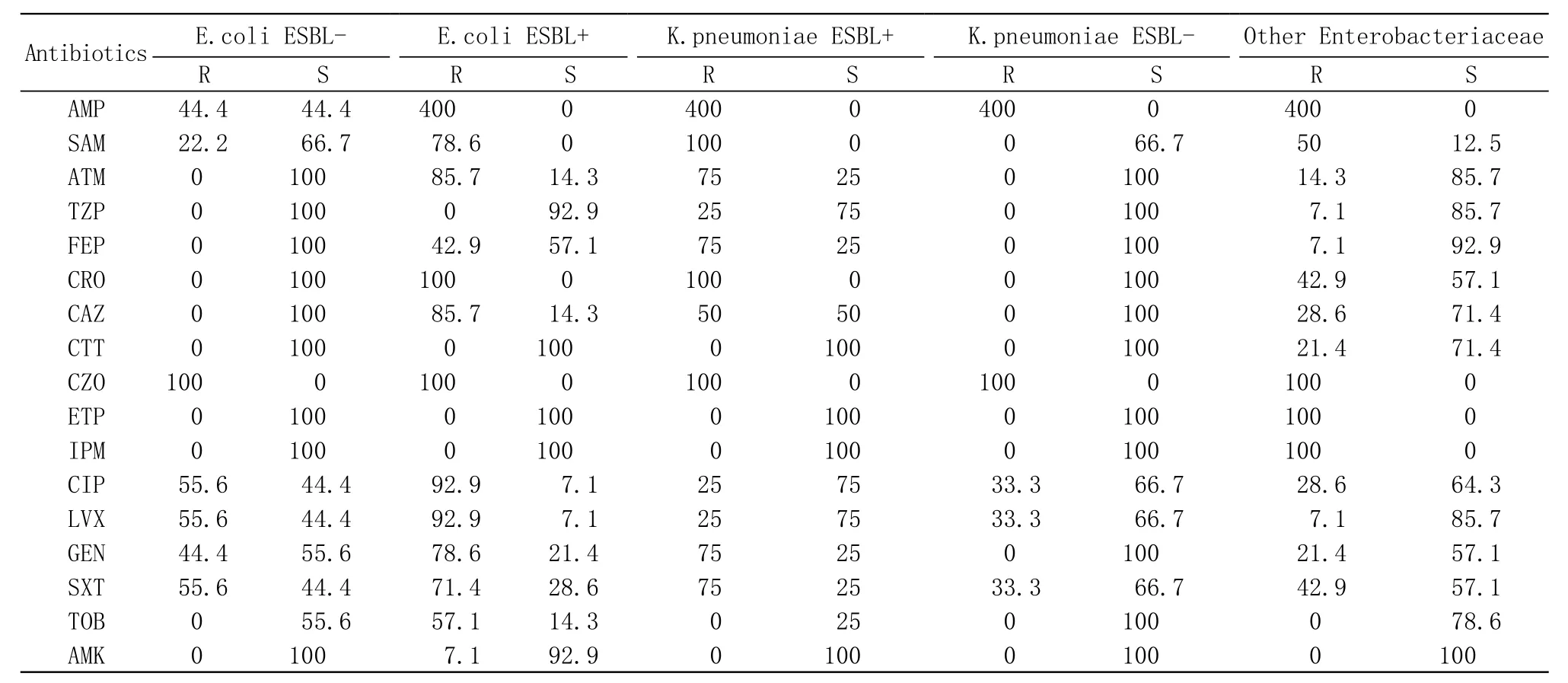
表2 腸桿菌科菌對抗菌藥物的敏感性Tab.2 Susceptibility rate and resistance rate of Enterobacteriaceae bacteria to antimicrobial agents(%)
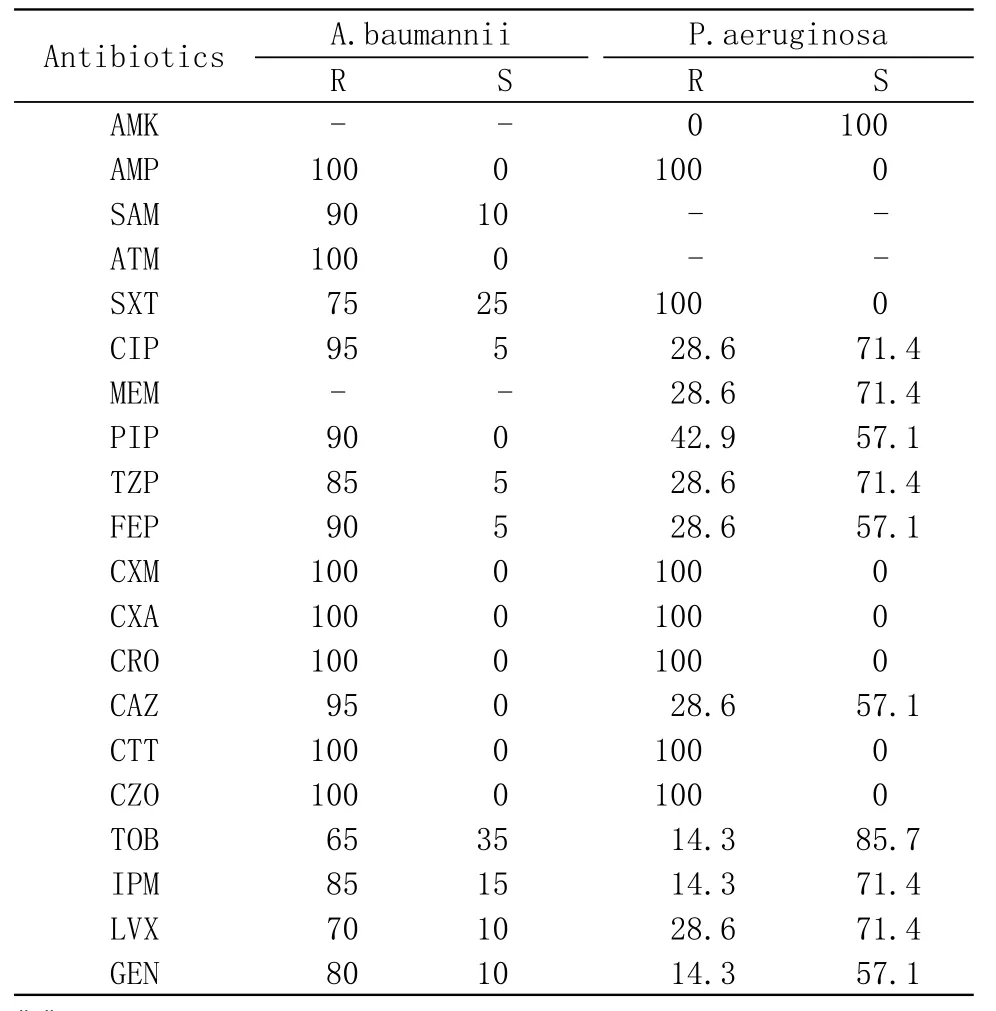
表3 非發酵菌對抗菌藥物的敏感性Tab.3 Susceptibility rate and resistance rate of nonfermentative bacteria to antimicrobial agents(%)

表4 腸球菌對抗菌藥物的敏感性Tab.4 Susceptibility rate and resistance rate of Enterococcus to antimicrobial agents(%)
討 論
本研究對我院住院患者腹腔感染需氧及兼性厭氧病原菌及抗菌藥物敏感性進行了分析。與文獻報道[4-8]相比較,我院分離率居前七位的病原菌中,鮑曼不動桿菌復合群的分離率較高,這與我院鮑曼不動桿菌整體分離率較高密切相關。
從腹腔感染的科室分布來看主要集中于肝膽外科、普外科和ICU,外科主要與解剖生理和基礎疾病相關。而結合ICU患者腹腔感染的病原菌分布特點顯示鮑曼不動桿菌中有70%來源于ICU,鮑曼不動桿菌作為環境中生存能力極強的條件致病菌,易侵犯ICU患者免疫低下人群,故ICU患者鮑曼不動桿菌腹腔感染主要與院內感染相關。且鮑曼不動桿菌的耐藥率也較高,多重耐藥株和泛耐藥株的比例分別高達90%和60%,對頭孢哌酮/舒巴坦敏感率(40.8%)介于文獻報道敏感率之間[6-8]。臨床可供選擇的敏感率較高的藥物十分有限,為臨床治療提出了嚴峻考驗。
銅綠假單胞菌菌株數較少,結果可能存在偏差,從有限數據來看,對阿米卡星和妥布霉素的敏感率較高,碳青霉烯類、哌拉西林/他唑巴坦和氟喹諾酮類的敏感率>70%,頭孢他啶和頭孢吡肟在約60%的患者中仍是可以應用的藥物。多重耐藥株的檢出給臨床治療提出了挑戰。
大腸埃希菌和肺炎克雷伯菌中的主要耐藥機制是產生ESBLs,僅有少部分菌可產生AmpC 酶[9]。本研究中大腸埃希菌ESBL陽性率高于Mohnarin的監測結果[8],低于SMART的監測結果[6]。無論是否產ESBLs,本研究中未發現產碳青霉烯酶腸桿菌科菌,且對頭孢替坦、阿米卡星和哌拉西林/他唑巴坦均表現出較好的體外抗菌活性。對于產ESBLs菌株,頭孢他啶的敏感性比頭孢曲松的敏感性高,這是否因CTX-M型基因型所引起將在后續研究中展開[10]。
本研究中屎腸球菌和金黃色葡萄球菌的分布與Mohnarin和SMART的監測結果有差異[6,8],對萬古霉素、利奈唑胺和替加環素均敏感。屎腸球菌耐藥率比糞腸球菌高。腸球菌對高水平慶大霉素的敏感性較低,使得聯合氨基糖苷類治療腸球菌感染的有效性降低。
綜上所述,本研究顯示我院腹腔感染需氧及兼性厭氧病原菌分布具有自己的流行病學特點,對常用抗菌藥物的耐藥性比較嚴重,酶抑制劑類、碳青霉烯類和糖肽類抗菌藥物是經驗性抗感染治療的有效藥物。
1 欒寧.自制雙套管治療嚴重腹腔感染92例分析[J].軍醫進修學院學報,2009,30(5):700.
2 Mazuski JE, Solomkin JS. Intra-abdominal infections[J]. Surg Clin North Am, 2009, 89(2):421-437.
3 Marshall JC. Intra-abdominal infections[J]. Microbes Infect,2004, 6(11):1015-1025.
4 謝紅梅,胡必杰,周春妹,等. 2006-2009年腹腔感染革蘭陰性桿菌對抗菌藥物的體外敏感性分析[J].中華醫院感染學雜志,2011,21(12):2610-2613.
5 王鳳霞,胡志東.2010年臨床腹腔感染患者病原菌的分布及耐藥性分析[J].中國全科醫學,2011,14(16):1864-1866.
6 Yang Q, Wang H, Chen M, et al. Surveillance of antimicrobial susceptibility of aerobic and facultative Gram-negative bacilli isolated from patients with intra-abdominal infections in China: the 2002-2009 Study for Monitoring Antimicrobial Resistance Trends (SMART)[J]. Int J Antimicrob Agents, 2010, 36(6): 507-512.
7 田文廣,黃文祥,賈蓓,等.腹腔感染革蘭陰性細菌耐藥性臨床分析[J].第三軍醫大學學報,2011,33(21):2235-2239.
8 胡巧娟,胡志東,李金,等.Mohnarin 2008年度報告:腹腔感染病原菌分布及耐藥監測[J].中國抗生素雜志,2010,35(8):620-624,632.
9 Pai H, Kang CI, Byeon JH, et al. Epidemiology and clinical features of bloodstream infections caused by AmpC-type-beta-lactamaseproducing Klebsiella pneumoniae[J]. Antimicrob Agents Chemother, 2004, 48(10):3720-3728.
10 Wang H, Kelkar S, Wu W, et al. Clinical isolates of Enterobacteriaceae producing extended-spectrum beta-lactamases:prevalence of CTX-M-3 at a hospital in China[J]. Antimicrob Agents Chemother, 2003, 47(2): 790-793.

