橋本甲狀腺炎與黏膜相關淋巴組織的病理學特征
羅 美,紀小龍
1遼寧醫學院 科學實驗中心,錦州 121000;2.北京武警總醫院 病理科,北京 100039
橋本氏甲狀腺炎(hashimoto thyroiditis,HT)中,淋巴細胞反應性增生導致黏膜相關淋巴組織(mucosa associated lymphoid tissue,MALT)增生,并可進一步發展成侵襲性淋巴瘤[1]。甲狀腺同時存在反應性和腫瘤性淋巴細胞,這會導致在細胞學或組織學上鑒別黏膜相關淋巴組織淋巴瘤(mucosa associated lymphoid tissue lymphoma,MALTOMA)產生困難,此時往往需借助免疫組織化學和分子生物學技術來鑒別診斷[2]。本研究闡述HT形態特征及免疫組織化學特點,并觀察免疫球蛋白(Ig)kappa(κ)和lambda(λ)輕鏈在鑒別HT和淋巴瘤中的重要性。
材料和方法
1 樣本選擇 收集武警總醫院2009年1月-2012年3月病理科存檔的32例甲狀腺切除標本,其中30例為HT,2例甲狀腺原發性黏膜相關性淋巴組織病變(非霍奇金淋巴瘤)作為對照。30例HT中女性25例,確診時平均年齡44.63(15~70)歲;男性5例,年齡25~66歲,所有患者臨床均表現為甲狀腺腫(平均3.7 cm),其中18例彌漫腫大,12例結節性。2例原發性淋巴瘤的對照病例均為女性,分別為65歲及80歲,臨床均表現為快速增大的結節性甲狀腺腫(分別為6 cm×5 cm×4 cm,8 cm×5 cm×3 cm),結節固定,超出甲狀腺界限,并出現壓迫癥狀及呼吸困難。
2 HE染色檢查 所有標本均經甲醛固定、石蠟包埋,并切成4μm組織切片,經常規蘇木素和伊紅染色(hematoxylin-eosin,HE)后,行組織病理學診斷,并評價淋巴細胞的浸潤及淋巴上皮病變(lymphoepithelial lesion,LEL)。淋巴上皮病變指3個或3個以上淋巴細胞聚集出現在腺體上皮細胞中。
3 免疫組織化學 石蠟切片脫蠟后梯度酒精入水,經3%過氧化氫封閉內源性過氧化物酶后,放入10 mmol/L檸檬酸鹽緩沖液中微波修復15 min,PBS緩沖鹽水洗,10%山羊血清孵育10 min,切片分別與鼠源或兔源一抗(CD20、CD3、Igκ、Igλ和抗細胞角蛋白)在4℃下孵育過夜(濃度1∶200)。切片與生物素標記的山羊抗鼠、抗兔IgG抗體(濃度1∶200)孵育30 min,與結合了親和素的辣根過氧化物酶(濃度1∶200)孵育45min。DAB顯色5 min,蘇木素復染。Igκ和Igλ染色細胞比例≥10∶1時認為存在單克隆性。
結 果
1 HT的組織病理特征 30例HT臨床表現為甲狀腺腫,鏡下均表現為多克隆性。所有病例均顯示HT特征性改變,淋巴細胞聚集成濾泡,濾泡間小淋巴細胞、漿細胞浸潤,其中散在淋巴漿細胞樣細胞及少量大的活化細胞。大多數淋巴濾泡生發中心和套區界限清楚,且不存在邊緣區。2例淋巴漿細胞彌漫浸潤,局灶甲狀腺結構被不典型的淋巴細胞破壞,濾泡上皮萎縮。嗜酸細胞化生常見,淋巴上皮病變少見。見圖1。
2 甲狀腺原發性淋巴瘤病理特征 2例甲狀腺原發性淋巴瘤患者的臨床表現為巨大甲狀腺腫,甲狀腺實質被彌漫緊密排列的不典型淋巴樣細胞取代。淋巴樣細胞由單核樣淋巴細胞組成,細胞核小、輕度不規則,或類似中心細胞,染色質濃集,核仁不顯著,胞漿豐富、淡染。淋巴上皮病變常見。其中可見淋巴漿細胞樣細胞混雜浸潤,細胞核偏位,胞漿豐富、強嗜伊紅染色。淋巴組織中見殘留的甲狀腺濾泡上皮,濾泡小,內含膠質或形成不含膠質的腺泡狀結構。瘤細胞浸潤甲狀腺包膜及周圍脂肪、骨骼肌組織。見圖2。
3 免疫組織化學染色 1)HT:大量淋巴細胞組成(T細胞和B細胞混雜存在,但主要是T細胞)。淋巴濾泡主要由B細胞組成(CD20+、CD3-)(圖3A)。淋巴濾泡間淋巴細胞主要由T細胞構成(CD3+、CD20-),其間也參雜少量B細胞和漿細胞(圖3B)。淋巴上皮病變少見,其中浸潤的淋巴細胞主要是T細胞(CD3+)(圖3C)。細胞角蛋白顯示殘留的甲狀腺濾泡上皮(圖3D)。2例甲狀腺炎富含淋巴細胞,免疫組織化學染色顯示其中CD20陽性細胞數目增多,生發中心界限清楚,其外圍有明顯的套區包繞。甲狀腺濾泡間淋巴細胞彌漫緊密浸潤,但為多克隆性增生,雙重表達κ、λ免疫染色,lambda/kappa比值始終小于1∶5(圖4A和B)。2)甲狀腺原發性淋巴瘤:2例MALT淋巴瘤主要由B細胞組成,且B細胞不僅限于生發中心。邊緣區及彌漫區的瘤細胞不論大小均表達CD20,不表達CD3,這進一步證實腫瘤細胞來源于B細胞(圖2C和D)。淋巴上皮病變眾多,而完整的甲狀腺濾泡少見(圖2E)。淋巴上皮病變數量較HT多,且淋巴細胞填充甲狀腺濾泡腔的現象顯著,局灶填充的細胞呈中心細胞樣(圖2F)。細胞角蛋白勾勒出殘留的萎縮濾泡上皮。kappa和lambda免疫染色證實了形態學診斷,腫瘤細胞明確為κ單克隆,我們計數了10個高倍視野,kappa/lambda比值至少10∶1。病理特征及克隆性為kappa單克隆,即輕鏈限制僅見于淋巴瘤病例。
討 論
94%甲狀腺淋巴瘤患者繼發于淋巴細胞性甲狀腺炎。但是由于臨床病史、體格檢查、甲狀腺功能測定和超聲學檢查均無法特異地發現異常增生的淋巴細胞,因此甲狀腺淋巴瘤的診斷困難。此外,有時低級別病變與淋巴細胞性甲狀腺炎鑒別存在困難,重度慢性淋巴細胞性甲狀腺炎與淋巴瘤鑒別也會十分困難[3]。
本研究中,所有HT病例均顯示大量淋巴濾泡形成,且反應性發生中心寬大,套區顯著,淋巴濾泡間大量淋巴細胞和漿細胞浸潤。甲狀腺濾泡上皮萎縮,嗜酸細胞化生;2例因淋巴細胞浸潤形成淋巴上皮病變,致使局灶甲狀腺結構消失,但是HT典型區域仍然多見。文獻也報道過此類現象,并認為甲狀腺炎可致正常甲狀腺濾泡結構消失,形成所謂的淋巴上皮病變[4]。甲狀腺炎中常見成分之一的生發中心在部分病例可以很少,甚至消失。反應性淋巴細胞大量增生會掩飾早期淋巴瘤。血清學標記,如乳酸脫氫酶(LDH)和β2-微球蛋白顯著增高往往只見于明顯的淋巴瘤[5]。因此,甲狀腺活檢更易于確切診斷。
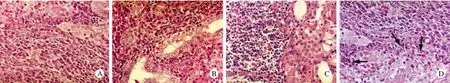
圖1 HT的HE染色 A: 萎縮的甲狀腺濾泡旁反應性生發中心,濾泡間淋巴漿細胞性炎細胞浸潤; B: 淋巴漿細胞浸潤,局灶形成LEL;C:濾泡上皮嗜酸細胞化生; D:箭頭示偶見LELs(×400)Fig.1 HE staining of HT A: Reactive germinal centre beside atrophic thyroid follicles with interfollicular infiltration of lymphoplasmacytic inflammatory cells; B: Lymphoplasmacytic infiltration with focal formation of LEL; C: Hurthle cell metaplasia of follicular epithelium;D: Occasional LEL (arrows) in HT

圖2 甲狀腺MALT淋巴瘤病例 A: LEL(HE染色); B: CD20陽性腫瘤細胞; C: CD3陰性腫瘤細胞; D: 箭頭示殘留的甲狀腺濾泡; E:細胞角蛋白示少量殘留甲狀腺濾泡,注意LEL;F: 箭頭示CD20陽性腫瘤細胞形成LEL,MALT瘤細胞簇(×400)Fig.2 Patients with MALT thyroid lymphoma A: HE-stained LEL; B: CD20-positive tumor cells; C: CD3-negative tumor cells; D: Residual thyroid follicles; E: Few anti-cytokeratin- stained residual thyroid follicles with formation of LEL; F: Arrow indicates CD20-positive tumor cells with formation of LEL and MALT lymphoma cell cluster (×400)
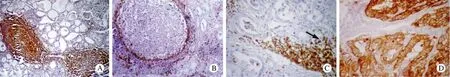
圖3 HT免疫過氧化物酶染色 A: CD20示反應性淋巴濾泡(×200); B: 含反應性淋巴濾泡的HT具CD3陽性的套區(×200); C: 箭頭示少量非破壞性LEL由CD3陽性T細胞組成(×400); D: 細胞角蛋白示完整的甲狀腺濾泡(×200)Fig.3 Immunoperoxidase- stained HT A: CD20 showing reactive lymphoid follicles (×200); B: HT with reactive lymphoid follicles having CD3-positive mantle zone (×200); C: Arrow indicating CD3-positive T-cells-formed few non-destructive LEL (×400); D: Cytokeratin showing intact thyroid follicles (×200)
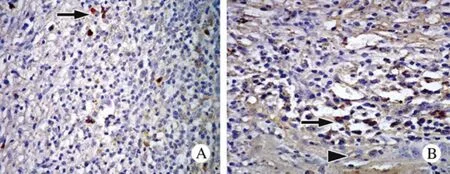
圖4 免疫過氧化物酶染色 A: 箭頭示HT異質性表達κ免疫染色; B: 箭頭示HT反應性淋巴組織表達λ免疫染色,三角箭頭指示小灶甲狀腺濾泡非破壞性LELFig.4 Immunoperoxidase staining A: Arrow indicatingκimmunostaining of heterogeneous HT (×400); B: HT showing positiveλimmunostaining of reactive lymphoid population(arrow), the arrowhead indicating the thyroid follicle with small non-destructive LEL (×400)
本組所有HT病例顯示B細胞和T細胞混雜增生,尤以后者為甚[6]。CD20勾勒出生發中心,而套區和淋巴濾泡間區高表達CD3。淋巴上皮病變中的淋巴細胞以T細胞為主,即能排除MALT淋巴瘤。細胞角蛋白染色顯示出結構不清的淋巴上皮病變。據文獻報道[7],HT中檢測到B細胞單克隆增生。有研究者認為,此少量B細胞選擇性單克隆增生是HT自身免疫反應的一部分[8]。也有研究者證實,甲狀腺淋巴瘤患者確實先前有HT病史[9]。此外,Moshynska 等[10]報道1例HT患者發生了微灶性結外邊緣區淋巴瘤,瘤灶直徑4mm,他們強調需仔細檢查甲狀腺標本,以發現小的淋巴瘤轉化灶。
本組2例HT局灶甲狀腺結構被不典型的淋巴細胞破壞。由此會有這樣的疑問:此類病變可能隱含單克隆性增生,并可在日后進展成淋巴瘤。但是,κ和λ免疫組織化學染色證實其為多克隆性,表明這些不典型淋巴細胞為反應性增生,可以排除早期淋巴瘤的可能。本研究的2例MALT淋巴瘤顯示,甲狀腺結構被彌漫浸潤的淋巴細胞破壞,并浸潤至甲狀腺周圍組織,且以單克隆性增生為主,腫瘤性淋巴細胞有核裂,胞漿豐富、透明。其中也夾雜漿細胞樣淋巴細胞。結構破壞性的LEL豐富,完全取代了甲狀腺濾泡,殘留的甲狀腺濾泡被細胞角蛋白勾勒出來。瘤細胞一致表達CD20,而不表達CD3,證實其為B細胞淋巴瘤。Kappa和lambda免疫組織化學染色顯示腫瘤細胞一致、強烈表達κ免疫染色,而不表達λ免疫染色[7]。
總之,嚴格的形態學及免疫組織化學標準能鑒別HT和MALT淋巴瘤。對于形態學上處于交界的病例(淋巴細胞彌漫浸潤),細胞角蛋白、CD20、CD3,以及κ、λ免疫染色能有助于鑒別診斷。
1 Zintzaras E, Voulgarelis M, Moutsopoulos HM. The risk of lymphoma development in autoimmune diseases: a meta-analysis[J]. Arch Intern Med, 2005, 165(20): 2337-2344.
2 Cabay RJ, Salem F. Chronic lymphocytic (Hashimoto) thyroiditis:an interesting cellular aggregate in a fine-needle aspiration biopsy[J] .Diagn Cytopathol, 2009, 37(3):191.
3 Tiemann M, Asbeck R, Wacker HH. Clonal B-cell reaction in Sj?gren disease and Hashimoto autoimmune thyroiditis[J].Pathologe, 1996, 17(4): 289-295.
4 Li Y, Nishihara E, Hirokawa M, et al. Distinct clinical, serological,and sonographic characteristics of hashimoto's thyroiditis based with and without IgG4-positive plasma cells[J]. J Clin Endocrinol Metab, 2010, 95(3): 1309-1317.
5 Horie I, Abiru N, Sakamoto H, et al. Induction of autoimmune thyroiditis by depletion of CD4+CD25+ regulatory T cells in thyroiditis-resistant IL-17, but not interferon-gamma receptor,knockout nonobese diabetic-H2h4 mice[J]. Endocrinology, 2011,152(11): 4448-4454.
6 Saxena A, Alport EC, Moshynska O, et al. Clonal B cell populations in a minority of patients with Hashimoto's thyroiditis[J]. J Clin Pathol, 2004, 57(12): 1258-1263.
7 Chen HI, Akpolat I, Mody DR, et al. Restricted kappa/lambda light chain ratio by flow cytometry in germinal center B cells in Hashimoto thyroiditis[J]. Am J Clin Pathol, 2006, 125(1):42-48.
8 Deshpande V, Huck A, Ooi E, et al. Fibrosing variant of Hashimoto thyroiditis is an IgG4 related disease[J]. J Clin Pathol, 2012, 65(8):725-728.
9 Zeppa P, Cozzolino I, Peluso AL, et al. Cytologic, flow cytometry,and molecular assessment of lymphoid infiltrate in fine-needle cytology samples of Hashimoto thyroiditis[J]. Cancer Cytopathol,2009, 117(3): 174-184.
10 Moshynska OV, Saxena A. Clonal relationship between Hashimoto thyroiditis and thyroid lymphoma[J]. J Clin Pathol, 2008, 61(4):438-444.

