股深動脈開通與股淺動脈支架植入治療下肢缺血的對照研究
鐘紅珊,孟令巖,徐克,楊慶,王穎,李隴超
超過50%的下肢動脈粥樣硬化性狹窄/閉塞病變累及股淺動脈(superficial femoral artery,SFA)。TASCⅡ指南(Trans-Atlantic Inter-Society Consensus for the management of PAD)將總長度超過15 cm的未累及腘動脈的長節段性SFA狹窄/閉塞病變定義為C級病變[1]。對于SFA長節段(>15 cm)閉塞的患者,SFA的開通與支架植入是常規的介入治療方法。但需植入至少2枚血管內支架,手術費用較高,且長節段性病變支架植入后遠期通暢率不理想。另有部分患者由于下肢動脈粥樣硬化病程較長,給SFA閉塞段的開通造成了很大困難。在這類患者中,股深動脈(deep femoral artery,DFA)及其側支循環在維持下肢血供方面起有至關重要的作用[2-4]。一旦DFA狹窄超過30%,患者即會出現嚴重下肢缺血(critical limb ischemia,CLI),表現為持續2周以上的靜息痛、皮膚破潰或壞疽。因此,本研究采用病例對照研究,探討經皮DFA開通在治療慢性CLI中的重要性。
1 資料與方法
1.1 臨床資料
2009年8月至2012年8月本科收治68例SFA長節段性閉塞(TASCⅡ分級C級)并有慢性CLI癥狀的患者,術前均行下肢動脈超聲多普勒檢查和CT血管造影(CTA)檢查明確診斷,記錄患者跛行距離,同時測定踝肱指數(ABI)。伴有髂動脈及股總動脈流入道病變的患者不納入本研究。50例患者接受了SFA支架植入術,18例患者接受了DFA成形術和(或)支架植入術。患者術后第1年每3個月隨訪1次,第2年和第3年每6個月隨訪1次。如患者下肢缺血癥狀復發則隨時隨訪。隨訪內容包括臨床癥狀、間歇性跛行距離、ABI和下肢動脈多普勒超聲檢查,如疑似血管再閉塞則進行CTA檢查。為對比兩種治療方法的臨床療效,根據交叉配對分析入組標準,即有持續2周以上的CLI癥狀,SFA長節段性閉塞(>15 cm),DFA起始段狹窄(80%>管腔直徑狹窄率>30%),髂動脈及股總動脈流入道管腔無嚴重狹窄,腘動脈和脛腓干血流通暢并小腿流出道血管至少有1條通暢的和術后長期口服阿司匹林和他汀類藥物,對18對符合標準的患者進行了回顧性分析。研究終點設定為支架再狹窄或閉塞、需再次介入治療、截肢和死亡。介入治療失敗定義為術后3個月癥狀無改善或病情復發。隨訪6~36個月,平均28個月。
1.2 介入治療方法
1.2.1 SFA支架植入術經健側股動脈穿刺后置入7 F翻山鞘至患側髂動脈,進行數字減影血管造影(DSA),顯示SFA病變血管形態,在單彎導管支撐下,用0.035英寸泥鰍導絲開通閉塞段,必要時可行內膜下開通,跟進導管穿過閉塞段后注入少量對比劑,如遠端血管分支顯影,則確認導管頭端位于動脈真腔內。置換260 cm加硬導絲,用直徑4 mm長球囊對閉塞段血管進行預擴張,并植入直徑6 mm的自膨式血管內支架,造影確認支架位置及血流情況。如支架膨脹不良可用直徑6 mm球囊導管進行后擴張,擴張后再次進行血管造影評價療效。
1.2.2 DFA球囊成形術和(或)支架植入術經健側股動脈穿刺后置入7 F翻山鞘至患側髂動脈,DSA顯示SFA病變血管形態、DFA和側支循環及遠端流出道血流情況(圖1a、1b)。單彎導管支撐下,用0.035英寸泥鰍導絲穿越起始部狹窄超過30%的DFA,置換260 cm加硬導絲后,用相應理想血管直徑的短球囊導管對DFA狹窄段進行擴張成形術。擴張結束后進行血管造影,如殘余狹窄小于15%,則結束治療;如殘余狹窄大于15%或出現DFA夾層,則植入球擴式血管內支架。支架植入后再次進行血管造影評價療效(圖1c)。
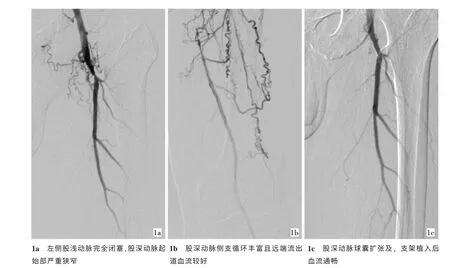
圖1 股深動脈支架植入術治療
1.3 統計學方法
介入治療后的臨床療效,即首次通暢率及再次通暢率用Kaplan-Meier法分析,log-rank檢驗確定兩種治療方法是否存在顯著差異;患者的間歇性跛行距離、ABI和手術費用以平均數±標準差表示,術前、術后及兩組間差異用t檢驗;應用Cox回歸風險比例模型分析患者術前存在的各種危險因素(如性別、年齡、吸煙、糖尿病、高血壓、冠心病、間歇性跛行距離、ABI及血管造影顯示膝下保持通暢的流出道動脈條數)對介入手術后臨床療效的影響P<0.05為差異有統計學意義。
2 結果
68例患者支架植入的技術成功率為100%。30 d死亡率為1.5%(1/68)。1例患者于術后27 d死于心肌梗死。根據入組標準對其余67例患者進行篩選,對其中36例患者進行了交叉配對分析,分為SFA支架植入組(18例)和DFA球囊成形和(或)支架植入組(18例)。
2.1 術前評估
兩組患者術前一般臨床資料見表1。兩組間術前間歇性跛行距離和ABI值差異無統計學意義(P>0.05)。
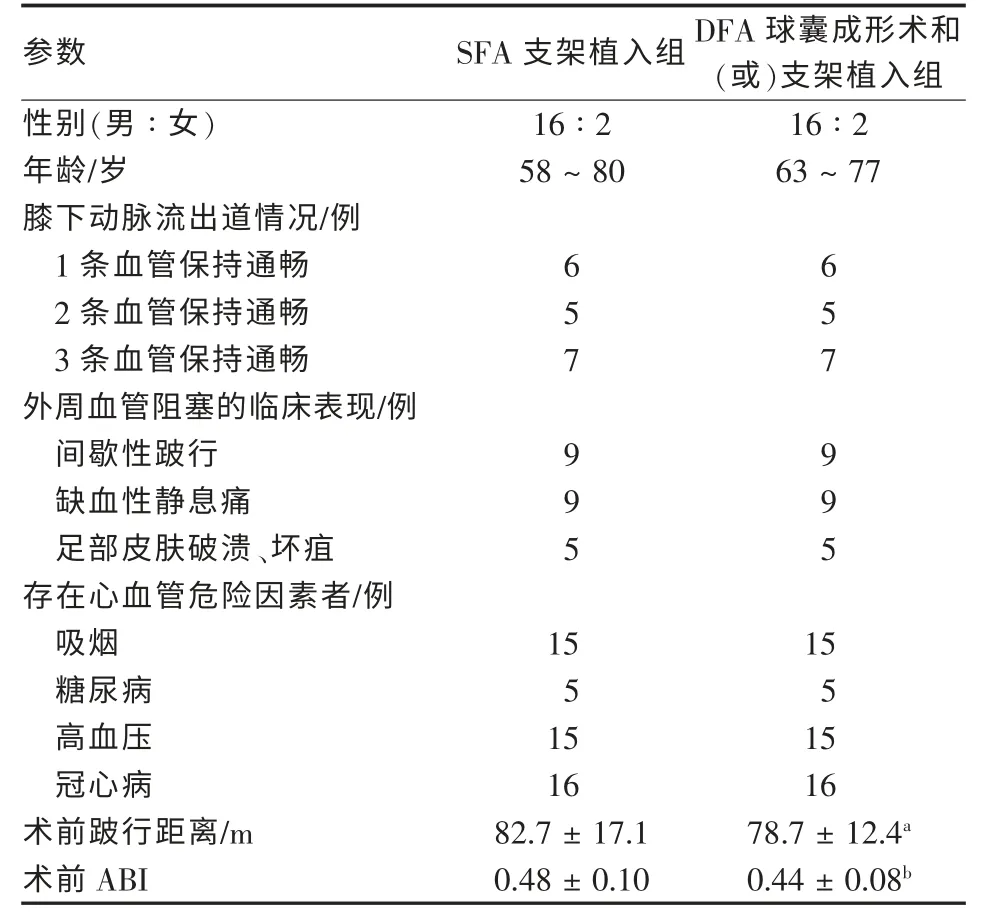
表1 兩組患者的臨床資料(n=18)
2.2 療效評價
兩組患者經介入治療后平均跛行距離和ABI均有明顯改善。SFA支架植入組患者的跛行距離由術前的(82.7±17.1)m增加到術后的(664.4±146.4)m,差異有統計學意義(P<0.000 1);ABI由術前的0.48±0.10增加到術后的0.82±0.05(P<0.000 1)。DFA球囊成形和(或)支架植入組患者的跛行距離由術前的(78.7±12.4)m增加到術后的(661.1±137.1)m,差異有統計學意義(P<0.000 1),ABI由術前的0.44±0.08增加到術后的0.79±0.05(P<0.000 1)。兩組間跛行距離增加幅度和ABI改善差異無統計學意義(P>0.05,圖2、3)。

圖2 患者治療后跛行距離改善情況
2.3 遠期臨床療效評價
SFA支架植入組和DFA球囊成形和(或)支架植入組的首次通暢率及再次通暢率差異無統計學意義(P>0.05,圖4)。
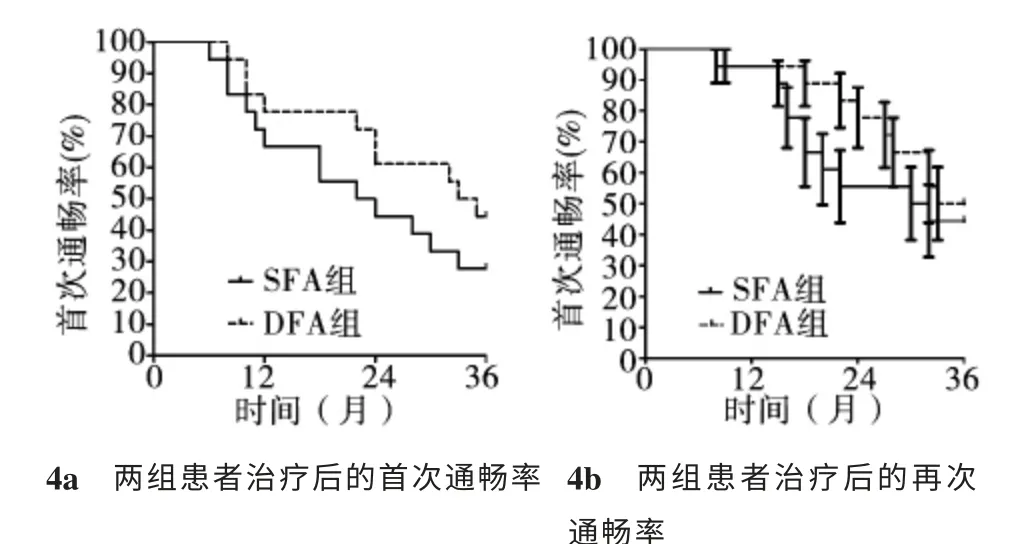
圖4 患者接受介入治療的首次通暢率與再次通暢率
在隨訪期間,SFA支架植入組有3例患者接受截肢手術(2例膝下截肢,1例膝上截肢)。DFA球囊成形和(或)支架植入組有4例患者接受截肢手術(2例膝下截肢,2例膝上截肢),兩組相比差異無統計學意義(P=0.674)。所有截肢患者術前均表現為CLI伴有足部皮膚破潰和壞疽。
2.4 多變量分析
應用Cox回歸風險比例模型對兩種介入治療方法和患者術前存在的各種危險因素(如性別、年齡、吸煙、糖尿病、高血壓、冠心病、間歇性跛行距離、ABI及保持通暢的膝下流出道動脈條數)對臨床療效的影響進行分析。結果證實只有術前血管造影顯示的保持通暢的膝下流出道情況是影響預后的獨立因素。流出道血管通暢條數越多,預后越好(P=0.000,OR=0.100,95%CI:0.039~0.256)。

圖3 患者治療后ABI改善情況
3 討論
慢性長節段SFA狹窄/閉塞所致CLI的治療一直是困擾血管介入醫師的難題[5-6]。這類病變外科轉流手術損傷大,移植物遠期通暢率不理想。而長節段SFA閉塞性病變的腔內治療開通較困難,手術時間長,內膜下開通后植入多個長金屬支架的遠期開通率不理想,且可能出現支架折斷等并發癥。DFA及其側支循環對于維持慢性長節段SFA狹窄/閉塞病變患者的下肢血供起著至關重要的作用。目前,關于單純DFA開通成形術的報道較少[7-8],在技術成功率、遠期首次開通率及保肢率方面結果相差懸殊。我們在長期的臨床實踐中發現部分慢性長節段SFA狹窄/閉塞所致CLI患者在開通DFA后可獲得較好臨床療效。因此,我們推論,這類患者的SFA狹窄/閉塞為慢性發病過程,很多患者通過豐富的DFA側支循環保證下肢供血,一旦DFA起始部發生狹窄/閉塞病變,則出現CLI癥狀。本研究對具有相同適應證、危險因素和影像學表現的慢性長節段SFA狹窄/閉塞伴DFA短節段狹窄的患者進行了配對病例對照研究,將兩種治療方法,即SFA開通及支架植入術和DFA球囊成形和(或)支架植入術進行了對比。結果表明兩種治療方法的手術成功率、圍手術期和中遠期臨床療效相似。而在手術難度及醫療成本方面,DFA球囊成形和(或)支架植入術則明顯優于SFA開通及支架植入術。因此,對于慢性長節段SFA狹窄/閉塞所致CLI患者,在治療前應進行謹慎細致的影像學評估。如DFA起始部有短節段的狹窄/閉塞,且DFA與SFA之間側支循環豐富,應首先考慮進行DFA開通成形和(或)支架植入術,這樣既縮短了手術時間,減少了患者和醫師的X線輻射劑量,又節約了醫療成本,減輕了社會經濟負擔。
本研究還對患者術前存在的各種危險因素及臨床表現與病變血管特點對預后的影響進行了多變量分析。發現性別、年齡、吸煙、糖尿病、高血壓、冠心病、間歇性跛行距離和ABI對于介入治療術后的遠期療效無影響。而術前通暢的膝下流出道動脈條數是唯一影響預后的獨立因素。因此,術前的謹慎影像學評估對于任何一種介入治療的適應證的選擇至關重要,并可使患者及家屬對疾病預后有更準確的心理預期。
本研究也存在一定的不足之處,即未對介入治療術前的DFA與SFA之間的側支循環進行量化評估。因此,在今后的臨床研究中,我們將根據DFA與SFA之間的側支循環條數及側支循環血管直徑進行量化評估,說明側支循環的豐富程度,這樣可以更科學、更完善地確定DFA球囊成形和(或)支架植入術治療慢性長節段SFA狹窄/閉塞所致嚴重下肢缺血的適應證。
綜上所述,對于慢性長節段SFA狹窄/閉塞所致的CLI,并伴有DFA起始段狹窄(管腔直徑狹窄率30%~80%)的患者,DFA球囊成形和(或)支架植入術與SFA開通及支架植入術相比,手術成功率、圍手術期和中遠期臨床療效無明顯差異。且手術過程簡單,手術費用低。因此,DFA的開通應引起血管介入醫師的足夠重視。膝下流出道通暢與否是影響各種介入治療預后的獨立因素,因此,介入治療前的影像學評估不容忽視。
[1]Norgren L,Hiatt WR,Dormandy JA,et al.Inter-society consensus for the management of peripheral arterial disease(TASCⅡ)[J].Eur J Vasc Endovasc Surg,2007,33:S1-75.
[2]Leeds FH,Gilfillan RS.Importance of profunda femoris artery in the revascularization of the ischemic limb[J].Arch Surg,1961,82:25-31.
[3]Morris GC Jr,Edwards E,Cooley D,et al.Surgical importance of profunda femoris artery.Analysis of 102 cases with combined aortoiliac and femoropopliteal occlusive disease treated by revascularization of deep femoral artery[J].Arch Surg,1961,82:32-37.
[4]Waibel PP,Wolff G.The collateral circulation in occlusions of the femoral artery:an experimental study[J].Surgery,1966,60:912-918.
[5]王洪劍,鄧鋼,秦永林,等.球囊擴張或(和)支架植入術治療股淺動脈狹窄或閉塞的中遠期療效[J].介入放射學雜志,2012,21:810-815.
[6]周玉斌,吳丹明.股淺動脈長段閉塞的治療選擇[J].介入放射學雜志,2010,19:831-834.
[7]Varty K,London NJ,Ratliff DA,et al.Percutaneous angioplasty of the profunda femoris artery:a safe and effective endovascular technique[J].Eur J Vasc Surg,1993,7:483-487.
[8]Silva JA,White CJ,Ramee SR,et al.Percutaneous profundaplasty in the treatment of lower extremity ischemia:results of long-term surveillance[J].J Endovasc Ther,2001,8:75-82.