胸腺切除對EAE 大鼠發病影響及機制的探討
申張順,高 倩,程樹彬,辛立建,劉瑞春,郭 力,董 梅
多發性硬化(multiple sclerosis,MS)是以中樞神經系統炎性脫髓鞘為主要病理改變的自身免疫性疾病,發病機制尚不完全清楚。實驗性自身免疫性腦脊髓炎(EAE)與人類MS 在臨床表現、病理學特征及免疫學機制等多方面相似,是公認的研究MS 的動物模型。
CD4+CD25+Treg 細胞是新近發現的細胞亞群,具有抑制炎癥反應、促進疾病緩解等重要作用,在多種自身免疫性疾病中發揮保護作用,同樣可抑制EAE 病情進展,促進疾病恢復[1]。
研究表明,CD4+CD25+Treg 細胞來自于胸腺,在胸腺中發育、分化、成熟并輸出到外周免疫環境,發揮其免疫調節作用。一般認為,到青春期后,胸腺隨年齡的增長而逐漸萎縮退化,其功能亦隨之衰退。新近研究表明:EAE 大鼠可見胸腺萎縮、凋亡加劇等病理學改變,胸腺在EAE 大鼠發病中可通過產生CD4+CD25+Treg 細胞,抑制EAE 進展[2]。關于成年期胸腺是否能分化調節T 細胞并進一步發揮抗炎、維持免疫耐受的調節作用的認識,目前仍相對空白。
本研究通過觀察對比去胸腺和未去胸腺EAE大鼠發病過程,檢測不同發病時期脊髓和脾臟Treg細胞的動態變化,明確胸腺是否在EAE 大鼠發病中具有免疫調節作用并進一步探討其作用機制。
1 材料和方法
1.1 實驗動物、試劑器材
1.1.1 實驗動物 健康雌性Wistar 大鼠(合格證編號:1006151)90 只,6~8 周齡,體重180~200g;雌性豚鼠3 只,體重350~400g,河北醫科大學實驗動物中心提供。
1.1.2 試劑及儀器 卡介苗60mg/ml(北京生物制品研究所),兔抗小鼠/大鼠Foxp3 抗體(北京博奧森生物技術有限公司),antirat CD4+(FITC)、anti-rat CD25+(PE),anti-rat Foxp3(PE-CY5)及固定破膜劑(美國eBioscience 公司),流式細胞儀(美國Beckman Coulter Etics XL),離心機(TD5G,湖南凱達科學儀器有限公司)。
1.2 實驗方法
1.2.1 去胸腺大鼠模型的制備[3]Wistar 大鼠以10%水合氯醛腹腔注射麻醉,固定四肢及頭部,沿前頸部及胸部中線剪開皮膚及皮下組織并暴露氣管,沿氣管前間隙于胸骨柄中點剪開胸骨約1.5 cm,顯露胸腺上極。用顯微鑷輕輕牽引并分離胸腺兩葉,當分離到下極時即與胸腔相通,此時迅速游離取下胸腺關閉胸腔,繼而用10ml 注射器刺入大鼠右側胸腔,緩緩回抽,一般可抽出胸腔內積氣3~5ml,縫合皮下組織及皮膚。同樣方法切開胸骨,保留胸腺,制備對照組假手術模型。
1.2.2 EAE 動物模型的制備[4]及分組 對去胸腺組大鼠和部分假手術組大鼠,以豚鼠全脊髓勻漿(GPSCH)為抗原進行免疫,建立Wistar 大鼠EAE動物模型。實驗分為對照組(假手術大鼠未進行免疫)、去胸腺EAE 組和EAE 組(假手術大鼠進行免疫),每組30 只,各組按發病時間及發病程度分為發病前期(免疫12d)、發病高峰期(發病后3d)和恢復期(發病后7d),每組10 只。
1.2.3 指標觀察 免疫當天為第0 天,觀察大鼠精神、飲食、體重、二便及肢體活動,參照通用的評分標準進行神經功能評分:0 分:不發病;1 分:動物尾部無力;2 分:后肢輕度癱瘓+步態不穩;3 分:中度癱瘓但自主運動保存;4 分:肢體嚴重癱瘓,自主運動不能;5 分:瀕死狀態。
1.2.4 標本處理 按實驗設計,以10%水合氯醛麻醉大鼠,迅速取脾臟,進行流式細胞術檢測,取脊髓腰膨大組織固定于4%多聚甲醛中,行HE 及免疫組化染色,觀察炎癥改變和脊髓組織中Foxp3的表達。將脾臟研磨、200 目細胞篩過濾制成細胞懸液,定量,加入抗CD4+、CD25+熒光抗體避光孵育30min,加入破膜劑破膜,加入Foxp3 抗體避光孵育30min 后,重懸細胞,上流式細胞儀檢測Treg 細胞含量。
1.2.5 統計分析 所得數據采用SPSS13.0 統計軟件進行統計分析,各組發病率用百分數表示,組間比較采用卡方檢驗,計量資料以均數±標準差(±s)表示,多組計量資料均數的比較應用ANOVA方差分析,組間兩兩比較采用LSD 法,P<0.05 為差異有統計學意義。
2 結果
2.1 動物發病情況的觀察 兩組動物均出現食欲不振、皮毛不光滑、體重下降等情況。繼而出現尾部無力下垂、肢體癱瘓,多數動物為2 個以上肢體癱瘓,嚴重者出現瀕死狀態。EAE 組大鼠病情達高峰后,癥狀逐漸緩解,極少動物遺留后遺癥狀,去胸腺組大鼠發病率高于EAE 組(P<0.05),且癱瘓程度更重,癥狀持續,不能隨病程緩解,神經功能評分顯著高于EAE 組(P<0.05)(見表1)。
2.2 組織病理學改變 對照組各時期脊髓組織內均未見炎性細胞浸潤。去胸腺組和EAE 組在發病前期均可見少量散在炎性細胞浸潤,對比無明顯差異。去胸腺組發病第3 天和第7 天均可見大量炎性細胞浸潤和多處“血管袖套”現象,均較EAE組程度嚴重,EAE 組發病第7 天較第3 天炎性細胞明顯較少,“血管袖套”基本消失(見圖1)。
2.3 脊髓Foxp3 表達 對照組不同時期脊髓組織Foxp3 少量表達(P>0.05)。去胸腺組和EAE組Foxp3 陽性細胞數目隨疾病進展均增高(P<0.05),不同時期EAE 組表達量均高于同時期去胸腺組(P<0.05),且兩組表達量均高于對照組(P<0.05)(見表2)。
2.4 脾臟CD4+CD25+Foxp3+T 的細胞含量對照組不同時期脾臟組織Foxp3 細胞含量無差異(P>0.05)。去胸腺組EAE 組Foxp3 細胞含量隨病情發展均增高(P<0.05),不同時期EAE 組的Foxp3 含量均高于同時期的去胸腺組(P<0.05),且兩組Foxp3 的細胞含量均高于對照組(P<0.05)(見表3)。
表1 各組發病率和神經功能評分比較(±s)

表1 各組發病率和神經功能評分比較(±s)
胸腺切除組與EAE 組比較* P<0.05;7d 組與3d 組比較#P<0.05
表2 不同組脊髓Foxp3 細胞陽性表達比較(±s)

表2 不同組脊髓Foxp3 細胞陽性表達比較(±s)
與對照組比較* P<0.05;3d 組與發病前組比較#P<0.05;胸腺切除組與EAE 組比較▽P<0.05;7d 組與3d 組比較△P<0.05

表3 不同組脾臟CD4+CD25+Foxp3+Treg 含量(%)比較
3 討論
MS 的發病機制目前尚不完全明確,目前的資料多認為是由CD4+T 淋巴細胞介導的針對自身髓鞘抗原免疫應答及繼發炎癥級聯反應損傷中樞神經白質所致。CD4+CD25+調節性T 細胞,即Treg 細胞在自身免疫應答的免疫負調節及自身免疫耐受中發揮著重要作用,可分為胸腺來源的自然調節T 細胞(nTR)和誘導性調節T 細胞(iTR)[5]。Foxp3 是叉頭樣轉錄因子家族成員之一,對CD4+CD25+T 細胞發育和功能起到很重要的調控作用[6]。Kim[7]等學者證實,Foxp3 高度選擇表達于CD4+CD25+T 細胞,是CD4+CD25+T 細胞的重要標志,也是鑒定Treg 細胞的重要標志。CD4+CD25+T 細胞在維持外周免疫耐受、預防自身免疫性疾病的發生方面起著重要作用。研究發現,在MS 疾病活動期,CD4+CD25+T 細胞在患者外周血中的數量較非活動期明顯減少,Foxp3mRNA 的表達量也顯著降低[8]。雷帕霉素可通過增加EAE 大鼠外周淋巴器官脾臟中CD4+CD25+Foxp3 細胞含量,從臨床和病理兩方面明顯減輕疾病的發生[9]。Th17 細胞是近年來研究發現的參與MS 發病的另一類T 淋巴細胞,通過分泌IL-17等細胞因子破壞血腦屏障,募集炎癥細胞進入CNS,破壞髓鞘和軸索[10]。在EAE 發病中,Treg 細胞和Th17 細胞共同參與調節機體自身免疫過程,二者的平衡關系決定了疾病的發展方向,Th17 細胞功能亢進、Treg 細胞功能低下是導致MS 發病的關鍵所在[11,12]。CD4+CD25+T 細胞在抑制EAE 疾病的發展以及促進其恢復緩解方面發揮著至關重要的作用。
胸腺是機體最重要的中樞免疫器官,在維持機體正常免疫功能和免疫耐受機制中發揮著重要作用。胸腺在調節性CD4+CD25+T 細胞發育分化過程中占有十分重要的地位。實驗發現,切除出生后3d 小鼠的胸腺可誘使其患多種自身免疫疾病如自身免疫性腸炎等[13],在其體內檢測不到CD4+CD25+Foxp3+T 細胞的存在,或含量極低,向其輸注CD4+CD25+T 細胞則可防止自身免疫疾病的發生,表明CD4+CD25+T 細胞是在胸腺中發育分化,并輸注到外周淋巴器官及組織,進而發揮其免疫調節作用。傳統觀念認為,在個體發育早期,CD4+CD25+T 細胞自胸腺輸出到外周淋巴組織中后,即通過自身的擴增膨脹建立天然CD4+CD25+T 細胞群,而不再需要胸腺補充作用。到青春期以后,胸腺隨年齡的增長而逐漸出現重量、形態以及功能的退化,T 細胞發育成熟過程受阻,生成數量減少,不再是機體的主要免疫器官,其免疫調節作用亦隨之減弱。但Tsunoda[14]研究表明:大鼠發生EAE 后,可以見到胸腺出現萎縮、腫脹、凋亡加劇等病理學異常及生成的T 淋巴細胞功能受損等情況。在其胸腺中仍可以檢測到大量CD4+CD25+T 細胞及Foxp3mRNA。因此,我們推斷,在發生自身免疫疾病過程中,胸腺仍可輸出Treg 細胞,抑制自身免疫損傷,發揮免疫調節作用。
本研究發現,去胸腺組大鼠發病率高、臨床癥狀嚴重且不能緩解,炎癥細胞浸潤程度重,脊髓中Foxp3+陽性細胞數量及脾臟中CD4+CD25+Treg 細胞含量均較EAE 組明顯下降,差異具有統計學意義。表明成年期胸腺確實在降低EAE 大鼠發病率、減輕神經功能損傷及促進病情緩解等方面發揮著極其重要的作用。EAE 組大鼠隨疾病發生和進展,胸腺中CD4+CD25+Treg 細胞動員輸出增加,在數量和功能上得到上調,通過其接觸抑制和分泌抑炎細胞因子作用,抑制效應細胞功能,抑制炎癥發展,疾病發展得到抑制并逐漸緩解。而去胸腺組大鼠在發病過程中,雖然其脊髓中Foxp3+陽性細胞數量及其脾臟中CD4+CD25+T 淋巴細胞含量有相對升高,但失去了胸腺的免疫調節作用。促炎因素一直處于主導地位,致使其發病癥狀重于EAE 組,而且喪失了疾病恢復緩解能力。
Van[15]等研究支持EAE 小鼠出現胸腺損傷及輸出Treg 細胞減少,通過增加Treg 細胞可以改善EAE發病。因此,胸腺不僅是T 細胞發育器官,而且是重要的免疫調節器官,并參與免疫耐受形成。在EAE 大鼠發病過程中,胸腺能通過動員輸出CD4+CD25+T 淋巴細胞到外周免疫環境和靶器官中,抑制炎癥進展,促進疾病恢復,從而發揮其免疫調節作用。
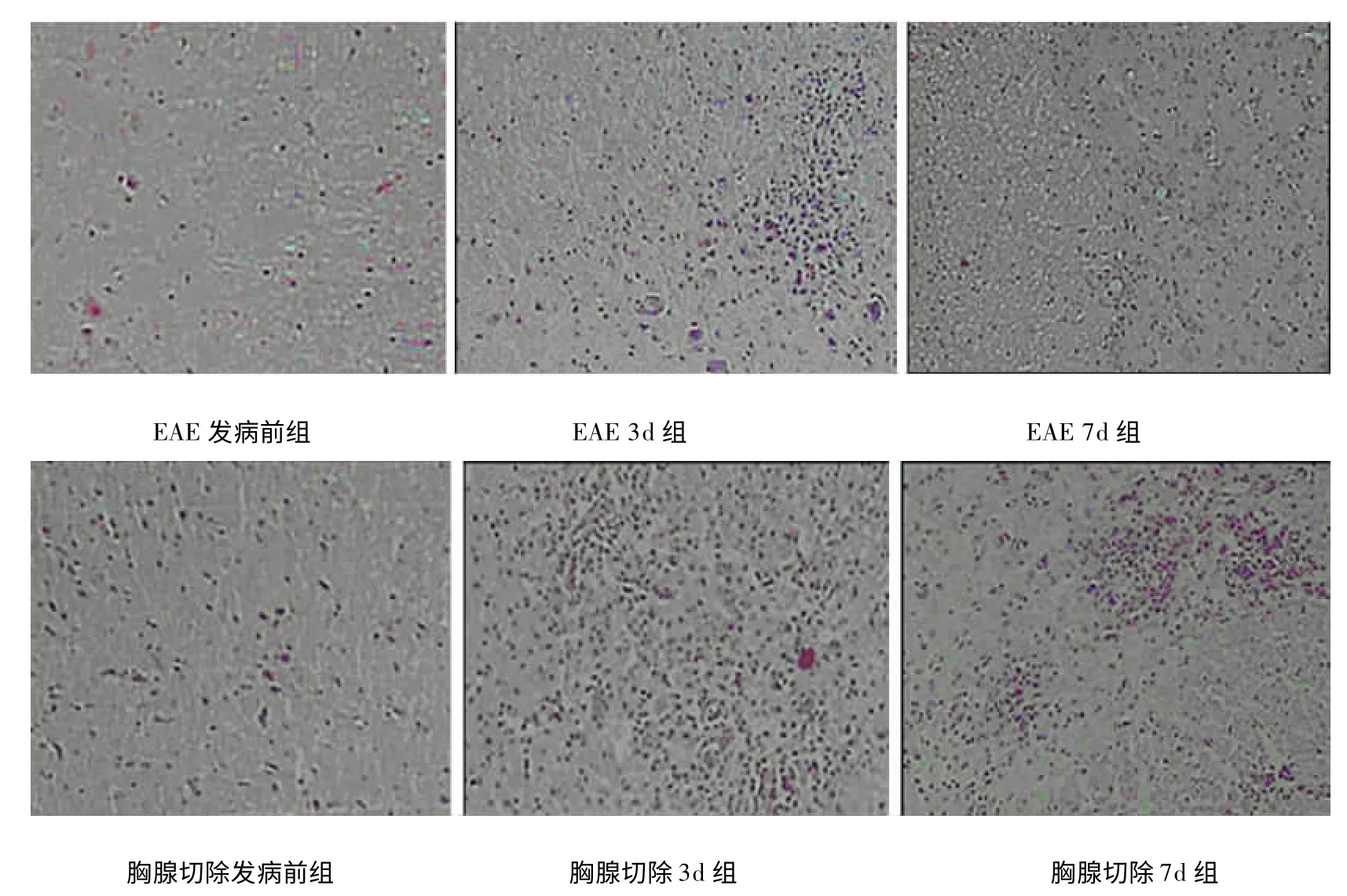
圖1 各組脊髓HE 染色比較(HE,200×)
[1]Stephens LA,Malpass KH,Anderton SM.Curing CNS autoimmune disease with myelin-reactive Foxp3+Treg[J].Eur J Immunol,2009,39(4):1108-1117.
[2]Song F,Guan Z,Gienapp IE,et al.The thymus plays a role in oral tolerance in experimental autoimmune encephalomyelitis[J].J Immunol,2006,177(3):1500-1509.
[3]熊海波,夏穗生,溫 浩.去胸腺大鼠模型的建立及改進[J].中華器官移植雜志,2004,7:214-214.
[4]Dong M,Liu RC,Guo L,et al.Pathological findings in rats with experimental allergic encephalomyelitis[J].APMIS,2008,116(11):972-984.
[5]Weiss JM,Bilate AM,Gobert M,et al.Neuropilin 1 is expressed on thymus-derived natural regulatory T cells,but not mucosa-generated induced Foxp3+T reg cells[J].J Exp Med,2012,209(10):1723-1742.
[6]Chatila T.Molecular mechanisms of regulatory T cell development[J].J Clin Immunol,2008,28(6):625-630.
[7]Kim JM,Rudensky A.The role of the transcription factor foxp3 in the development of regulatory T cells[J].Immunol Rew,2006,212:86-98.
[8]翁益云,李旭華,夏君慧.多發性硬化患者外周血CD4+CD25+T細胞變化及其機制探討[J].中國神經免疫學和神經病學雜志,2008,15(2):84-86.
[9]Donia M,Mangano K,Amoroso A,et al.Treatment with rapamycin ameliorates clinical and histological signs of protracted relapsing experimental allergic encephalomyelitis in Dark Agouti rats and induces expansion of peripheral CD4+CD25+Foxp3+regulatory T cells[J].J Autoimmun,2009,33(2):135-140.
[10]Pierre Miossc.IL-17 and Th17 cells in human inflammatory diseases[J].Microbes and infection,2009,11(5):625-630.
[11]張藍方.Th17/Treg 平衡調節與疾病的關系進展[J].J Jining Med Univ,2011,34(1):68-71.
[12]Luz-Crawford P,Kurte M,Bravo-Alegria J,et al.Mesenchymal stem cells generate a CD4+CD25+Foxp3+regulatory T cell population during the differentiation process of Th1 and Th17 cells[J].Stem Cell Res Ther,2013,4(3):65.
[13]Asano M,Toda M,Sakaguchi N,et al.Autoimmune diseaseas a consequence of developmental abnormality of a T cell subpopulation[J].J Exp Med,1996,184(2):387-396.
[14]Tsunoda I,Libbey JE,Kuang LQ,et al.Massive apoptosis in lymphoid organs in animal models for primary and secondary progressive multiple sclerosis[J].Am J Pathol,2005,167(6):1631-1646.
[15]Tan YV,Abad C,Wang Y,et al.Pituitary adenylate cyclase activating peptide deficient mice exhibit impaired thymic and extrathymic regulatory T cell proliferation during EAE[J].PLoS One,2013,8(4):61200.

