血清IL-6、IL-10 及IFN-α 水平對首發(fā)抑郁患者雙側(cè)海馬區(qū)細(xì)胞代謝影響的磁共振波譜研究
朱 穎,王冬青,朱 彥,李月峰,朱海濤,殷瑞根,趙 亮
炎癥因子學(xué)說是抑郁癥發(fā)病機(jī)制中的一種重要的假說,其中促炎性細(xì)胞因子及抗炎性細(xì)胞因子種類繁多,且作用各不相同。而大量病理學(xué)及影像學(xué)證據(jù)亦表明抑郁癥患者海馬存在功能結(jié)構(gòu)的變化。雖然炎癥因子學(xué)說與腦結(jié)構(gòu)功能異常學(xué)說研究點(diǎn)不一樣,但實(shí)際上是相互聯(lián)系及影響的。
以往的研究很少對這兩種學(xué)說所研究的對象進(jìn)行聯(lián)系比較,我們針對這種潛在的聯(lián)系性,利用氫質(zhì)子磁共振波譜技術(shù)(1H-MRS)檢測雙側(cè)海馬細(xì)胞代謝功能變化的同時測定外周血血清中幾種炎癥因子的水平高低,探討炎癥因子對首發(fā)抑郁患者海馬區(qū)細(xì)胞代謝的影響,有機(jī)地結(jié)合兩種學(xué)說去研究抑郁癥的發(fā)病機(jī)制。
1 材料與方法
1.1 實(shí)驗(yàn)對象收集 收集20 例2010 年4 月~2013 年4 月經(jīng)江蘇大學(xué)附屬醫(yī)院及附屬第四人民醫(yī)院精神科診斷為首發(fā)抑郁癥的患者并符合以下條件:(1)首次發(fā)作并且未經(jīng)過抗抑郁藥物干預(yù),同時未服用過其它精神類藥物;(2)未接受過電休克等物理治療;(3)未使用影響腦內(nèi)乙酰膽堿等神經(jīng)遞質(zhì)的藥物;(4)排除其他精神障礙或藥物依賴、患有嚴(yán)重的軀體疾病或嚴(yán)重藥物過敏、患過腦器質(zhì)性疾病或其他可能影響腦結(jié)構(gòu)與功能的疾病;(5)近2w 無感冒、發(fā)熱及其他感染性病史。其中男8 例,女12 例,最大者35 歲,最小者17 歲,平均年齡(26±4)歲;受教育年限8~16(13.4±3.8)年;身高154~177(160±19)cm;體重46~80(63±10)kg;均為右利手。
20 例健康志愿者均為本院職工或其家屬,其中男9 例,女11 例;最大者37 歲,最小者20 歲,平均年齡(28±6)歲;受教育年限9~19(15.2±2.9)年;身高:156~179(164±22)cm,體重:44~78(58±11)kg,均為右利手。
本研究經(jīng)醫(yī)院倫理委員會批準(zhǔn),全部志愿者對本研究項目知情并簽署知情同意書。
1.2 磁共振波譜檢測 采用西門子公司Magnetom Trio Tim 3.0T 高場磁共振成像系統(tǒng)及MRS 專用頭顱線圈作為檢測設(shè)備。以TSE 序列MRI 常規(guī)掃描排除腦部器質(zhì)性病變,并采用3 軸(X 軸、Y 軸、Z 軸)對雙側(cè)海馬進(jìn)行1H-MRS 定位。VOI:(16×16);體素大小:1cm×1cm×1.5cm。采用(MVS)3D-CSI 序列對受試者進(jìn)行1H-MRS 掃描(TR=1700ms,TE=135ms)。波譜掃描時避開顱骨、脂肪、氣腔及腦脊液等結(jié)構(gòu),并使用飽和帶以避免周圍組織對檢查結(jié)果的影響。體素內(nèi)勻場、水抑制均由掃描程序自動完成。掃描完成后使用隨機(jī)LEONARDO 程序進(jìn)行基線、相位校正。工作站記錄相關(guān)代謝指標(biāo)并以Cr 為標(biāo)準(zhǔn)計算Glx/Cr、NAA/Cr、Cho/Cr、MI/Cr 的比值(Cr 由于其濃度在各種狀態(tài)下量化相對恒定,常被作為參照物)。所有數(shù)據(jù)均光盤刻錄儲存,之后由兩名副高以上職稱醫(yī)師統(tǒng)一時間同時獨(dú)立進(jìn)行統(tǒng)計分析。
1.3 血清炎癥因子水平測量 所有受試者均在早晨6:30~8:00 時間段1H-MRS 掃描前空腹抽取肘靜脈血3ml,不抗凝,自然狀態(tài)下放置30min 后離心(3000r/min,10min)分離血清后置于-20℃低溫保存。采用ELISA 法對保存的血清樣本進(jìn)行IL-6、IL-10 及IFN-α 水平的檢測。
1.4 統(tǒng)計學(xué)分析 測得數(shù)據(jù)符合正態(tài)性分布,數(shù)據(jù)用Stata12.0 軟件包進(jìn)行統(tǒng)計分析,計量資料以均數(shù)±標(biāo)準(zhǔn)差(±s)表示。采用t 檢驗(yàn)的統(tǒng)計學(xué)方法,P<0.05 為有統(tǒng)計學(xué)意義。采用Spearman 相關(guān)分析檢驗(yàn)雙側(cè)海馬區(qū)多種代謝指標(biāo)與血清中多種炎性因子水平的相關(guān)性,P<0.05 為有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 兩組雙側(cè)海馬各代謝指標(biāo)變化 相對于正常組,首發(fā)抑郁組患者左側(cè)海馬的Glx/Cr 及NAA/Cr 顯示下降(Glx/Cr:t=2.69,<0.05;NAA/Cr:t=2.81,P<0.05);而Cho/Cr 顯示升高(t=2.36,P<0.05),MI/Cr 變化不明顯(t=1.19,P>0.05),右側(cè)海馬僅僅出現(xiàn)Glx/Cr(t=2.43,P<0.05)的下降,其余指標(biāo)未見有統(tǒng)計學(xué)意義的升高(見表1、見圖1)。
2.2 兩組血清中炎癥因子水平變化 相對于正常組,首發(fā)抑郁組患者外周血血清中IL-6 及IFNα 水平出現(xiàn)有統(tǒng)計學(xué)意義的升高(IL-6:t=4.53,P<0.05;IFN-α:t=4.49,P<0.05),IL-10 水平變化不明顯(t=0.26,P>0.05)(見表2)。
2.3 雙側(cè)海馬各代謝指標(biāo)與血清中各種炎癥因子水平的相關(guān)性分析 雙側(cè)海馬的Glx/Cr 水平與IL-6、IFN-α 水平呈明顯負(fù)相關(guān)[左側(cè):(IL-6:r=-0.555,P<0.05;IFN-α:r=-0.604,P<0.05);右側(cè):(IL-6:r=-0.575,P<0.05;IFN-α:r=-0.511,P<0.05)],左側(cè)海馬的NAA/Cr 水平與IL-6、IFN-α 水平亦呈顯著負(fù)相關(guān)(IL-6:r=-0.582,P<0.05;IFN-α:r=-0.593,P<0.05),左側(cè)海馬的Cho/Cr 水平與IL-6、IFN-α 水平成明顯正相關(guān)(IL-6:r=0.601,P<0.05;IFN-α:r=0.548,P<0.05)。其余代謝指標(biāo)與血清炎癥因子水平相關(guān)性不明顯(見表3)。
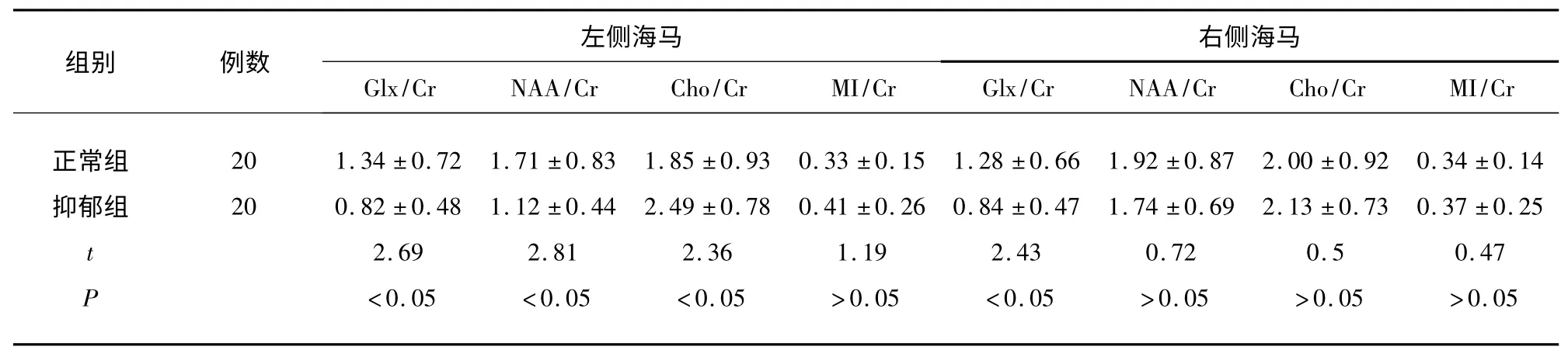
表1 正常組與抑郁組的雙側(cè)海馬各1H-MRS 代謝指標(biāo)比較

表2 正常組與抑郁組的血清炎癥因子水平比較(pg/ml)
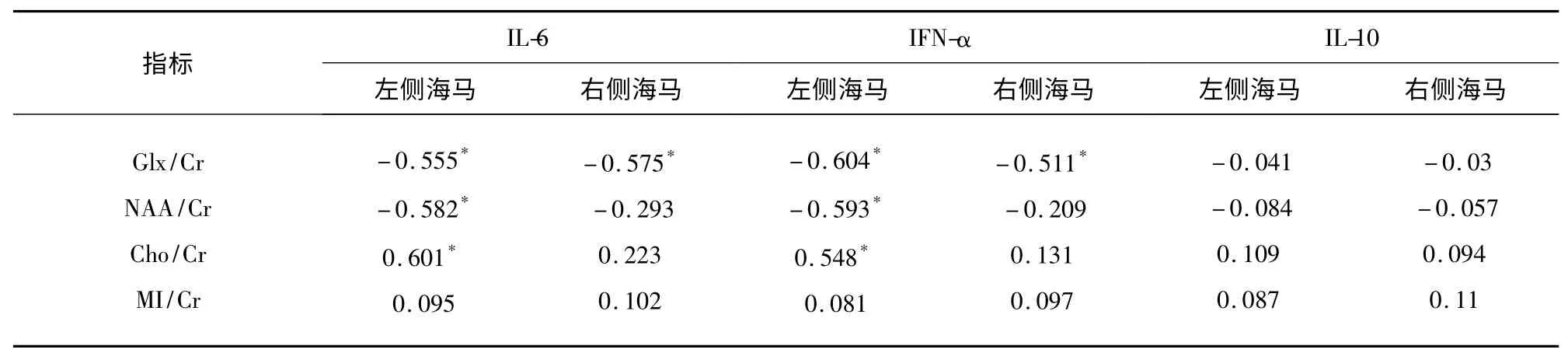
表3 雙側(cè)海馬1H-MRS 各代謝指標(biāo)檢測結(jié)果與血清炎癥因子水平高低的相關(guān)性

圖1 正常組與抑郁組雙側(cè)海馬的1H-MRS 波譜圖對比(左為正常組,右為抑郁組)
3 討論
Dowlati[1]認(rèn)為慢性炎癥是產(chǎn)生抑郁癥的一個重要因素,Lee[2]的研究也表明產(chǎn)生抑郁狀行為的大鼠其血清中炎癥因子的水平與正常大鼠有較大區(qū)別。筆者所在研究小組的前期研究通過檢測抑郁大鼠模型的腦脊液炎癥因子水平也發(fā)現(xiàn)其中幾種因子水平的升高[3]。由于對抑郁癥炎癥因子假說的研究大多只是集中在某些載體內(nèi)(如:外周血清、腦脊液或腦組織液)炎癥因子的水平高低,所以究竟這些炎癥因子對于神經(jīng)細(xì)胞代謝的影響是怎樣很少有涉及。且動物模型與臨床病例發(fā)病機(jī)制并不完全一致[4]。因此本研究選擇首發(fā)抑郁患者作為研究對象,以排除不同類型、不同病程、不同年齡、性別以及首發(fā)復(fù)發(fā)等干擾因素。首發(fā)抑郁患者由于是從正常逐漸變化為抑郁狀態(tài),不受病程、治療或年齡等因素的干擾[5],能更單純地研究抑郁癥始發(fā)的發(fā)病原因。海馬是如今公認(rèn)的導(dǎo)致產(chǎn)生抑郁狀態(tài)的核心核團(tuán),調(diào)控著情感、情緒變化甚至學(xué)習(xí)記憶能力[6],其中神經(jīng)細(xì)胞的代謝變化極可能參與了整個抑郁癥發(fā)生的過程。筆者利用1H-MRS 這種無創(chuàng)的檢測神經(jīng)細(xì)胞代謝變化的手段去活體研究首發(fā)抑郁癥患者敏感腦區(qū)受炎癥因子水平的影響,充分結(jié)合兩種不同手段去探討抑郁癥的發(fā)病機(jī)制。
L-6 促進(jìn)B 淋巴細(xì)胞分化及增殖,這些物質(zhì)能抑制神經(jīng)細(xì)胞新生、發(fā)育,且能同步激活下丘腦-垂體-腎上腺軸,增加皮質(zhì)激素分泌,促進(jìn)細(xì)胞凋亡[7]。IFN-α 引起將色氨酸轉(zhuǎn)化為犬尿氨酸的IDO(吲哚胺2,3-雙加氧酶)的升高,導(dǎo)致色氨酸供應(yīng)減少,從而減少5-HT 的合成,同時犬尿氨酸的代謝產(chǎn)物能引起神經(jīng)元細(xì)胞的損失,導(dǎo)致抑郁癥[8]。IL-10 作為一種免疫抑制因子能夠調(diào)節(jié)免疫系統(tǒng),對抗促炎性細(xì)胞因子的作用。筆者分別選擇這3 種對機(jī)體有著不同作用的炎癥因子做研究比較,發(fā)現(xiàn)在首發(fā)抑郁患者出現(xiàn)血清炎癥因子水平變化的同時,海馬的某些神經(jīng)細(xì)胞代謝指標(biāo)亦出現(xiàn)了有統(tǒng)計學(xué)意義的波動。IL-6、IFN-α 水平在首發(fā)抑郁患者的血清中都有較明顯的升高,做相關(guān)性分析發(fā)現(xiàn)同時雙側(cè)海馬的Glx/Cr都出現(xiàn)了下降,而NAA/Cr 及Cho/Cr 的變化僅僅出現(xiàn)在左側(cè)海馬,代表著肌醇磷酸循環(huán)的MI/Cr 值[9]卻并未出現(xiàn)明顯變化。由于存在大腦優(yōu)勢半球的影響[10],我們推測在早期的首發(fā)抑郁癥中IL-6、IFN-α水平升高影響最大的是海馬神經(jīng)細(xì)胞的谷氨酸循環(huán)代謝,促炎癥細(xì)胞能夠破壞正常的神經(jīng)細(xì)胞谷氨酸循環(huán),使神經(jīng)遞質(zhì)代謝出現(xiàn)紊亂,這或許是抑郁癥產(chǎn)生的始發(fā)環(huán)節(jié)。緊接著的左側(cè)海馬NAA/Cr 及Cho/Cr 變化代表了神經(jīng)元數(shù)目與神經(jīng)細(xì)胞包膜完整性的變化,推測由于受到谷氨酸循環(huán)異常影響而出現(xiàn)了神經(jīng)細(xì)胞的損害,是始發(fā)環(huán)節(jié)的一個發(fā)展,加深了神經(jīng)元與神經(jīng)細(xì)胞的破壞。IL-10 在本次研究中并未出現(xiàn)有意義的變化,猜測與抑郁癥的病程有關(guān),它在早期的首發(fā)抑郁癥中并未激活起作用。
隨著更大樣本量的采集及BOLD[11]等腦功能成像的應(yīng)用,我們將進(jìn)一步做動態(tài)及藥物干預(yù)研究繼續(xù)探討炎癥因子對神經(jīng)細(xì)胞代謝循環(huán)的影響。
[1]Dowlati Y,Herrmann N,Swardfager W,et al.A meta-analysis of cytokines in major depression[J].Biol Psychiatry,2010,67:446-457.
[2]Lee T,Jarome T,Li SJ,et al.Chronic stress selectively reduces hippocampal volume in rats:a longitudinal magnetic resonance imaging study[J].Neuroreport,2009,20:1554-1558.
[3]朱 彥,王冬青,李月峰,等.抑郁模型大鼠額葉及海馬對腦脊液炎癥因子敏感性的磁共振質(zhì)子波譜研究[J].中華行為醫(yī)學(xué)與腦科學(xué),2013,22:303-305.
[4]Yuksel C,Ongur D.Magnetic resonance spectroscopy studies of glutamate-related abnormalities in mood disorders[J].Biol Psychiatry,2010,68:785-794.
[5]王冬青,朱 彥,李月峰,等.首發(fā)抑郁癥患者敏感腦結(jié)構(gòu)的磁共振質(zhì)子波譜分析[J].中華行為醫(yī)學(xué)與腦科學(xué)雜志,2011,20:19-21.
[6]張朝輝,宋景貴.卒中后抑郁單胺類遞質(zhì)與睡眠的研究[J].中風(fēng)與神經(jīng)疾病雜志,2008,25(2):188-190.
[7]Einvik G,Vistnes M,Strom HH,et al.Circulating cytokine concentrations are not associated with major depressive disorder in a communitybased cohort[J].Gen Hosp Psychiatry,2012,34:262-267.
[8]Matthew H,Arun S,Meera S,et al.γ-H2AX+CD8+T lymphocytes cannot respond to IFN-α,IL-2 or IL-6 in chronic hepatitis C virus infection[J].J Hepatol,2013,58:868-874.
[9]Venkatraman TN,Krishnan RR,Steffens DC,et al.Biochemical abnormalities of the medial temporal lobe and medial prefrontal cortex in late-life depression[J].Psychiatry Res,2009,1:49-54.
[10]羅一烽,王冬青,李月峰,等.抑郁模型大鼠行為學(xué)及海馬體積變化的動態(tài)研究[J].中華行為醫(yī)學(xué)與腦科學(xué)雜志,2010,19:1102-1104.
[11]Menno P,Lucie H,Anne Z,et al.Blockade of the renin-angiotensin system and renal tissue oxygenation as measured with BOLD-MRI in patients with type 2 diabetes[J].Diabetes Res Clin Pract,2013,99:136-144.

