無溶劑體系酶催化酯化反應合成1,3-甘油二酯的研究
魯 珊, 黃健花, 王興國
(江南大學 食品學院,江蘇 無錫214122)
甘二酯,也稱為脂肪酸甘油二酯(DAG),是由丙三醇(甘油)與兩個脂肪酸酯化得到的產物,按空間異構分為 1,3-甘二酯(1,3-DAG)和 1,2-甘二酯(1,2-DAG)。其中,天然食用油脂中的甘二酯以1,3-DAG為主,占甘二酯總量的70%左右。1,3-DAG具有很好的乳化性能,可作為乳化劑廣泛應用于食品、藥品和化妝品等行業;另一方面還具有許多生理功能,可用于預防與治療高脂血癥及與高脂血癥密切相關的心腦血管疾病,近年來受到人們的廣泛關注[1-3]。
目前合成1,3-DAG主要有化學法和酶法。化學法得到高純度的產品比較困難,往往需要多步驟的反應以及繁瑣的純化操作[4]。酶法反應條件溫和,且由于酶的選擇性,較易得到高純度的1,3-DAG。角田昭等人研究了在脫水條件下利用堿性脂肪酶進行的酯化反應,反應48h酯化率達到96%,甘油二酯質量分數為60%[5]。Masakatsu[6]等人利用固定化脂肪酶作為催化劑進行酯化反應,酯化率能達到86%左右,甘油二酯質量分數可達65%,但是反應是使用的是非特異性脂肪酶,所以得到的DAG是1,3-DAG和1,2-DAG的混合物。邱壽寬等人用Lipozyme RM IM做催化劑,以大豆和甘油為底物,在最適條件下,甘二酯得率為51.7%。
作者選用特異性酶Lipozyme RM IM做催化劑,以脂肪酸、甘油為原料直接酯化生成1,3-DAG,不僅反應方便,可一步完成,且產物純度較高,反應時間較短,為進一步放大和商業化提供技術基礎。
1 材料與方法
1.1 試驗材料與儀器
Lipozyme RM IM(物理吸附大孔陰離子交換樹脂):諾維信生物技術有限公司產品;甘油(AR級):國藥化學試劑有限公司產品;油酸(AR級):國藥化學試劑有限公司產品。
Re-52型旋轉蒸發器:上海亞榮生化儀器廠產品;集熱式恒溫磁力攪拌水浴鍋:金壇市醫療儀器廠產品;Waters 1525高效液相色譜:美國Waters公司產品;TGL-16B離心機:上海安亭科學實驗儀器廠產品。
1.2 試驗方法
1.2.1 酯化方法 取16.14 g油酸,然后將油酸與甘油按一定摩爾比混合,于一定溫度、80 r/min攪拌均勻,添加一定量的固定化酶于真空反應器(真空度0.07 MPa)或常壓反應器反應一定時間。反應過程中,按一定時間間隔取樣分析反應物組成。
1.2.2 酸值的測定 按GBT 5530-2005進行。
1.2.3 酯化率的計算
酯化率(%)=[(反應起始酸價-反應物的酸價)/反應起始酸價]×100%
1.2.4 甘油酯組成分析 酯化產物用正己烷萃取,加少量水離心收集油相,吹氮氣除溶劑,HPLC分析。分析條件:Waters Spherisorb Silica色譜柱(2.0 mm×250 mm);流動相 A:正己烷-異丙醇(體積比99∶1);流動相 B:正己烷-異丙醇-乙酸(體積比 1∶1:0.01)進行梯度洗脫,柱溫:35 ℃;進樣量:5 μL;漂移管溫度:75℃;流動相流量:0.5 mL/min。檢測器:蒸發光散射檢測器,面積歸一化法定量。
2 結果與討論
2.1 反應產物組成
甘油與油酸反應后的產物組分有TAG、FFA、1,3-DAG、1,2-DAG 和 MAG,如圖 1 所示:
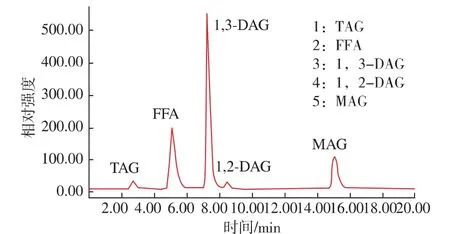
圖1 反應產物的高效液相圖Fig.1 HPLC chromatograms of reaction products
2.2 真空脫水對酯化率的影響
適宜的水分含量是維持酶活力所必須的。但當水分含量超過一定量后,脂肪酶的酯化活力會大大降低,而表現為較高的水解活力。在酶催化酯化反應過程中,會生成水,水的存在不利于平衡向酯化方向進行。因此,采用一定措施去除體系中過量的水使反應平衡向合成方向移動,不僅可以提高酶活,也可以增加酯化率。作者考察了常壓及真空條件下進行的酯化反應的進程曲線。
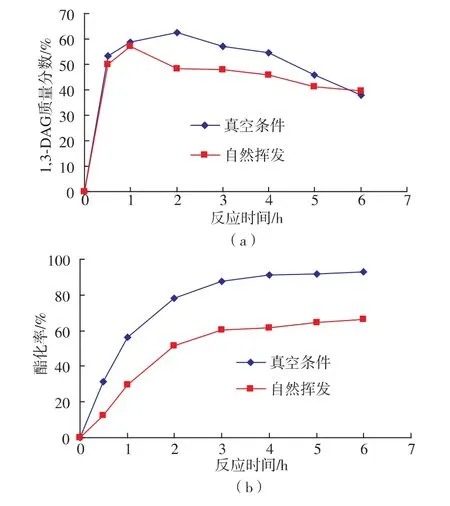
圖2 脫水對1,3-DAG質量分數和酯化率的影響Fig.2 Effect of water removal on 1,3-DAG yield and conversion rate
由圖 2可知,在常壓下,反應 2h,1,3-DAG含量和酯化率分別是48%和52%;在真空條件下,反應2h,1,3-DAG含量和酯化率分別為62%和78%。之所以有這樣的差距,可能是因為甘油是極性分子,在常溫常壓條件下甘油和脂肪酸供體之間的相容性很差,當甘油和脂肪酸供體混合后與脂肪酶接觸時,極性的甘油分子傾向于包裹在脂肪酶上而造成酶的催化效率降低[8]。由此可見,在酯化生產1,3-DAG反應中除去反應生成的水分是十分必要的。
2.3 底物摩爾比的影響
任何一種底物摩爾數的改變,都會影響體系的穩定性及產物的擴散速率與含量,從理論上脂肪酸與甘油的摩爾比例在化學計量比 (2∶1)會使1,3-DAG質量分數達到最佳。如果脂肪酸質量分數過高,則底物利用率不高;如果甘油質量分數過高,不僅使體系的黏度加大,不利于反應的進行,而且體系極性增加,甘油與脂肪酶易沉積在底部,難以與脂肪酸有效的混合,使反應速率降低[9-10]。
作者以1,3-DAG質量分數及酯化率為指標,研究了反應溫度65℃,Lipozyme RM IM添加量6%(以底物總質量計),真空脫水(0.07MPa)的條件下,油酸、甘油的摩爾比對酯化合成1,3-DAG的影響,結果如圖3所示。
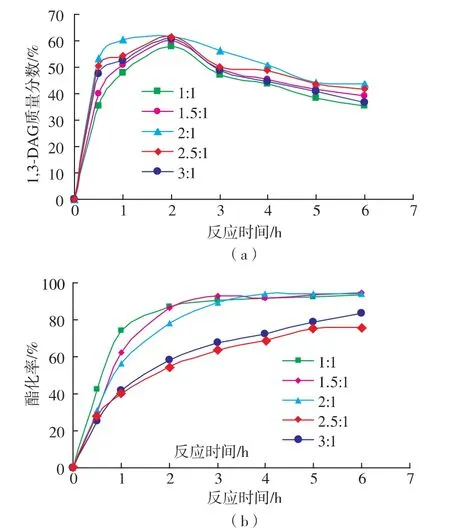
圖3 底物摩爾比對1,3-DAG質量分數和酯化率的影響Fig.3 Effect of the molar ratio on 1,3-DAG yield and conversion rate
由圖3可知,1,3-DAG質量分數隨著底物摩爾比(油酸與甘油的摩爾比)的增加而出現先上升后下降的趨勢。在底物摩爾比為2∶1時,反應2 h,1,3-DAG得率最高,可達到62%,酯化率為78%。當油酸與甘油的摩爾比例大于2∶1而小于3∶1(理論上生成TAG的比例)時,1,3-DAG得率和酯化率都會下降,這可能是因為體系中更多的油酸會趨向于轉化為TAG,所以造成DAG的得率下降,進而1,3-DAG得率會下降。因此,反應體系中底物摩爾比采用2∶1為宜。
2.4 酶量的影響
在油酸與甘油摩爾比為2∶1,反應溫度為65℃, 真空脫水 (0.07 MPa),4%、6%、8%(底物總質量計)作為酶量研究的變量條件下,考察了加酶量對1,3-DAG質量分數和酯轉化率的影響,結果見圖4。
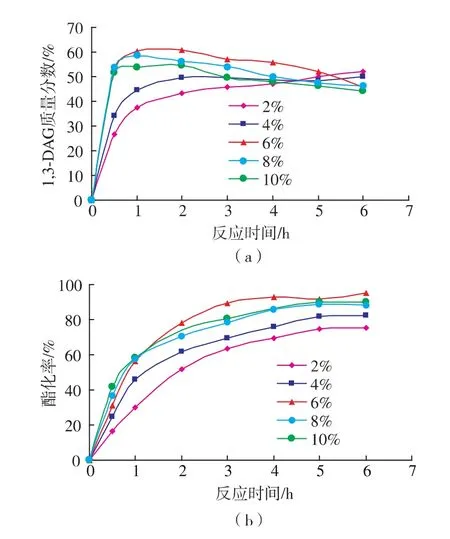
圖4 酶量對1,3-DAG質量分數和酯化率的影響Fig.4 Effect of enzyme load on 1,3-DAG yield and conversion rate
由圖4可知,當酶量從2%增加到6%時,反應到2h時,1,3-DAG質量分數從50%上升到62%;酯化率從52%上升到78%,當繼續增加酶量到10%時,1,3-DAG的質量分數和酯化率都是呈下降趨勢的,這可能是由于酶底物數量有限,達到飽和,并且固體脂肪酶量過大,反應體系流動性差,反應一定程度受阻[11]。同時發現,隨著反應時間的增加,1,3-DAG含量呈下降趨勢,而酯轉化率呈上升趨勢,當反應時間到4 h后,酯化率為94%后,基本保持不變,由此可見酯化率最高時,1,3-DAG含量并非最高,這可能是由于體系反應過程中的酰基轉移產物中1,2-DAG和TAG含量增加存在所致,因此以后的研究中酶添加量采用6%為宜。
2.5 溫度的影響
適宜的溫度控制對酶催化反應是重要的。脂肪酶來源不同,最適溫度也各不相同。一般而言溫度升高,有利于酯化反應副產物水的脫除,加快反應速率,但溫度過高,則會影響酶的空間結構和構象,從而降低酶活力。所以實驗需控制適宜的反應溫度。研究了不同的溫度對反應產物中1,3-DAG含量及酯化率的影響。如圖5所示。其他反應參數為:油酸與甘油底物摩爾比2∶1,Lipozyme RM IM添加量6%(以底物總質量計),真空脫水(0.07 MPa)。
由圖5可知,隨著溫度的升高,1,3-DAG的含量和反應初速度都是增加的,當溫度為65℃時,反應時間為2 h時,1,3-DAG的質量分數最高達到61%,酯化率為78%。當溫度高于60℃時,1,3-DAG的質量分數和反應初速度則降低。這可能是由于反應溫度升高時,物質在反應體系中的溶解度會有很大提高,體系黏度低,傳質速率就快,進而反應速度快。然而,隨著溫度的進一步升高 (溫度高于65℃),熱力學平衡占據主導地位,酰基位移增加(1,2-DAG由4.1%上升至8.9%),使1,3-DAG質量分數下降[12]。另外可以看到,隨著反應時間的增加,1,3-DAG的質量分數呈下降趨勢,當5 h后趨于平衡,而酯化率則緩慢增加,當4 h后保持不變。綜合考慮以上因素,選擇65℃作為反應溫度較佳。
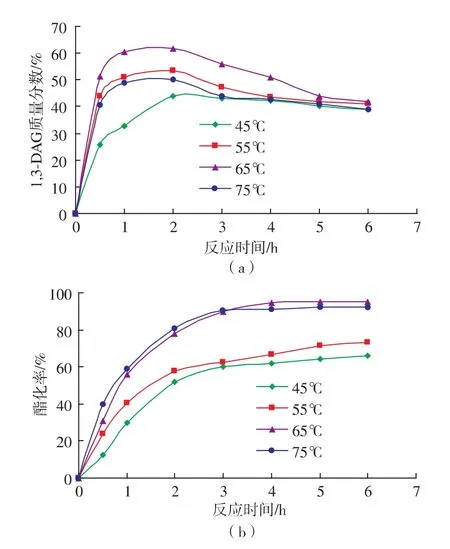
圖5 溫度對1,3-DAG質量分數和酯化率的影響Fig.5 Effect of temperature on 1,3-DAG yield and conversion rate
3 結語
采用RM IM酶催化脂肪酸與甘油合成1,3-DAG,利用真空脫水,油酸與甘油的摩爾比為2∶1,溫度為65℃,酶量為底物總質量的6%時,1,3-DAG得率最高為62%。
[1]Yang T,Zhang H,Mu H,et al.Diacylglycerols from butterfat:production by glycerolys is and short-path distillation and analysis of physical properties[J].J Am Oil Chem Soc,2004,81:979-987.
[2]Lo S K,Cheong L Z,Arifin N,et al.Diacylglycerol and triacylglycerol as responses in a dual response surface·-optimized for diacylglycerol production by lipase-catalyzed esterification in a pilot packed-bed enzyme reactor[J].J Agric Food Chem,2007,55:5595-5603.
[3]LIU Ning,WANG Yong,ZHAO Qiang-zhong,et al.Fast synthesis of 1,3-DAG by Lecitase Ultra-catalyzed esterification in solvent-free system[J].Eur J Lipid Sci Technol,2011,113:973-979.
[4]Ikeda I,Gu X P,Miyamoto I,et al.Preparation of 1,3-diacylglycerols and 1-alky-3-acylglycerols in the presence of quaternary ammonium salt[J].J Am Oil Chem Soc,1989,66:822-824.
[5]陳福明,孫登文.雙甘酯的生產及應用[J].中國油脂,1997,22(5):49-51.CHEN Fu-ming,SUN Deng-wen.The production and application of diglyceride[J].China Oils and Fats,1997,22(5):49-51.(in Chinese)
[6]翟丹丹,張建法,蔣鵬舉,等.甘油二酯的制備、純化及分析[J].河南化工,2004,5:4-6.ZHAI Dan-dan,ZHANG Jian-fa,JIANG Peng-ju,et al.Preparation,purification and analysis of diglyceride[J].China Oils and Fats,2004,5:4-6.(in Chinese)

