移居高原地區青年男性細胞遺傳學損傷的觀察分析
楊 柳,王 瑞,崔建華張占平,桂俊豪,高 亮,何 江,余伍忠*
(1.蘭州軍區烏魯木齊總醫院臨床醫學研究所,新疆 烏魯木齊830000;2.解放軍第18醫院高山病研究所,新疆 葉城844000;3.解放軍第12醫院檢驗科,新疆 疏勒844000)
在生物學和醫學領域,高原系指海拔3000m以上、能激發生物體(包括人、動植物以及微生物)能產生明顯的生物效應環境和高度。高原環境是地球上一個特殊的生態環境系統,其獨特的氣候特征引發的連鎖應激反應在系統、器官和分子細胞水平甚至基因水平均對機體具有深刻的影響[1]。目前高原醫學的研究在高原生理、急性高原病、高原肺水腫、高原營養等方面進展很快,但有關高原環境暴露的細胞遺傳學損傷影響的研究仍然有限。從細胞遺傳學及人類健康保護的角度出發,客觀評估高原惡劣環境對人體健康狀況的影響,有助于科學制定相關防護措施,有重要的經濟和國防建設意義。
本文利用外周血淋巴細胞培養技術、姐妹染色單體交換和微核生成分析技術,對移居高原地區青年男性的相關細胞遺傳學指標進行觀察分析。
1 對象與方法
1.1 研究對象 觀察組選擇駐守在海拔5000-5400米高原地區某部男性官兵67人,年齡18-25歲,分別在進入高原地區之前及一年后進行追蹤調查,因各種原因失訪16人,實際完成51人;對照組選擇同期入伍駐守海拔800米左右地區某部男性官兵53人,年齡18-25歲之間。
所有研究對象在了解內容并簽署了知情同意書后進行了相應的體格檢查和病史調查,排除放射線接觸史及其他明顯致畸因素的影響。
1.2 研究方法
1.2.1 微量外周血淋巴細胞培養及淋巴細胞微核標本制作方法與分析 采用胞質分裂阻斷微核法(Cytokinesis-block micronucleus method)檢測微核細胞。具體方法如下:將肝素抗凝靜脈血0.4ml注入含20%胎牛血清和PHA的RPMI1640培養基,37℃培養至44h,加入細胞松弛素B(Cyt-B),終濃度為4.Oμg/ml,繼續培養至72h,收獲細胞。1000 rpm離心10分鐘;棄上清,加入0.044mol/L的KCl低滲液8ml,混勻,置37℃水浴5分鐘;加入新鮮配置的Carnoy’s固定液0.3ml,混勻,靜置2分鐘;1000rpm離心10分鐘后棄上清,彈指法混勻沉淀物,再加入8mlCarnoy’s固定液,混勻,固定5 min;1000rpm離心10分鐘后棄上清,加入數滴固定液,混勻;氣干法制片,晾干;以pH6.8的PBS配置1∶10的Giemsa染液對標本染色12min,蒸餾水沖洗、晾干;微核觀察與分析:于油境下,選擇胞核、胞質完整,著色清晰的淋巴細胞,盲法觀察微核(微核的存在狀態及判斷方法:存在于胞質中、與主核完全脫離、呈圓形或橢圓形、邊緣光滑、著色與主核一致 、大小為主核1/3以下的小核)出現頻率。每一份樣本分析1000個細胞核。微核率以千分率表示。
1.2.2 姐妹染色單體交換(SCE)標本制作步驟及分析 外周血淋巴細胞接種同上,培養一開始即加入BrdU液(終濃度至10μg/ml培養液),充分混勻;以不透光黑紙包裹培養物,于暗處繼續培養50 h;加秋水仙液(終濃度至0.2μg/ml培養液)處理2 h;棄上清,加入0.044mol/L的 KCl低滲液8ml,混勻,置37℃水浴5分鐘;加入新鮮配置的Carnoy’s固定液0.3ml,混勻,靜置2分鐘;1000rpm離心10分鐘后棄上清,彈指法混勻沉淀物,再加入8ml-Carnoy’s固定液,混勻,固定5min;1000rpm離心10分鐘后棄上清,加入數滴固定液,混勻;氣干法制片,標本置室溫放置2~3天;差異化染色前1天,將標本玻片置37℃恒溫箱過夜;次日,以2×SSC液封片,水蒸氣熏蒸及紫外線照射30min均按本室常規進行,蒸餾水沖洗,4%的Giemsa液染色10min后即可。
鏡檢:選擇在加入BrdU后經過2個復制周期、姐妹染色單體差異化著色清晰、染色體分散良好、染色體數目完整且長短適宜的中期分裂相,計數發生SCE的次數。每一份標本分析40個中期分裂相,計算每個細胞的SCE平均數。SCE計數原則為:染色體末端的交換計為1次交換,短臂或長臂的中間發生的交換計為2次交換。
2 結果
結果顯示,觀察組駐守高原前微核細胞率和微核率分別為0.41±0.03和0.49±0.03,與對照組的0.43±0.06和0.53±0.07相比無顯著差異(P>0.05);駐守高原一年后觀察組的微核細胞率和微核率有明顯升高,分別為0.60±0.05和0.76±0.07,與一年前相比有顯著性差異(P<0.05),如表1示。
SCE頻率觀察組駐守高原前為6.25±1.24/細胞,分布范圍為4.1~8.9/細胞;對照組為6.61±1.29/細胞,分布范圍在4.2~8.7/細胞,兩組間無顯著性差異(P<0.05)。駐守高原一年后觀察組SCE頻率為8.93±1.52/細胞,分布范圍為4.9~10.6/細胞,與一年前相比有顯著性差異(P<0.05),如表2示。
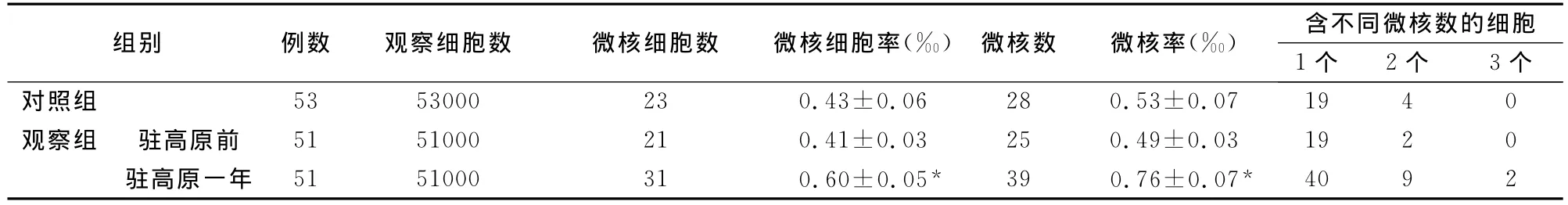
表1 移居高原地區青年男性微核率的變化
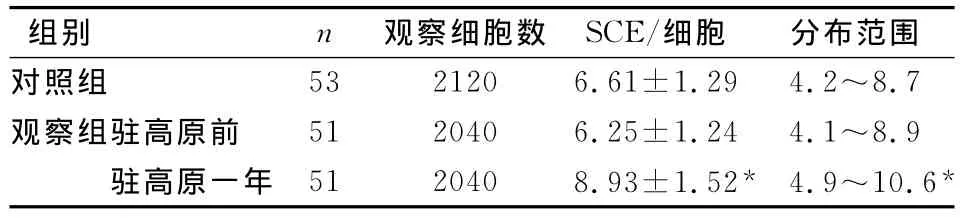
表2 移居高原地區青年男性SCE頻率的變化
3 討論
高原惡劣環境是人們進行高原作業或執行任務時不得不面臨的自然因素,高原環境對人體健康影響的不利因素主要是由于其獨特的氣候特點如空氣稀薄、氧分壓低、日光輻射強、寒冷干燥風大等,人進入高原后所處的內外環境是導致組織結構和功能變化的最主要的因素。我國高原地域遼闊,邊境線長,經濟和國防戰略地位十分重要,對移居高原人群的醫學研究尤為重要。我們在以往的研究中發現:高原環境中移居人群的染色體畸變率明顯高于低海拔地區和世居高原人群,提示高海拔地區的低氧和高本底輻射暴露是造成移居高原地區人群染色體畸變率增高的可能原因[2]。在本文中,我們采用自身前后對照的方法,選擇駐守高原的某部官兵,對移居高原地區青年男性的細胞傳學損傷指標進行觀察分析,進一步證實了上述結果。
外周血淋巴細胞微核測定是評價群體輻射效應的一種簡便而有價值的細胞遺傳學指標[3],淋巴細胞微核是細胞內染色體斷裂或紡錘絲受影響而在細胞有絲分裂后期滯留在細胞核外的染色物質。它來源于染色體斷片或有絲分裂過程中丟失的整條染色體,在有絲分裂后期不能納入子核而在細胞漿中形成單個或多個小核。微核實驗能檢測放射誘導產生的染色體完整性改變和染色體分離改變,微核率的大小直接反映染色體的損傷程度,與染色體畸變發生率呈正相關,也間接地代表受染色體損傷的狀況[4]。
我們采用胞質分裂阻斷微核法(cytokinesisblock micronucleus method)[5]對移居高原地區青年男性的微核率進行了檢測分析,結果顯示,觀察組駐守高原前微核細胞率和微核率分別為0.41±0.03和0.49±0.03,與對照組的0.43±0.06和0.53±0.07相比無顯著差異(P>0.05);駐守高原一年后觀察組的微核細胞率和微核率有明顯升高,分別為0.60±0.05和0.76±0.07,與一年前相比有顯著性差異(P<0.05),提示高原環境對移居高原人體的微核率有明顯的增加作用。
姐妹染色單體交換(sister chromatid exchange,SCE)是指兩條姐妹染色單體在相同位置上發生的同等對稱的片段交換。SCE主要在DNA復制期間形成,所代表的是同源位點復制產物間的交換,標志著染色體在DNA水平上存在不穩定性損傷。SCE頻率是檢測遺傳不穩定性和早期染色體DNA損傷極為靈敏的指標,既可用于檢測各種誘變因素和致癌因素對人體DNA的損傷,又可作為探討染色體斷裂和修復機制的良好手段。SCE頻率增高表明染色體不穩定或修復能力低下,意味著DNA受損[6]。本文結果顯示:觀察組駐守高原前SCE頻率為6.25±1.24/細胞,分布范圍為4.1~8.9/細胞;對照組為6.61±1.29/細胞,分布范圍在4.2~8.7/細胞,兩組間無顯著性差異(P<0.05);駐守高原一年后觀察組SCE頻率為8.93±1.52/細胞,分布范圍為4.9~10.6/細胞,與一年前相比有顯著性差異(P<0.05),提示高原環境可能存在引起人體DNA損傷的因素。
微核和SCE分析技術簡便、易操作,靈敏度高,現已成為遺傳毒理學中成熟的主要研究方法。本文利用可反映體內有無染色體損傷的微核試驗和反映體內有無DNA損傷的姐妹染色單體交換(SCE)試驗對移居高原的青年男性進行了細胞遺傳學評價,結果提示高原環境對移居人群具有一定的遺傳損傷作用,長期在高原環境作業可導致染色體斷裂和DNA損傷,但其詳細機制仍待進一步研究。
雖然高原醫學的研究已經取得了長足的進步和發展,但多數研究側重于高原生理、急性高原病、高原肺水腫、高原營養等方面,并且目前對高原環境所致人體損傷的生物學機理、閾值效應和健康危險度原則等尚未得到完全理解。隨著分子生物學技術和危險度評價方法的完善,將可能最終對高原暴露環境中的各種有害因素進行全面科學地評估,全面、科學地闡明高原環境暴露對人體健康的影響及其機制,并尋求改善及防治方案,提高近、遠期高原醫學防護水平,為我國高原開發和建設服務。
[1]呂偉宏,田懷軍.高原環境對男性生殖健康的影響[J].實用預防醫學,2006,(4):1090.
[2]余良寬,胡 邊,馮 靜,等.新疆高原地區塔吉克族、漢族官兵細胞遺傳學的比較分析[J].中國優生與遺傳雜志,2006,(8):33.
[3]Cerqueira EM,Santoro CL,Donozo NF,et al.Genetic damage in exfoliated cells of the uterine cervix.Association and interaction between cigarette smoking and progression to malignant transformation[J].Acta Cytol,1998,42(3):639.
[4]Patino-Garcia B,Hoegel J,Varga D,et al.Scoring variability of micronuclei in binucleated human lymphocytes in a case-control study[J].Mutagenesis,2006,21(3):191.
[5]Fenech M.The cytokinesis-block micronucleus technique:a de-tailed description of the method and its application to genotoxicity studies in human populations[J].Mutat Res,1993,285(1):35.
[6]彭 偉,湯秀明.VDT作業女性外周血淋巴細胞姐妹染色單體互換、微核及絨毛微核的研究[J].現代婦產科進展,2001.(02):86.

