腺病毒介導的shRNA下調PTEN表達對體外活化肝星狀細胞增殖與凋亡的影響*
郭 劍, 劉小娟, 張國尊, 孫慧聰, 劉林力, 郭金波, 劉 蕾, 姚冬梅, 宋 梅, 張曉嵐△
(河北醫科大學第二醫院 1消化內科,2心臟外科,河北 石家莊 050000)
1000-4718(2012)09-1627-06
2012-03-11
2012-07-10
國家自然科學基金資助項目(No.30872513);河北省自然科學基金資助項目(No.C2010000565);河北省科技廳課題平臺處項目(No.09966108D)
△通訊作者 Tel: 0311-66002955; E-mail: xiaolanzh@126.com
腺病毒介導的shRNA下調PTEN表達對體外活化肝星狀細胞增殖與凋亡的影響*
郭 劍1, 劉小娟1, 張國尊1, 孫慧聰1, 劉林力2, 郭金波1, 劉 蕾1, 姚冬梅1, 宋 梅1, 張曉嵐1△
(河北醫科大學第二醫院1消化內科,2心臟外科,河北 石家莊 050000)
目的探討腺病毒介導的shRNA下調第10號染色體缺失的磷酸酶和張力蛋白同源物基因(PTEN)表達對體外培養的大鼠活化肝星狀細胞(HSCs)增殖和凋亡的影響及其信號轉導機制。方法體外培養活化HSCs,以腺病毒為載體將靶向PTEN的shRNA干擾重組體轉染至體外活化的大鼠HSCs;四甲基偶氮唑鹽(MTT)法檢測HSCs增殖;末端轉移酶標記技術(TUNEL)及流式細胞術測定HSCs凋亡;Western blotting方法檢測PTEN、Bax、Bcl-2、Akt、p-Akt、ERK1/2及p-ERK1/2蛋白表達情況;實時熒光定量PCR方法檢測PTEN、Akt及ERK1 mRNA表達情況。結果(1) 靶向PTEN的RNA干擾重組腺病毒成功感染體外活化HSCs,并在一定范圍內呈時間依賴性地促進HSCs增殖,腺病毒感染HSCs后72 h,HSCs凋亡率顯著下降(P<0.05);(2) Bax表達降低,Bcl-2表達增加(P<0.05);(3) p-Akt和p-ERK1/2蛋白表達顯著增加(P<0.05);而Akt蛋白及其mRNA、ERK1蛋白及其mRNA表達均無顯著改變(P>0.05)。結論RNA干擾下調PTEN基因表達可能通過Bcl-2/Bax途徑促進體外活化HSCs增殖并抑制其凋亡,此外,RNA干擾下調PTEN基因表達促進p-Akt和p-ERK1/2表達增多,提示PTEN可能通過影響PI3K/Akt和ERK1/2信號通路而在調控HSCs增殖和凋亡中發揮重要作用。
肝星狀細胞; 第10號染色體缺失的磷酸酶和張力蛋白同源物基因; RNA干擾; 細胞增殖; 細胞凋亡
肝星狀細胞(hepatic stellate cells, HSCs)的活化在肝纖維化過程中發揮著重要作用[1]。如何抑制HSCs活化、增殖并誘導其凋亡是逆轉肝纖維化的關鍵所在。HSCs在增殖、活化過程中受到多種細胞內信號轉導通路的調控,作用于這些信號通路或者其中級聯反應的重要環節已成為目前防治肝纖維化的新思路。
第10號染色體缺失的磷酸酶和張力蛋白同源物基因(phosphatase and tensin homolog deleted on chromosome 10,PTEN)是迄今為止所發現的第一個具有雙重磷酸酶活性的腫瘤抑制基因,可抑制腫瘤細胞增殖,誘導腫瘤細胞凋亡[2],其蛋白產物具有脂質磷酸酶與蛋白磷酸酶雙重活性,可以負性調控磷脂酰肌醇-3激酶 (phosphoinositol- 3-kinase, PI3K)/絲氨酸-蘇氨酸蛋白激酶B(serine-threonine protein kinase B, Akt)和細胞外信號調節激酶1/2(extracellular signal-regulated kinase 1/2, ERK1/2)信號通路介導的細胞生長和轉化。已有研究發現過表達的PTEN可顯著抑制體外活化HSCs的增殖,誘導其凋亡[3- 4],但PTEN的低表達對體外活化HSCs增殖、凋亡的影響及其細胞內信號轉導機制仍需進一步明確。為此,本研究通過構建HSCs的PTEN低表達模型,觀察下調PTEN表達對活化HSCs增殖及凋亡的影響,從而為尋求治療肝纖維化的有效新靶點提供實驗基礎及理論依據。
材 料 和 方 法
1試劑與細胞系
攜帶靶向PTEN的短發卡狀RNA并表達增強型綠色熒光蛋白(enhanced green fluorescent protein, EGFP)的腺病毒(PTEN shRNA)及表達EGFP的空病毒(Ad-EGFP)由武漢市晶賽生物工程技術有限公司協助構建;小鼠抗PTEN單克隆抗體、小鼠抗Bax單克隆抗體、兔抗Bcl-2多克隆抗體、山羊抗Akt多克隆抗體、兔抗p-Akt多克隆抗體、兔抗ERK1/2多克隆抗體和兔抗p-ERK1/2多克隆抗體均購于Santa Cruz;SYBR Green Real Master Mix購于北京康為世紀生物科技有限公司;末端轉移酶標記技術(terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling, TUNEL)試劑盒購于上海碧云天生物技術有限公司;大鼠肝星狀細胞系HSCs-T6(其表型為活化的HSCs)購自中國醫學科學院北京腫瘤研究所;AD293T細胞由本實驗室長期冷凍保存。
2實驗分組
(1)對照組,僅以含10%胎牛血清的DMEM培養液培養細胞,在轉染步驟加入無血清無抗生素DMEM代替病毒液;(2)Ad-EGFP組,轉染表達EGFP的空病毒Ad-EGFP;(3)PTEN shRNA組,轉染靶向PTEN的RNA干擾重組腺病毒PTEN shRNA。
3腺病毒感染HSCs
以感染復數(multiplicity of infection,MOI)50進行腺病毒感染。確定所需病毒顆粒量(細胞數×MOI),用無血清無抗生素的DMEM稀釋病毒液并加入細胞生長的培養器皿,使病毒液均勻分布。置于37 ℃孵箱中孵育2 h,每隔15 min輕輕傾斜轉動培養器皿,促進感染;2 h后,補加適當體積完全培養基,繼續孵育到實驗所需時間,通過倒置熒光顯微鏡觀察EGFP表達。流式細胞儀檢測轉染效率達80%以上。
4直接細胞計數法繪制HSCs生長曲線
取對數生長期的HSCs,胰蛋白酶消化細胞,用含2%胎牛血清的DMEM培養液調整細胞濃度為2.0×108L-1,每孔1 mL,加入24孔培養板內,培養箱中孵育至70%~80%細胞融合時進行實驗。每組設6復孔,于0 h、24 h、48 h和72 h分別進行細胞計數,繪制細胞生長曲線。
5MTT法測定HSCs增殖
將呈指數生長的HSCs以每孔6×103個細胞接種于96孔板中,每孔體積200 μL,按上述方法進行腺病毒感染,每組6個復孔,另設陰性對照孔。分別于腺病毒感染后24 h、48 h和72 h每孔加入5 g·L-1MTT 20 μL,繼續孵育4 h,加入二甲基亞砜150 μL,酶標儀測定每孔的吸光度(absorbance,A),以無細胞培養液孔調零。細胞生長增殖率(%)=[實驗組A值-對照組A值]/對照組A值×100%。
6TUNEL法檢測HSCs凋亡
腺病毒感染HSCs后72 h,收集各組細胞爬片,應用TUNEL法按說明書操作檢測HSCs凋亡,凋亡HSCs細胞核為棕黃色。隨機選取5個高倍視野觀察,計算凋亡指數。
7流式細胞術檢測HSCs凋亡率
腺病毒感染HSCs后72 h,收集各組細胞,70%冰乙醇固定過夜,經碘化丙啶(propidium iodide, PI)染液處理后,流式細胞儀檢測HSCs凋亡率。
8Westernblotting檢測活化HSCs中PTEN、Bax、Bcl-2、Akt、p-Akt、ERK1/2和p-ERK1/2蛋白表達
腺病毒感染HSCs后72 h,提取各組細胞蛋白,考馬斯亮藍比色法測定蛋白含量。應用Western印跡技術檢測HSCs的PTEN、Bax、Bcl-2、ERK1/2、p-ERK1/2、Akt和p-Akt蛋白表達,小鼠抗PTEN單克隆抗體、小鼠抗Bax單克隆抗體、兔抗Bcl-2多克隆抗體、山羊抗Akt多克隆抗體、兔抗p-Akt多克隆抗體、兔抗ERK1/2多克隆抗體、兔抗p-ERK1/2多克隆抗體及兔抗3-磷酸甘油醛脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗體均為1∶200稀釋,采用NIH ImageJ 1.38軟件進行定量分析。以GAPDH作為內參照,結果以目的條帶和內參照的吸光度值來表示。
9實時熒光定量PCR技術檢測HSCs中PTEN、Akt和ERK1mRNA表達
腺病毒感染HSCs后72 h,按Trizol試劑盒說明提取各組細胞總RNA,電泳鑒定RNA并定量,逆轉錄合成cDNA;PTEN、Akt、ERK1及內參照GAPDH引物參照GenBank基因序列自行設計,由北京賽百盛基因有限公司合成。PTEN:上游引物5′- GGA AAG GAC GGA CTG GTG TA -3′,下游引物5′- TGC CAC TGG TCT GTA ATC CA -3′,擴增產物大小為101 bp;GAPDH:上游引物5′- GGC AAG TTC AAC GGC ACA G -3′,下游引物5′- CGC CAG TAG ACT CCA CGA CAT -3′,擴增產物大小為122 bp;Akt:上游引物5′- GAG GAG CGG GAA GAG TG -3′,下游引物5′- GAG ACA GGT GGA AGA AGA GC -3′,擴增產物大小為672 bp;ERK1:上游引物5′-TCA TAG GCA TCC GAG ACA TC-3′,下游引物5′-TGG TAG AGG AAG TAG CAG ATG-3′,擴增產物大小為148 bp。在ABI Prism 7700實時熒光定量PCR儀上進行實時定量擴增。SYBR反應體系25 μL。反應條件95 ℃ 10 min,1個循環;95 ℃ 15 s,60 ℃ 1 min,35個循環。采用相對定量2-ΔΔCt法比較目的基因mRNA的表達差異。
10統計學處理
結 果
1PTENshRNA抑制體外活化HSCs中PTEN的表達
腺病毒感染HSCs后72 h,應用實時定量RT-PCR檢測PTEN mRNA的表達。以對照組PTEN基因的表達量為1,則Ad-EGFP組、PTEN shRNA組較對照組的PTEN mRNA的相對倍數分別為0.93倍和0.63倍,PTEN shRNA組PTEN mRNA表達明顯低于對照組及Ad-EGFP組(P<0.05)。Western blotting檢測PTEN蛋白在各組細胞中的表達,PTEN shRNA組(1.11±0.03)顯著低于對照組(1.49±0.04)及Ad-EGFP組(1.48±0.02)(P<0.05),見圖1。表明shRNA可顯著抑制體外培養的活化HSCs中PTEN的表達。

Figure 1. Western blotting analysis was used to detect PTEN,Bax, Bcl-2,Akt,p-Akt,ERK1,ERK2,p-ERK1 and p-ERK2 protein expression in HSCs in different groups.
圖1Westernblotting檢測各組HSCs中PTEN、Bax、Bcl-2、Akt、p-Akt、ERK1/2及p-ERK1/2蛋白表達
2PTENshRNA促進活化的HSCs增殖
在一定時間范圍內,PTEN shRNA可呈時間依賴性地促進HSCs生長,增殖率于72 h達最高,較對照組升高22.5%;MTT檢測結果顯示,腺病毒感染活化HSCs后24 h,Ad-EGFP及PTEN shRNA對細胞增殖均無明顯作用(P>0.05)。但在48 h、72 h時PTEN shRNA可顯著刺激HSCs增殖,其增殖率分別為29.51%、43.29% (相對于對照組) (P<0.01),見圖2、表1。
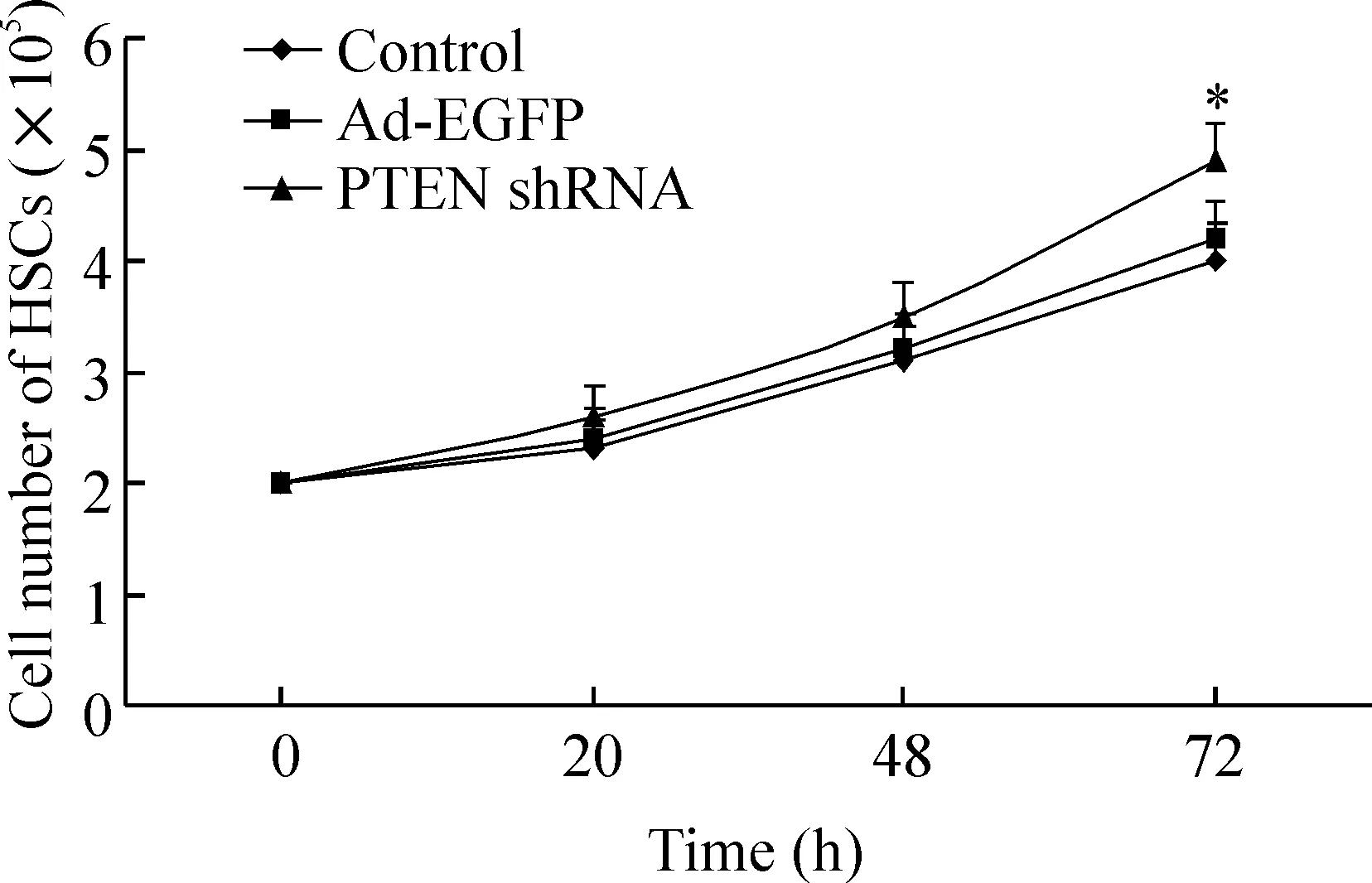

圖2直接細胞計數法繪制的不同時點HSCs的生長曲線

表1 HSCs MTT結果
**P<0.01vscontrol and Ad-EGFP.
3PTENshRNA抑制活化的HSCs凋亡
TUNEL法檢測結果顯示,腺病毒感染HSCs后72 h,PTEN shRNA組HSCs凋亡率為2.94%±0.31%,低于對照組(5.17%±0.27%)及Ad-EGFP組(5.34%±0.43%)(P<0.05)。PI標記的流式細胞術檢測結果顯示,PTEN shRNA組HSCs凋亡率(1.26%±0.18%)低于對照組(3.28%±0.42%)及Ad-EGFP組(2.95%±0.41%) (P<0.05),這表明PTEN shRNA可抑制活化的HSCs凋亡,見圖3、4。
4PTENshRNA對活化HSCsBax及Bcl-2表達的影響
Western blotting檢測腺病毒感染HSCs 72 h Bax蛋白的表達結果顯示,PTEN shRNA組(0.98±0.04)顯著低于對照組(1.29±0.03)及Ad-EGFP組(1.30±0.04)(P<0.05);而對Bcl-2蛋白的檢測結果顯示,PTEN shRNA組(1.86±0.06)較對照組(1.48±0.04)及Ad-EGFP組(1.47±0.05)顯著升高(P<0.05),對照組與Ad-EGFP組之間無顯著差異(P>0.05),見圖1。
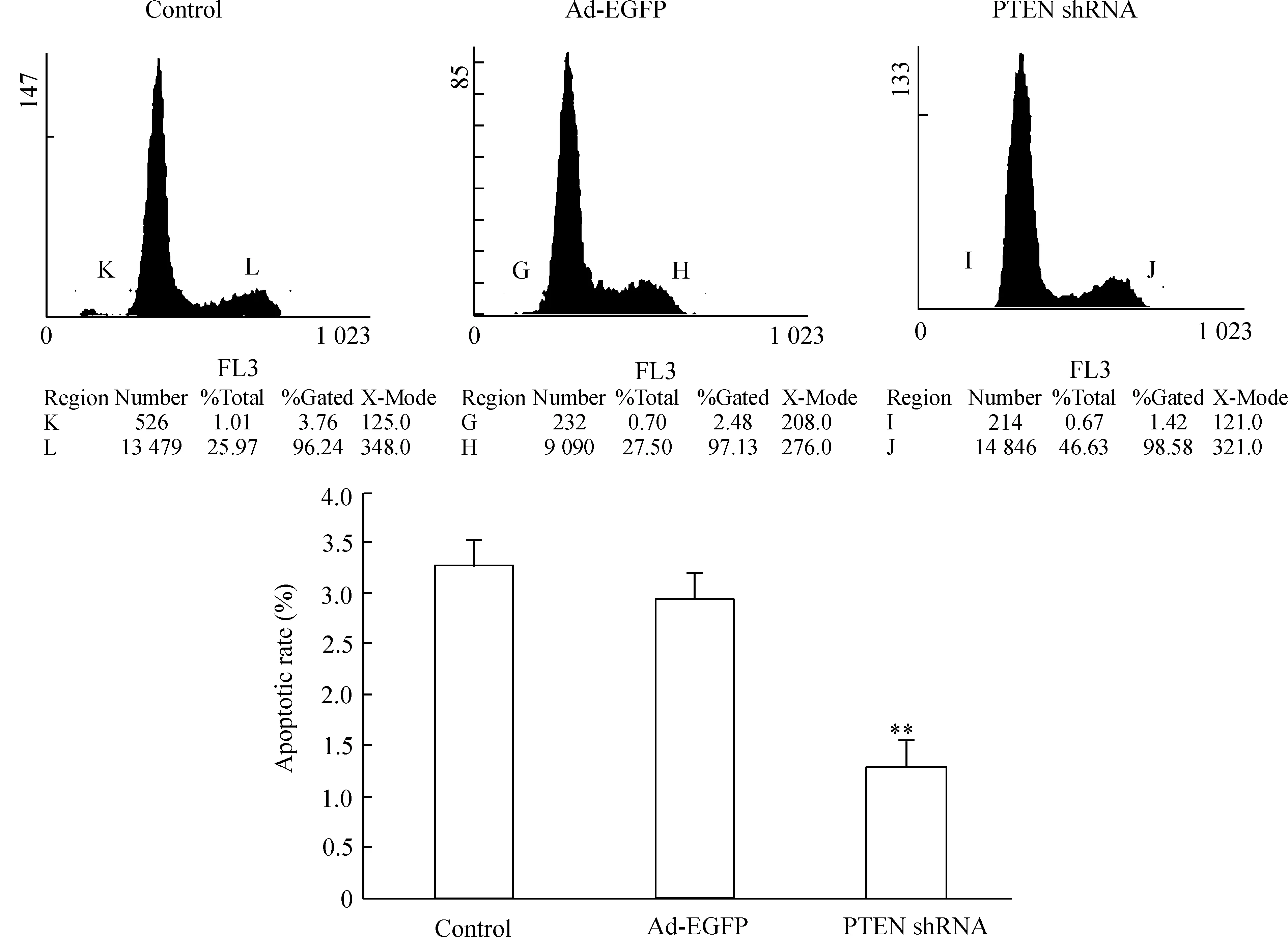

圖3流式細胞術檢測腺病毒感染肝星狀細胞72h的凋亡率


圖4TUNEL法檢測腺病毒感染肝星狀細胞72h的凋亡率
5PTENshRNA對HSCsAkt、p-Akt、ERK1/2、p-ERK1/2蛋白及AktmRNA和ERK1mRNA表達的影響
腺病毒感染HSCs 72 h,Western blotting檢測各組HSCs的Akt和ERK1蛋白表達結果顯示,Akt蛋白表達在對照組(1.05±0.02)、Ad-EGFP組(0.99±0.05)與PTEN shRNA組(1.03±0.02)間均無顯著差異(P>0.05);ERK1蛋白表達在對照組(1.11±0.03)、Ad-EGFP組(1.15±0.04)及PTEN shRNA組(1.13±0.04)之間亦無顯著差異(P>0.05);檢測HSCs中p-Akt蛋白表達結果顯示,PTEN shRNA組(1.59±0.03)顯著高于對照組(1.21±0.03)及Ad-EGFP組(1.16±0.04) (P<0.05)。p-ERK1蛋白表達顯示,PTEN shRNA組(1.20±0.02)顯著高于對照組(0.73±0.05)和Ad-EGFP組(0.81±0.04) (P<0.05),見圖1。實時熒光定量PCR檢測HSCs中Akt及ERK1 mRNA表達,以對照組Akt及ERK1 mRNA的表達量為1,則Ad-EGFP組和PTEN shRNA組相對對照組的Akt mRNA表達倍數分別為0.94倍和1.05倍,Ad-EGFP組和PTEN shRNA組相對對照組的ERK1 mRNA表達倍數分別為0.99倍和1.04倍,表明兩者在各組間均無顯著差異(P>0.05)。
討 論
PTEN蛋白是一種具有脂質磷酸酶和蛋白磷酸酶雙重活性的特異性磷酸酶,可抑制腫瘤細胞增殖,誘導腫瘤細胞凋亡。已有研究發現PTEN與腎纖維化[5]、肺纖維化、心肌纖維化[6]、肝纖維化[7]等多種纖維化疾病相關聯。本實驗構建了靶向PTEN的RNA干擾重組體,研究抑制PTEN表達后對HSCs細胞增殖及凋亡的影響。
Hettinger等[8]的研究結果表明,當抑制腫瘤細胞中PTEN表達時,可使腫瘤細胞的生存率提高,凋亡率減少。本實驗在重組腺病毒成功感染HSCs的基礎上,應用直接細胞計數法繪制生長曲線和MTT法測定了HSCs的增殖情況。其結果顯示,PTEN shRNA可在一定范圍內呈時間依賴性地促進HSCs增殖,與Hettinger等[8]的研究結果一致。
在肝損傷修復過程中,往往伴隨著活化HSCs數量的減少,而細胞凋亡則是其主要機制[9],本實驗采用流式細胞術檢測HSCs凋亡,其結果顯示:PTEN shRNA組凋亡率較對照組和Ad-EGFP組明顯降低(P<0.05)。此外采用TUNEL法也顯示:PTEN shRNA組HSCs凋亡率明顯低于對照組及Ad-EGFP組(P<0.05)。這2種方法均表明下調PTEN表達后HSCs凋亡受到抑制。細胞凋亡受到多種細胞因子的調控,其中Bcl-2家族是最重要因子之一,Bcl-2具有抑制凋亡作用,而Bax是Bcl-2的顯性抑制因子,可促進細胞凋亡[10]。本研究觀察到,PTEN shRNA成功轉染HSCs后,Bcl-2表達明顯升高,Bax表達降低,Bcl-2/Bax比值升高,從而表明在下調PTEN表達后,HSCs凋亡受到抑制,生存期延長,這提示Bcl-2/Bax升高可能是低表達的PTEN誘導活化HSCs增殖的機制之一。
磷酸化和去磷酸化在細胞內信號級聯放大系統中發揮著重要作用,而PTEN蛋白在酪氨酸和絲氨酸/蘇氨酸蛋白激酶所介導的信號轉導通路中發揮著重要作用。有研究表明PI3K/Akt和ERK1/2信號通路參與了活化HSCs增殖、凋亡及細胞周期的調控[11-12]。PTEN蛋白的脂質磷酸酶可以負性調控PI3K/Akt信號通路所介導的細胞生長,若PTEN失活,PI3K/Akt將持續活化,可導致細胞體積增大、分裂加速、凋亡阻滯[13]。而PTEN蛋白的蛋白磷酸酶活性可抑制ERK1/2上游的銜接蛋白Shc的磷酸化和Ras的活化,從而負性調控ERK1/2信號通路介導的細胞轉化和細胞周期[14]。本研究進一步研究了下調PTEN表達后HSCs的信號轉導情況,其結果顯示,采用腺病毒介導的PTEN shRNA下調PTEN的表達后,活化HSCs的Akt、ERK1蛋白及其mRNA表達均無明顯變化,但p-Akt和p-ERK1/2蛋白表達卻明顯增高,提示下調PTEN的表達后,脂質底物PIP3的去磷酸化可能受到了抑制,從而使HSCs的p-Akt表達明顯升高,PI3K/Akt信號通路得以發揮其所介導的細胞生長作用,以及下調PTEN表達后可使HSCs中ERK1/2的磷酸化水平增加,這些均表明PTEN表達降低可能通過影響PI3K/Akt和ERK1/2信號通路而參與了對活化HSCs增殖和凋亡的調控。
本研究初步證實,下調PTEN表達后可激活活化HSCs中PI3K/Akt及ERK1/2信號通路,進而導致HSCs增殖加快及凋亡減少,這與我們的前期研究以及國外學者Takashima等[15]的研究結果相一致。已有研究表明,活化的Akt可以通過使Bcl-2家族成員之一的BAD的Ser136位點磷酸化,從而使Bcl-2表達增多而發揮抗凋亡作用[16],同時也能磷酸化Bax的Ser184位點使 Bax表達減少而抑制細胞凋亡[17]。由此可見,低表達的PTEN可能通過調節PI3K/Akt信號通路中Akt的磷酸化水平進而調節Bcl-2/Bax途徑來發揮其抑制細胞凋亡的作用。然而,調控活化HSCs增殖和凋亡的細胞內信號轉導機制有多種,各種信號轉導通路之間彼此影響、相互作用,PI3K/Akt及ERK1/2信號通路僅可能是PTEN調控HSCs生理過程的信號轉導機制之一。PTEN是否還通過其它信號轉導機制來參與對HSCs增殖及凋亡的調節,還需要進一步的研究和探討。
[1] Hernandez-Gea V, Friedman SL. Pathogenesis of liver fibrosis[J]. Annu Rev Pathol, 2011,6:425-456.
[2] Wang S, Cheng Z, Yang X, et al. Effect of wild type PTEN gene on proliferation and invasion of multiple myeloma[J]. Int J Hematol, 2010,92(1):83-94.
[3] Hao LS, Zhang XL, An JY, et al. PTEN expression is down-regulated in liver tissues of rats with hepatic fibrosis induced by biliary stenosis[J]. APMIS, 2009,117(9):681-691.
[4] 郝禮森, 張曉嵐, 安君艷, 等. PTEN過表達及其突變對體外活化肝星狀細胞凋亡的影響[J]. 中華消化雜志, 2009,29(8):529-533.
[5] 張 昆, 傅淑霞, 譚會斌, 等. IgA腎病PTEN表達及其對腎間質纖維化的影響[J]. 中國病理生理雜志, 2009,25(5):984-987.
[6] 王 利, 呂安林, 趙曉梅, 等. 心血管系統中PTEN基因的研究進展[J]. 中國病理生理雜志, 2010,26(7):1428-1432.
[7] 郝禮森, 張曉嵐, 安君艷, 等. PTEN在肝纖維化大鼠肝組織中的動態表達[J]. 中國病理生理雜志, 2009,25(6):1137-1141.
[8] Hettinger K, Vikhanskaya F, Poh MK, et al. c-Jun promotes cellular survival by suppression of PTEN[J]. Cell Death Differ, 2007,14(2):218-229.
[9] Elsharkawy AM, Oakley F, Mann DA. The role and regulation of hepatic stellate cell apoptosis in reversal of liver fibrosis[J]. Apoptosis, 2005,10(5):927-939.
[10]Karamanolis DG, Kyrlagkitsis I, Konstantinou K, et al. The Bcl-2/Bax system and apoptosis in ulcerative colitis[J]. Hepatogastroenterology, 2007,54(76):1085-1088.
[11]Zhou Y, Jia X, Wang G, et al. PI-3 K/AKT and ERK signaling pathways mediate leptin-induced inhibition of PPARγ gene expression in primary rat hepatic stellate cells[J]. Mol Cell Biochem, 2009,325(1-2):131-139.
[12]Ming M, Han W, Maddox J, et al. UVB-induced ERK/AKT-dependent PTEN suppression promotes survival of epidermal keratinocytes[J]. Oncogene, 2010,29(4):492-502.
[13]Shim JH, Kim YS, Bahk YY. Proteome profile changes that are differentially regulated by lipid and protein phosphatase activities of tumor suppressor PTEN in PTEN-expressing U-87 MG human glioblastoma cells[J]. Proteomics, 2006,6(1):81-93.
[14]Leslie NR, Maccario H, Spinelli L, et al. The significance of PTEN′s protein phosphatase activity[J]. Adv Enzyme Regul, 2009,49(1):190-196.
[15]Takashima M, Parsons CJ, Ikejima K, et al. The tumor suppressor protein PTEN inhibits rat hepatic stellate cell activation[J]. J Gastroenterol, 2009,44(8):847-855.
[16]Song G, Ouyang G, Bao S. The activation of Akt/PKB signaling pathway and cell survival[J]. J Cell Mol Med, 2005,9(1):59-71.
[17]Xin M, Deng X. Nicotine inactivation of the proapoptotic function of Bax through phosphorylation[J]. J Biol Chem, 2005,280(11):10781-10789.
Effectsofadenovirus-mediatedshRNAtargetingPTENonproliferationandapoptosisofactivatedhepaticstellatecellsinvitro
GUO Jian1, LIU Xiao-juan1, ZHANG Guo-zun1, SUN Hui-cong1, LIU Lin-li2, GUO Jin-bo1, LIU Lei1, YAO Dong-mei1, SONG Mei1, ZHANG Xiao-lan1
(1DepartmentofGastroenterology,2DepartmentofCardiacSurgery,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China.E-mail:xiaolanzh@126.com)
AIM: To investigate the down-regulation of phosphatase and tensin homolog deleted on chromosome 10 (PTEN) gene by adenovirus-mediated short hairpin RNA (shRNA) on proliferation and apoptosis of activated hepatic stellate cells (HSCs)invitroand the related signaling transduction pathways.METHODSThe activated HSCs were culturedinvitroand transfected with recombinant adenovirus expressing shRNA targetingPTEN. The proliferation of HSCs was measured by MTT assay and the apoptosis was assessed by TUNEL and flow cytometry. Western blotting was used to detect the protein levels of PTEN, Bax, Bcl-2, Akt, p-Akt, ERK1/2 and p-ERK1/2 in HSCs, and real-time fluorescent quantitative PCR was applied to detect the mRNA expression of Akt and ERK1.RESULTSThe recombinant adenovirus expressing shRNA targetingPTENwas successfully transfected into activated HSCsinvitro, and significantly promoted the proliferation of HSCs in a time-dependent manner within a certain extent. The apoptotic rate of HSCs was significantly decreased 72 h after transfection (P<0.05). Meanwhile, reduced expression of Bax and elevated expression of Bcl-2 were induced 72 h after transfection (P<0.05). Furthermore, the expression of p-Akt and p-ERK1/2 were increased significantly (P<0.05), while no significant difference in the expression of Akt and ERK1 at mRNA and protein levels was observed (P>0.05).CONCLUSIONDown-regulation ofPTENby adenovirus-mediated shRNA dramatically promotes the proliferation of activated HSCs, and inhibits the apoptosis through Bcl-2/Bax pathway. In addition, the phosphorylation of Akt and ERK1/2 is increased, indicating that PI3K/Akt and ERK1/2 signal transduction pathways may play an important role in the regulation of proliferation and apoptosis of HSCs.
Hepatic stellate cells; Phosphatase and tensin homolog deleted on chromosome 10; RNA interference; Cell proliferation; Apoptosis
R363
A
10.3969/j.issn.1000-4718.2012.09.016

