鎂對哮喘患者外周血CD4 + CD25 + 調(diào)節(jié)性T 細胞凋亡及Foxp3 表達的影響*
梁瑞韻, 伍 衛(wèi), 黃 瑾, 江山平, 黃林潔, 李依群
(1中山大學孫逸仙紀念醫(yī)院呼吸內(nèi)科,廣東 廣州510120;中山大學附屬第五醫(yī)院2心內(nèi)科,3呼吸內(nèi)科,廣東 珠海519000)
支氣管哮喘(哮喘)是一種免疫失衡性疾病,既往觀點認為Th1/Th2 失衡在哮喘的發(fā)病機制中扮演著重要角色。但近年來研究發(fā)現(xiàn)CD4+T 細胞的其中一個亞群具有調(diào)節(jié)功能并參與哮喘的免疫調(diào)節(jié),其中,CD4+CD25+T 細胞的作用受到很大的關(guān)注。尤其是CD4+CD25+調(diào)節(jié)性T 細胞(regulatory T cells,Treg)紊亂導致的免疫耐受破壞在哮喘的發(fā)病機制中起著重要作用。CD4+CD25+T 細胞在哮喘發(fā)病中的作用引起了人們的廣泛關(guān)注,其作為一群調(diào)節(jié)機體免疫應答的重要細胞,本身也應存在一個被調(diào)節(jié)的過程,在人體微環(huán)境改變的情況下,CD4+CD25+T 細胞能否被調(diào)控呢?
眾所周知,鎂能緩解氣道平滑肌痙攣,使支氣管擴張。由于其有效、使用安全、副作用少,鎂劑在哮喘的應用已得到廣泛推廣。而鎂能否調(diào)節(jié)CD4+CD25+T 細胞的凋亡情況及其特殊的轉(zhuǎn)錄因子叉頭框蛋白3(forkhead box protein 3,F(xiàn)oxp3)的表達,目前未見相關(guān)報道。本實驗擬通過分離純化并培養(yǎng)健康人及哮喘患者外周血中CD4+CD25+T 細胞,以鎂劑干預后,再檢測CD4+CD25+T 細胞的凋亡情況及其Foxp3的表達情況,了解鎂對哮喘患者CD4+CD25+T 細胞的影響,以更深入地了解支氣管哮喘的發(fā)病機制,從而為支氣管哮喘的防治提供新的思路。
材 料 和 方 法
1 研究對象
健康成年人16 人,平均年齡(25 ±13)歲,男6 名,女10名,為本院健康志愿者。哮喘患者16 人,平均年齡(33 ±12)歲,男10 名,女6 名,符合《支氣管哮喘防治指南》診斷標準,為本院門診及住院病人,均未使用鎂劑或影響鎂排泄的藥物(如利尿劑)2 周以上,未使用糖皮質(zhì)激素類藥物或停用1 周以上;其中8 例為支氣管哮喘急性發(fā)作患者。
2 主要試劑和儀器
完全培養(yǎng)基包括RPMI-1640(Gibco)、10% 小牛血清(杭州四季清公司)、2 mmol/L L-谷氨酰胺、10 mmol/L HEPES、1 ×105U/L 青霉素和100 mg/L 鏈霉素;淋巴細胞分離液(1 073 g/L,上海恒信化學試劑有限公司);注射用硫酸鎂(2.5 g∶10 mL,廣州化學試劑廠,批號070402);碘化丙啶(propidium iodide,PI;Sigma);核糖核酸酶A(RNaIse A,25 mg;Sigma);鼠抗人IgG1-FITC/IgG1-PE (Becton Dickinson);CD25-FITC/CD4-PE (Becton Dickinson);鼠抗人CD8純化抗體(Becton Dickinson);Phycoerythrin-Cy5(PE-Cy5);抗人Foxp3 抗體(eBioscience);羊抗鼠IgG 免疫磁珠(goat anti-mouse IgG immunomagnetic beads,晶美生物工程有限公司);FACSCalibur 型流式細胞儀(Becton Dickinson);HERAcell CO2培養(yǎng)箱(Heraeus)。
3 方法
3.1 健康人及哮喘患者外周血CD4+CD25+T 細胞的分離及培養(yǎng) 按說明書進行,具體如下:(1)所有受試者無菌取外周靜脈血15 mL,分離、洗滌外周血單核細胞,并分離出T 淋巴細胞。(2)按2 μg∶107cells 加入鼠抗人CD8 純化抗體,反應后離心棄上清中未結(jié)合的抗體,按60 μg∶107cells 加入羊抗鼠IgG 免疫磁珠,反應后加入RPMI-1640 完全培養(yǎng)基重懸細胞,磁分離器分離,收集未被免疫磁珠結(jié)合的細胞懸液(即CD4+T 細胞)至另一干凈管中。(3)按2 μg∶107cells 加入鼠抗人CD25 純化抗體,反應、離心后棄上清中未結(jié)合的抗體,按60 μg∶107cells 加入羊抗鼠IgG 免疫磁珠,反應后加入RPMI-1640 完全培養(yǎng)基重懸細胞,磁分離器分離,收集被免疫磁珠結(jié)合的細胞懸液(即CD4+CD25+T 淋巴細胞)至另一干凈管中。(4)用24 孔板培養(yǎng),分空白組和鎂劑干預組(鎂離子終濃度為10 mmol/L),以RPMI-1640 完全培養(yǎng)基調(diào)整細胞終濃度,使每孔5 ×105cells∶1.5 mL,置37 ℃、5%CO2培養(yǎng)箱中培養(yǎng)72 h,收集0 和72 h 細胞進行相關(guān)檢測。
3.2 外周血CD4+CD25+T 細胞純度的檢測 (1)取100 μL CD4+CD25+T 細胞懸液,洗滌后在各測定管中加入CD25-FITC/CD4-PE 各20 μL,向陰性對照管中加入小鼠IgG1-FITC/IgG1-PE 單抗各20 μL,避光孵育并離心2 次。(2)于流式細胞儀(CellQuest 程序)中檢測10 000 個細胞,于FSC-SSC點圖設矩形門R1 排除碎屑,再作IgG1-FITC/IgG1-PE 點圖,設陰性對照十字門使包括左下象限95%細胞,將陰性對照圖中的十字門復制、粘貼于CD25-FITC/CD4-PE 點圖中,統(tǒng)計分析CD4+CD25+T 細胞陽性率。
3.3 CD4+CD25+T 細胞占CD4+T 細胞的比例檢測 (1)取100 μL CD4+T 細胞懸液(1 ×105細胞)加入抗CD4-PE/CD25-FITC 單抗各20 μL,避光孵育。(2)向陰性對照管中加入小鼠IgG1-FITC/IgG1-PE 單抗各20 μL,避光孵育。(3)調(diào)整細胞濃度,于流式細胞儀(CellQuest 程序)中檢測,統(tǒng)計分析CD4+CD25+T 細胞陽性率。
3.4 DNA 含量分布的流式細胞儀檢測 (1)收集細胞并離心,70%乙醇500 μL 4 ℃固定24 h 以上,以PBS 洗滌后離心2 次,加入5 g/L RNase A 10 μL,室溫避光反應后加入10 mg/L PI 染液10 μL,4 ℃避光染色。(2)調(diào)整細胞濃度,以488 nm 激發(fā)波長,于流式細胞儀(CellQuest 程序)中檢測細胞,于FSC-SSC 點圖設矩形門R1 排除碎屑,再作FL2W-FL2A 點圖及FL2A-counts 直方圖,統(tǒng)計亞二倍體峰比例變化。
3.5 Foxp3 在CD4+CD25+T 細胞表達強度的流式細胞術(shù)檢測 (1)分離外周血CD4+CD25+T 細胞后,調(diào)整細胞濃度為1 ×109/L,取100 μL 細胞懸液(1 ×105細胞)加入新配制的固定/透膜液1 mL,4 ℃避光反應60 min,洗滌2 次,離心后棄上清。(2)加入PE-Cy5 標記抗人Foxp3 抗體20 μL,4 ℃避光孵育30 min,洗滌后離心棄上清。(3)調(diào)整細胞濃度,用流式細胞儀檢測,于FSC-SSC 點圖設矩形門R1 排除碎屑,做Foxp3 直方圖并記錄其均值,CellQuest 軟件獲取并分析數(shù)據(jù)。
4 統(tǒng)計學處理
采用SPSS 13.0 軟件進行獨立樣本t 檢驗。數(shù)據(jù)以均數(shù)±標準差(±s)表示,以P <0.05 為差異有統(tǒng)計學意義。
結(jié) 果
1 外周血CD4 +CD25 +T 細胞的純度檢測
健康人外周血CD4+CD25+T 細胞的純度為77.4% ~92.3%,哮喘患者CD4+CD25+T 細胞的純度為75.2% ~93.8%,見圖1。

Figure 1. Purity of CD4 +CD25 +T cells detected by flow cytometry. A,B:heath group;C,D:asthma group.圖1 外周血CD4 +CD25 +T 細胞純度的流式細胞儀檢測
2 CD4 +CD25 +T 細胞占外周血CD4 +T 細胞的比例
在健康人中的比例為4.12% ~7.98%,在哮喘患者中的比例為4.51% ~8.68%,流式細胞術(shù)檢測見圖2,兩者相比,差異沒有統(tǒng)計學意義(P >0.05)。

Figure 2. Ratio of CD4 +CD25 +T of CD4 +T cells detected by flow cytometry.A,B:health group;C,D:asthma group.圖2 外周血CD4 +CD25 +T 占CD4 +T 細胞比例的流式細胞術(shù)檢測
3 鎂(10 mmol/L)對健康人及哮喘患者外周血CD4 +CD25 +T 細胞Foxp3 表達的影響
經(jīng)鎂(10 mmol/L)干預后,哮喘組CD4+CD25+T 細胞培養(yǎng)72 h,F(xiàn)oxp3 表達強度與健康對照組相比,P >0.05,提示鎂(10 mmol/L)對哮喘組外周血CD4+CD25+T 細胞的Foxp3 表達無影響,見圖3。
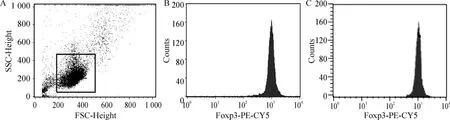
Figure 3. Foxp3 expression in CD4 +CD25 + T cells after magnesium treatment detected by flow cytometry.A:evacuation of the debris;B:Foxp3 expression in asthma group;C:Foxp3 expression in health group.圖3 鎂處理后外周血CD4 +CD25 + T 細胞Foxp3 表達的流式細胞術(shù)檢測
4 鎂(10 mmol/L)對外周血CD4 +CD25 +T 細胞凋亡的影響
經(jīng)鎂(10 mmol/L)干預后,CD4+CD25+T 細胞培養(yǎng)72 h,流式細胞術(shù)檢測凋亡率見圖4,健康組與哮喘組分別與陰性對照組相比,P <0.05,提示鎂(10 mmol/L)可以誘導健康人及哮喘患者外周血CD4+CD25+T 細胞凋亡率增加,見表1,而鎂(10 mmol/L)干預組的72 h 外周血CD4+CD25+T 細胞的凋亡率在哮喘組與健康組中沒有顯著差異(P >0.05)。

Figure 4. Apoptosis of CD4 +CD25 + T cells after magnesium treatment detected by flow cytometry.A,B:evacuation of the debris;C:asthma group;D:health group.圖4 鎂處理后外周血CD4 +CD25 + T 淋巴細胞凋亡的流式細胞術(shù)檢測
表1 鎂對外周血CD4 +CD25 +T 細胞凋亡率的影響Table 1. Effects of magnesium (10 mmol/L)on apoptotic rate of CD4 +CD25 +T cells (%. ±s.n=12)

表1 鎂對外周血CD4 +CD25 +T 細胞凋亡率的影響Table 1. Effects of magnesium (10 mmol/L)on apoptotic rate of CD4 +CD25 +T cells (%. ±s.n=12)
* P <0.05,**P <0.01 vs blank.
Group Asthma Health Magnesium 11.68 ±4.91** 10.76 ±3.77*Blank 8.07 ±4.90 8.83 ±4.25
討 論
鎂離子(magnesium ion,Mg2+)抑制鈣內(nèi)流,減少細胞內(nèi)鈣離子濃度,拮抗鈣離子對支氣管平滑肌的作用,從而使支氣管擴張;鎂離子使運動神經(jīng)末梢乙酰膽堿的釋放量減少,對抗乙酰膽堿對平滑肌細胞的興奮作用,直接舒張平滑肌,改善氣道狹窄,從而改善肺的通氣和換氣功能;臨床實驗證明硫酸鎂還可降低氣道高反應性,抑制非特異性炎癥反應,預防及改善哮喘患者的氣道重塑,提高其氣流受限的可逆化程度,從而預防和緩解哮喘癥狀[1-2]。在本課題組的前期研究中,亦證實應用鎂劑可明顯改善哮喘患者的肺功能[3],細胞內(nèi)鎂缺乏的C57BL/6 哮喘小鼠肺組織β2受體表達減少,在激動劑作用下更易發(fā)生β2受體低調(diào)節(jié)[4]。
目前對支氣管哮喘免疫調(diào)節(jié)方面的研究已成為熱點,近年來認為CD4+T 細胞除了Th1、Th2 等外還包括多種調(diào)節(jié)性T 細胞亞群,均在哮喘患者的免疫調(diào)節(jié)中起重要作用。Treg是指能夠控制或抑制其它細胞功能的T 細胞群體,其中CD4+CD25+Treg 最受關(guān)注,是通過胸腺產(chǎn)生的功能成熟的T細胞亞群,約占外周血中CD4+T 細胞的5% ~10%[5],是Treg 的主要組成部分。目前多個研究表明,CD4+CD25+Treg的數(shù)量或功能異常有可能導致多種自身免疫性疾病的發(fā)生[6-7],因此對CD4+CD25+Treg 的研究有重要意義。然而對CD4+CD25+Treg 還缺乏足夠的認識,其作用機制及免疫生物學特性尚有許多不明之處,如能在體內(nèi)外有效誘導、擴增和控制CD4+CD25+Treg 數(shù)量或調(diào)節(jié)其細胞功能,將會為支氣管哮喘的治療提供新思路。
本實驗中,CD4+CD25+T 細胞占外周血CD4+T 細胞的比例在健康人和哮喘患者中的比例無統(tǒng)計學差異,可能與本文選用的哮喘患者部分為非急性發(fā)作患者有關(guān),但經(jīng)鎂劑處理后,健康組和哮喘組的CD4+CD25+Treg 凋亡均增加,哮喘組的凋亡率高于健康組,但由于哮喘急性發(fā)作者數(shù)量少(只有8 例),故差異不顯著,但仍然提示適當補充鎂劑對于CD4+CD25+Treg 的凋亡有正調(diào)節(jié)作用,可能對于哮喘急性發(fā)作患者作用尤為明顯。
近年研究認為轉(zhuǎn)錄因子Foxp3 是CD4+CD25+Treg 的一個相對特異性標記,與其的發(fā)育和功能有關(guān)[8],F(xiàn)oxp3 作為一特殊的轉(zhuǎn)錄因子特異地高表達于CD4+CD25+T 細胞,有研究認為其數(shù)量可以反映CD4+CD25+T 細胞的水平和功能活性[9]。但也有研究認為Foxp3 對于CD4+CD25+Treg 的產(chǎn)生或活化是必需的,但不足以影響其功能,可能還存在其它因素的調(diào)節(jié)[10]。
本實驗中,硫酸鎂可以誘導健康人及哮喘患者外周血CD4+CD25+T 細胞72 h 的凋亡率增加,但不影響Foxp3 的表達,表明硫酸鎂調(diào)節(jié)凋亡的作用與機體的疾病狀態(tài)(哮喘)不相關(guān),具有廣泛調(diào)節(jié)作用,有可能應用于其它免疫相關(guān)疾病,而且與Foxp3 的表達不相關(guān)。本文進行了離體細胞鎂劑共培養(yǎng)的實驗,但未進行鎂劑治療哮喘的人體試驗以及動物實驗,有待下一步的研究以證實鎂劑治療哮喘的作用機制之一為調(diào)節(jié)CD4+CD25+T 細胞的凋亡。
[1] Jones LA,Goodacre S. Magnesium sulphate in the treatment of acute asthma:evaluation of current practice in adult emergency departments[J]. Emerg Med J,2009,26(11):783-785.
[2] Bichara MD,Goldman RD. Magnesium for treatment of asthma in children[J]. Can Fam Physician,2009,55(9):887-889.
[3] 江山平,李依群,曾志勇,等.以等滲硫酸鎂溶液為溶媒吸入沙丁胺醇對哮喘發(fā)作期患者肺功能的影響[J].中華內(nèi)科雜志,2002,41(1):54-55.
[4] 張 蔚,江山平,李元廣,等.C57BL/6 哮喘小鼠細胞內(nèi)鎂含量與肺組織β2受體mRNA 表達的相關(guān)性研究[J].中國病理生理雜志,2008,24(7):1394-1398.
[5] Picca CC,Caton AJ.The role of self-peptides in the development of CD4+CD25+regulatory T cells[J]. Curr Opin Immunol,2005,17(2):131-136.
[6] 莊 鵬,王湘郴,羅國輝,等. 慢性乙肝患者外周血CD4+CD25+FOXP3+Tregs 及HBV 抗原特異性CTLs 的檢測和分析[J]. 中國病理生理雜志,2011,27(9):1786-1789.
[7] 汪禮坤,匡 銘,彭寶崗,等. Tregs 調(diào)節(jié)小鼠肝癌局部引流淋巴結(jié)內(nèi)免疫效應細胞的功能[J]. 中國病理生理雜志,2010,26(5):922-927.
[8] Yi H,Zhen Y,Jiang L,et al. The phenotypic characterization of naturally occurring regulatory CD4+CD25+T cells[J]. Cell Mol lmmunol,2006,3(3):189-195.
[9] 陳莉娟,周 浩,朱劍文,等. Foxp3 轉(zhuǎn)染小鼠CD4+CD25-T 細胞抑制NK 細胞活性[J]. 中國病理生理雜志,2009,25(6):1151-1155.
[10] Brunkow ME,Jeffery EW,Hjerrild KA,et al. Disruption of a new forkhead/winged-h(huán)elix protein,scurfin,results in the fatal lymphoproliferative disorder of the scurfy mouse[J]. Nat Genet,2001,27(1):68-73.

