葡萄糖對人臍靜脈內皮細胞蛋白C受體表達的影響及吡格列酮的干預作用
郭小芳, 劉海波, 任惠龍, 陳宏衛, 賴靜波, 龔維坤, 成興波, 盧國元
(鄞州人民醫院 1內分泌科, 2心內科,浙江 寧波 315040;蘇州大學附屬第一醫院 3內分泌科, 4腎內科,江蘇 蘇州 215006)
1000-4718(2012)09-1565-06
2012-03-29
2012-07-13
△通訊作者 Tel:0574-87016961;E-mail:liuhaibo79@eyou.com
葡萄糖對人臍靜脈內皮細胞蛋白C受體表達的影響及吡格列酮的干預作用
郭小芳1,3, 劉海波2△, 任惠龍1, 陳宏衛1, 賴靜波1, 龔維坤1, 成興波3, 盧國元4
(鄞州人民醫院1內分泌科,2心內科,浙江 寧波 315040;蘇州大學附屬第一醫院3內分泌科,4腎內科,江蘇 蘇州 215006)
目的研究葡萄糖對人臍靜脈內皮細胞蛋白C受體(EPCR) mRNA 表達的影響,以及吡格列酮的干預作用。方法體外培養人臍靜脈內皮細胞(HUVECs),分別以流式細胞術和RT-PCR技術確認HUVECs膜上EPCR的表達水平和 mRNA 水平的表達。再分別以含不同濃度D-葡萄糖(5、10、30、50 mmol/L)的培養基以及含吡格列酮(5、10、20 μmol/L)或不含吡格列酮的高糖(50 mmol/L)培養基孵育HUVECs 24 h,行劑量和時間依賴性實驗,并采用實時定量PCR技術測定HUVECs細胞 EPCR mRNA 的表達。結果隨著培養基D-葡萄糖濃度的增加,HUVECs培養24 h后其EPCR mRNA 的表達逐漸下調。在采用吡格列酮干預后, 50 mmol/L高糖處理的HUVECs EPCR mRNA 表達的下調得到明顯改善。結論(1)EPCR 在HUVECs上高表達,高糖可通過下調EPCR mRNA 的表達而損傷內皮細胞功能。(2)吡格列酮可阻止高糖誘導的HUVECs EPCR mRNA表達的下調,從而保護內皮細胞功能。
內皮細胞; 葡萄糖; 吡格列酮; 內皮細胞蛋白C受體
高血糖是糖尿病(diabetes mellitus,DM)大血管并發癥發生發展的主要危險因素,而糖尿病血管并發癥的發生與內皮功能受損密切相關[1],內皮功能受損后可引起凝血活化及一系列的炎癥反應[2],從而參與動脈粥樣硬化(atherosclerosis,AS)的進程。因此減少血管內皮功能損傷,對防治糖尿病血管并發癥具有重要的臨床意義。 內皮細胞蛋白C受體(endothelial cell protein C receptor,EPCR) 是近年發現的蛋白C(protein C,PC)系統的一個新成員,主要表達于內皮細胞,它能與PC特異性結合,使PC活化效率提高5倍,而發揮抗凝作用[3]。同時有研究表明EPCR也有重要的抗炎作用[4]。因此,EPCR在維持血管內皮功能中發揮著重要的作用。 吡格列酮(pioglitazone)是近年來發現的一類新型口服胰島素增敏劑,已有研究表明吡格列酮具有抗炎及保護內皮功能的作用[5],但其具體機制尚不十分清楚。 本研究通過體外培養人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVECs),初步探討高糖對HUVECs EPCR mRNA 表達的影響,以及吡格列酮對高糖造成的內皮細胞 EPCR mRNA 表達下調的改善作用,探討糖尿病大血管病變及吡格列酮保護血管內皮功能的新機制,為糖尿病血管并發癥的防治提供新的思路。
材 料 和 方 法
1材料
1.1藥物與試劑 RPMI-1640 培養基購自Gibco;小牛血清、胎牛血清購自杭州四季青公司;瓊脂糖購自Amresco;胰酶購自 Difcd;FITC-羊抗鼠Ⅱ抗購自Immunotech; Trizol 購自Invitrogen;DEPC購自BBI; M-MLV、隨機引物和 dNTP購自Promega;RNA 酶抑制劑(RNasin)購自上海華美生物技術公司;Taq 酶購自上海晶美生物工程有限公司;D-葡萄糖為國產分析純; HUVECs(ECV304)為蘇州大學附屬第一醫院血栓與止血研究室凍存細胞株;鼠抗人 EPCR 多克隆抗體由王迎春教授惠贈;吡格列酮儲存液由蘇州大學附屬第一醫院心內科王育林博士惠贈。鼠抗人單克隆β-actin 購自 Sigma。
1.2主要儀器 Ex TaqTMR-PCR Version 2.1 購自大連寶生物公司;Eva Green 購自Biotium;流式細胞儀 Cytomics FC500 購自 Beckman Coulter;實時定量(real-time) PCR 儀 MJ Research Opticon2TM購自MJ Research;PCR 引物由上海生物工程有限公司合成。
2方法
2.1HUVECs的培養 復蘇HUVECs細胞,用含 15%小牛血清的 RPMI-1640 培養基在 37 ℃、5%CO2條件下培養。2~3 d換液1次,并按合適密度傳代。將HUVECs細胞以 1×108/L密度接種于 6 孔板中,用含 15%小牛血清的 RPMI-1640 培養基在 37 ℃、5% CO2條件下培養 24 h,在高倍顯微鏡下觀察,發現細胞貼壁生長,并有 80%~90%融合。再用無血清的 RPMI-1640 培養基替換完全培養基,37℃、5% CO2條件下孵育過夜。
2.2實驗分組 實驗一 : HUVECs細胞用含D-葡萄糖的低血清(含 3%小牛血清)RPMI-1640 培養基培養 24 h,觀察不同D-葡萄糖濃度(5 mmol/L 、10 mmol/L、30 mmol/L、50 mmol/L)時 EPCR mRNA 的表達;同時以 D-葡萄糖濃度為 50 mmol/L 的低血清(含 3%小牛血清)RPMI-1640 培養基培養HUVECs細胞,觀察不同時點(0.5 h、3 h、6 h、12 h、24 h)時 EPCR mRNA 的表達。以相同時間的不加刺激劑組為對照。實驗二: HUVECs細胞先以含不同濃度(5 μmol/L、10 μmol/L、20 μmol/L)吡格列酮的低血清(含 3%小牛血清)RPMI-1640 培養基培養 6 h,然后置于含 50 mmol/L葡萄糖的新鮮低血清(含 3%小牛血清)RPMI-1640 培養基中孵育至 24 h。同時以相同時間的不加刺激劑組為空白對照,以相同時間含 50 mmol/L 葡萄糖的低血清(含 3%小牛血清)RPMI-1640 培養基培養 24 h 組為陽性對照。每個實驗組設 5 復孔,每次實驗重復 3 次。
2.3流式細胞儀檢測EPCR在HUVECs細胞的表達 采用流式細胞儀技術檢測HUVECs細胞膜上 EPCR 的表達。生長至 80%融合的細胞以 0.25%胰酶消化,收集細胞,保證細胞數達到 1×109/L,1×PBS 洗滌3次;每管加 200 μL 1×PBS,重懸;均勻分成2管,其中一管加入 20 μL 鼠抗人 EPCR Ⅰ抗(1 μg∶20 μL),另一管加入 20 μL 1×PBS 作為空白對照;4 ℃ 濕盒中反應 1 h;離心、棄上清,1×PBS 洗滌3次,每管加 250 μL 1×PBS,重懸;每管加入 10 μL FITC-羊抗鼠Ⅱ抗(1 μg∶10 μL),黑暗處反應 30 min;離心、棄上清,1×PBS 洗滌3次,每管加 250 μL 1×PBS,重懸;流式細胞儀上檢測。
2.4采用逆轉錄-聚合酶鏈反應(reverse transcription-polymerase chain reaction,RT-PCR)和實時定量PCR(real-time quantitative PCR)技術檢測EPCR mRNA的表達。
2.4.1總RNA抽提 利用Trizol試劑從各組HUVECs中提取總RNA,紫外分光光度計測定A260/A280為1.8~2.2,并將 mRNA 濃度調整至 0.5 g/L。
2.4.2逆轉錄反應 取mRNA 3 μg,隨機引物 2 μL,加 DEPC 水補足反應總體積至 15 μL,65 ℃ 變性 5 min 后立即冰浴;加 M-MLV 1 μL、 緩沖液 8 μL 、RNasin 0.5 μL 和 dNTP 1.25 U,加 DEPC 水補足反應總體積至 25 μL,37 ℃ 1 h 后,95 ℃ 5 min滅活逆轉錄酶。
2.4.3聚合酶鏈反應(polymerase chain reaction,PCR) β-actin上游引物5’-CTCGCGCTACTCTCTCTTTC-3’,下游引物5’-CAGTCTCGATCCCACTTAA-3’,擴增片段330 bp。EPCR 上游引物 5’-ATTGCTGCCGATACTGCT-3’,下游引物5’-AGAGGAAAGGCCAAGGTC-3’,擴增片段318 bp。以上序列由上海生物工程有限公司合成。以β-actin(330 bp)作內參照。反應條件:EPCR為 94 ℃ 4 min 后開始循環,94 ℃ 40 s→58 ℃ 40 s→72 ℃ 40 s,共 30 個循環,最后72 ℃ 10 min;β-actin 為 94 ℃ 4 min 后開始循環,94 ℃ 40 s→58 ℃ 40 s→72 ℃ 40 s,共 28 個循環,最后 72 ℃ 10 min。反應后 1.5%瓊脂糖凝膠上樣,電泳鑒定結果。
2.4.4實時定量PCR 反應體系:5×buffer 5 μL,Mg2+(250 mmol/L)0.25 μL,dNTP(10 mmol/L)0.75 μL,Taq酶(250 U∶50 μL) 0.25 μL,上游引物(10 mmol/L) 0.5 μL,下游引物 (10 mmol/L) 0.5 μL,Evagreen(10 mmol/L) 0.5 μL,雙蒸水 15.45 μL,cDNA 2 μL,共 25 μL 體系;反應條件:95 ℃ 5 min 預變性,95 ℃ 15 s→58 ℃ 25 s→72 ℃ 25 s→78 ℃ 0.1 s;讀板;50 個循環;60 ℃~96 ℃ 0.3 s 熔解曲線;72 ℃ 5 min;4 ℃,forever。結果計算公式:(1)相對量=2-ΔCt,ΔCt=目的基因 Ct-內參基因 Ct;(2)實驗組∶對照組的相對量=2-ΔΔCt,ΔΔCt=實驗組ΔCt-對照組ΔCt。
3統計學處理
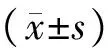
結 果
1流式細胞術檢測結果
EPCR在HUVECs表面高表達,為96.5%,見圖1。

Figure 1. The expression of EPCR protein in HUVECs was confirmed by flow cytometry. A: HUVECs control, treated with PBS; B: HUVECs test, treated with mouse anti-human EPCR antibody.
圖1流式細胞術檢測EPCR在HUVECs表面的表達
2RT-PCR結果
RT-PCR結果顯示HUVECs細胞膜上有較高的EPCR mRNA表達,見圖2。
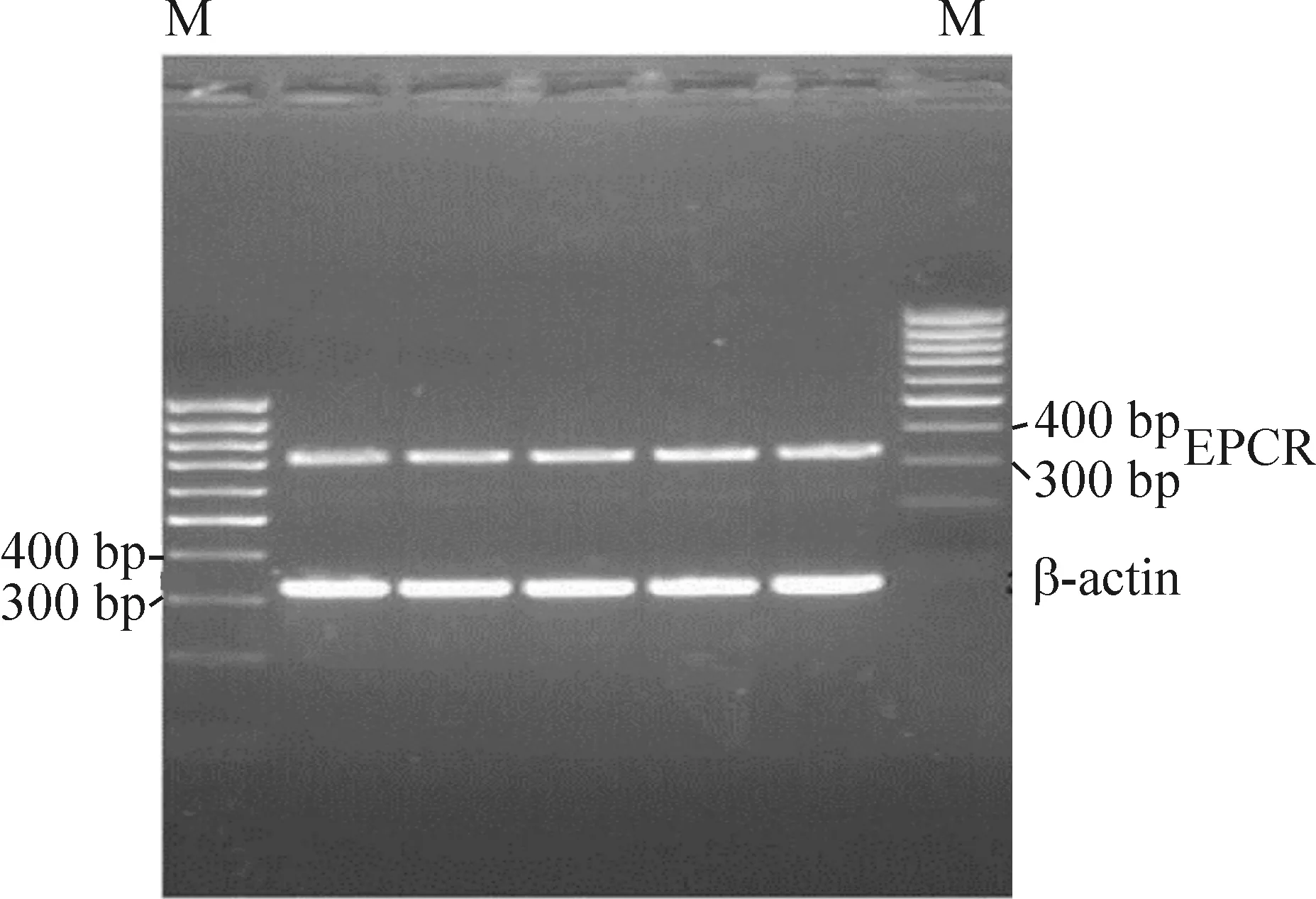
Figure 2. The expression of EPCR mRNA in HUVECs was confirmed by reverse transcription-polymerase chain reaction (RT-PCR) technique. M:marker;EPCR:318 bp;β-actin:330 bp.
圖2HUVECs細胞EPCRmRNA的表達
3D-葡萄糖和吡格列酮對HUVECs細胞EPCRmRNA表達的影響
3.1相同時間不同濃度D-葡萄糖對HUVECs EPCR mRNA的影響 已80%融合的HUVECs細胞中加入D-葡萄糖使其濃度分別達5 mmol/L、10 mmol/L、30 mmol/L和50 mmol/L,以低血清(含 3%小牛血清)RPMI-1640 培養基培養HUVECs細胞為空白對照。24h后EPCR mRNA水平分別是空白對照組(100%)的(93.58±0.96)%(P>0.05)、(91.42±0.13)%(P>0.05)、(85.14±0.56)%(P<0.05)和(65.02±0.62)%(P<0.01),高糖明顯下調HUVECs細胞EPCR mRNA的表達(P<0.05)。EPCR mRNA 的表達隨加入D- 葡萄糖濃度的增加而逐漸減少,在 D- 葡萄糖濃度為30 mmol/L和50 mmol/L時EPCR mRNA的表達呈顯著下降(P<0.05),并呈劑量依賴性,見圖3。
3.2相同濃度D-葡萄糖不同時間培養HUVECs對EPCR mRNA的影響 加入50 mmol/L D-葡萄糖分別培養HUVECs細胞0.5 h、3 h、6 h、12 h和24 h。與空白對照組(100%)相比,0.5 h、3 h和6 h時EPCR mRNA水平分別為(95.68±0.76)%、(95.62±0.56)%和(92.58±0.58)%,但與對照組相比無顯著差異(P>0.05);12 h和24 h時EPCR mRNA水平分別為(82.96±0.89)%(P<0.05)和(64.78±0.86)%(P<0.01),D-葡萄糖對EPCR mRNA表達的影響呈時間依賴性,見圖4。
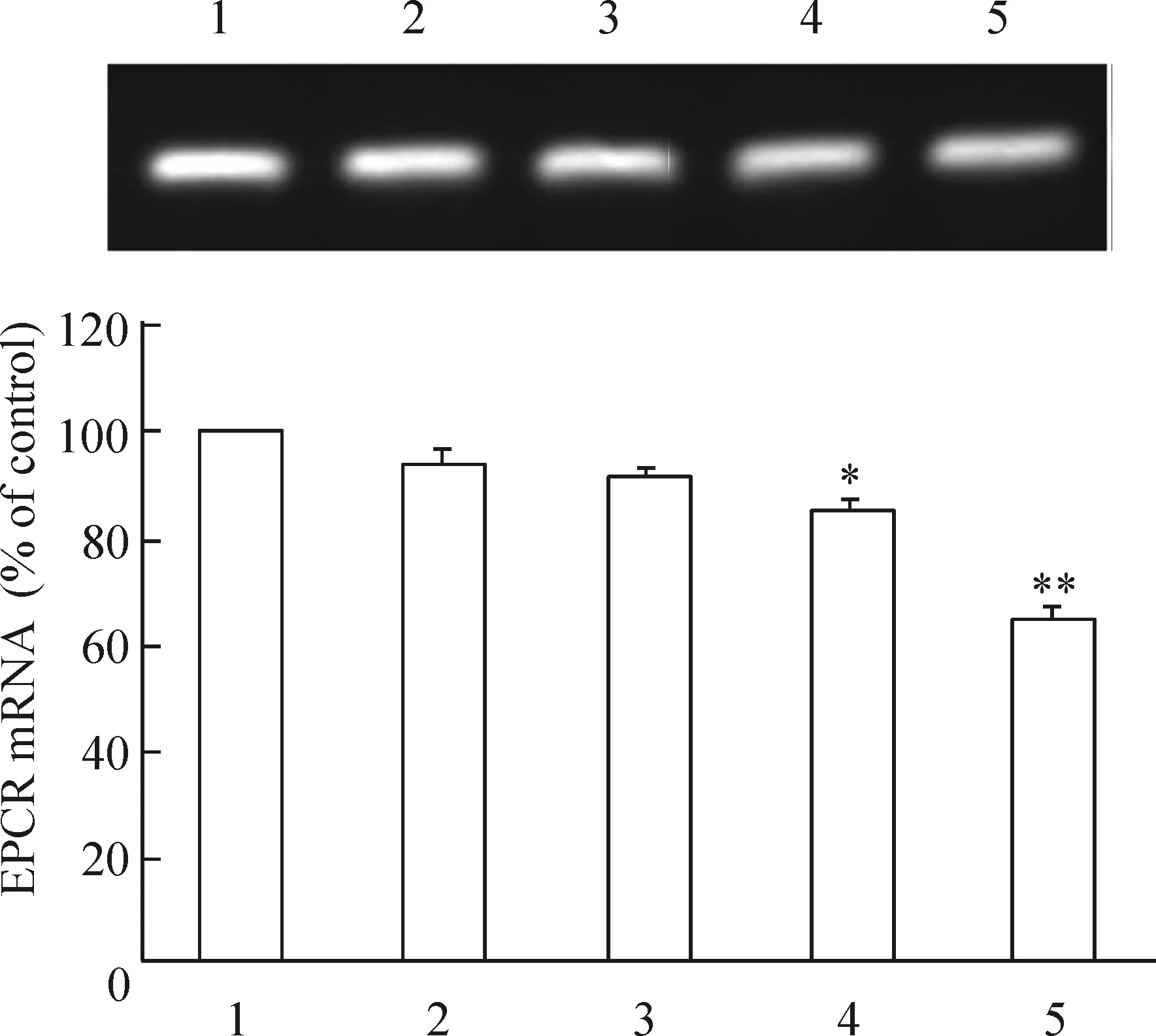

圖3不同濃度D-葡萄糖對EPCRmRNA表達的影響
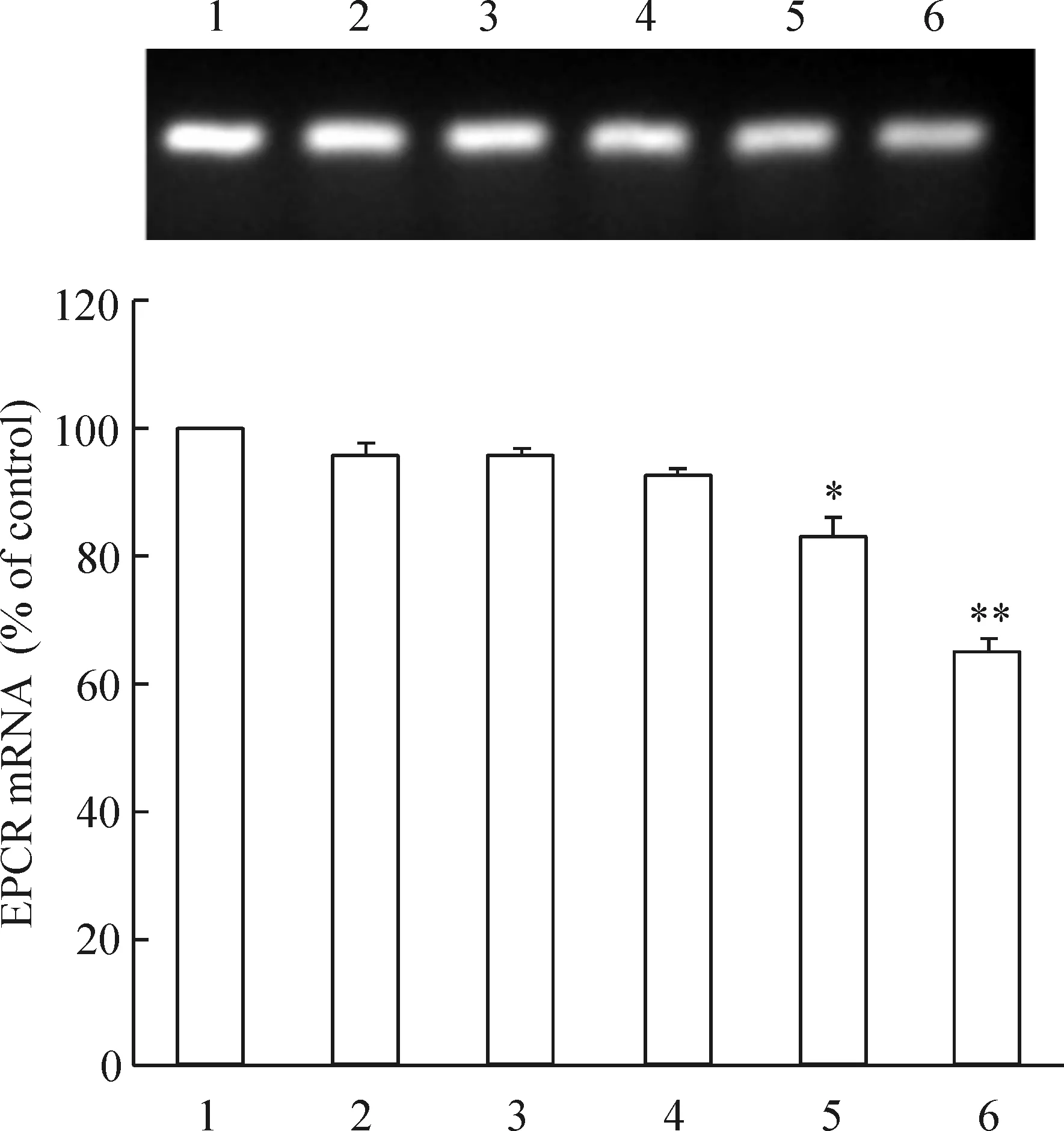
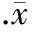
圖4不同時間相同濃度D-葡萄糖對EPCRmRNA表達的影響
3.3不同濃度吡格列酮預處理對HUVECs EPCR mRNA表達的影響 HUVECs細胞生長至80%融合后分為5組,分別為低血清(含 3%小牛血清)RPMI-1640培養基培養的空白對照組、僅加50 mmol/L D-葡萄糖的陽性對照組和以不同濃度吡格列酮(5 μmol/L、10 μmol/L及20 μmol/L)預處理的實驗組。實驗組加入不同濃度吡格列酮預作用6 h,然后換新鮮的含50 mmol/L D-葡萄糖的培養基孵育至24 h。其中以空白對照組EPCR mRNA的表達設為100%,陽性對照組EPCR mRNA的表達為(65.50±0.81)%,不同吡格列酮濃度(5 μmol/L、10 μmol/L和20 μmol/L)預處理后其EPCR mRNA的表達分別為(72.82±0.46)%、(76.60±1.59)%和(82.60±0.57)%(與對照組比)。高糖刺激下HUVECs細胞EPCR mRNA表達明顯降低,適宜濃度的吡格列酮預處理HUVECs細胞能顯著改善高糖對EPCR mRNA表達的下調作用(P<0.05),見圖5。
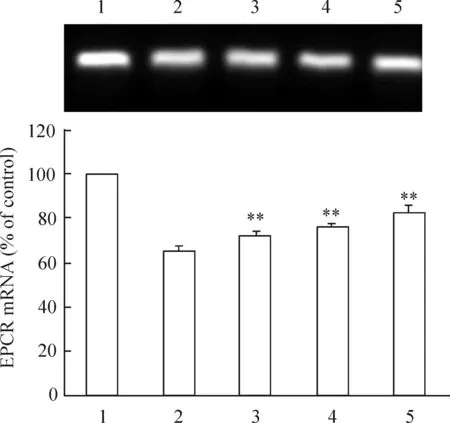

圖5不同濃度吡格列酮干預對EPCRmRNA表達的影響
討 論
高血糖是糖尿病的主要代謝特征,國內外的研究均已證實高血糖可直接或間接損傷內皮細胞功能,促進炎癥反應及血栓形成,參與糖尿病血管并發癥發生和發展的進程。
EPCR 是近年發現的PC系統的一個新成員,是一個由 221 個氨基酸組成的Ⅰ型跨膜糖蛋白,主要表達于大血管內皮細胞,其通過凝血酶(thrombin)-凝血酶調節蛋白(thrombomodulin,TM)復合物增進PC活性,提高PC的活化率。活化蛋白 C(the activated protein C,APC)在蛋白S、膜磷脂、Ⅴ因子及鈣離子等輔因子參與下,滅活 FVa 和Ⅷa,發揮抗凝作用[6]。另外,APC的抗炎作用也是近年來研究的熱點。其可能主要通過以下機制實現抗炎作用:首先,APC可直接作用于內皮細胞,通過下調 NF-κB的2個亞基(P50 和P52)的表達而下調下游基因的腫瘤壞死因子的表達;其次,其還能下調黏附分子ICAM-1、VCAM-1和E-選擇素的表達;同時,APC 還能直接上調內皮細胞bcl-2等抗凋亡基因的表達[7]。而所有這些分子機制的進程,均需要EPCR作為輔因子參與[3]。同時,新近的研究也表明EPCR對炎癥導致的內皮損傷具有直接的保護作用。Taylor等[8]已證明,EPCR能介導APC保護狒狒,使之抵抗因大腸桿菌輸入引起的致死作用。EPCR也可以直接抑制病原體介導的內皮細胞炎癥反應[9]。
綜上所述,EPCR可通過與PC/APC特異性結合發揮抗凝及抗炎作用,對維持血管內皮功能起著至關重要的作用。因此,EPCR也有可能參與高糖損傷內皮細胞的進程。
目前,高血糖損傷內皮細胞功能機制的研究主要集中在如下幾個方面:(1)多元醇途徑活性增強,導致細胞生長必需的肌醇減少及胞內山梨醇聚集以及高滲透壓而損傷內皮細胞(endothelial cells,ECs); (2)非酶糖基化及糖基化終末產物(AGEs)的形成,AGEs引起ECs增殖異常,并促進ECs死亡;(3)高糖狀態下產生過多的氧自由基,其對ECs產生嚴重的毒害作用[10]。現有研究已表明EPCR在維持血管內皮細胞功能中發揮重要的作用,但目前關于高血糖是否通過EPCR損傷內皮細胞功能國內外還未見相關報道。
本研究通過體外培養HUVECs,采用定量 real-time PCR 技術測定 HUVECs EPCR mRNA 的表達水平,證實在HUVECs細胞膜上有較高的EPCR mRNA表達,并且在高糖條件下培養的HUVECs,其 EPCR mRNA 的表達明顯下降,這表明高糖可通過下調EPCR mRNA的表達而導致血管內皮功能受損,這可能是糖尿病并發血管病變的新機制之一。
吡格列酮(troglizone)是一種噻唑烷二酮(thiazolidinedione,TZD) 類降血糖藥物,其可以通過改善胰島素抵抗,促進靶組織肌肉、肝臟、脂肪組織中糖的轉運及脂肪分解,達到降低血糖的目的[11]。新近的研究顯示,TZDs不但可以改善胰島素抵抗,降低血糖,還可以直接通過抑制炎癥反應、保護內皮功能等非降糖途徑來發揮血管保護作用[12-13]。近年來的研究也表明吡格列酮通過保護內皮細胞功能而延緩動脈粥樣硬化的早期進程[14]。然而,目前關于吡格列酮保護內皮細胞功能的機制還不十分明確,其是否可通過上調EPCR的表達來發揮其保護內皮細胞功能作用的研究還未見相關報道。
本研究發現在適量濃度的吡格列酮預處理HUVECs后,能明顯改善高糖所致的HUVECs EPCR mRNA表達的下調。這表明吡格列酮在高糖環境下能上調EPCR mRNA的表達而拮抗高糖對HUVECs內皮功能的損傷,實現其血管保護作用。這可能對今后 DM 血管并發癥發生發展的機制研究及靶向治療具有重要意義。
綜上所述,高血糖可通過下調EPCR mRNA的表達而損傷內皮細胞功能,而吡格列酮能通過改善高血糖導致的EPCR mRNA下調而發揮保護內皮細胞功能的作用,這可能是吡格列酮預防糖尿病血管并發癥的新機制。
[1] Hartge MM, Unger T, Kintsher U. The endothelium and vascular inflammation in diabetes [J]. Diab Vasc Dis Res, 2007, 4(2):84-88.
[2] Schouten M, Wiersinga WJ, Levi M, et al. Inflammation, endothelium, and coagulation in sepsis[J]. J Leukoc Biol, 2008, 83(3): 536-545.
[3] Van de Wouwer M,Collen D,Conway EM,et al. Thrombomodulin-protein C-EPCR system: integrated to regulate coagulation and inflammation[J].Arterioscler Thromb Vasc Biol, 2004, 24(8):1374-1383.
[4] O’Brien LA, Richardson MA, Mehrbod SF,et al. Activated protein C decreases tumor necrosis factor-related apoptosis-inducing ligand by an EPCR-independent mechanism involving Egr-1/Erk-1/2 activation [J]. Arterioscler Thromb Vasc Biol, 2007, 27(10):2634-2641.
[5] 燕 子,武 燁,劉慧榮,等. 吡格列酮對高脂血癥大鼠內皮功能的保護作用[J].中國病理生理雜志,2007,23(11):2086-2090.
[6] Van de Water NS, French JK, McDowell J, et al. The endothelial protein C receptor (EPCR) 23bp insert in patients with myocardial infarction [J]. Thromb Haemost, 2001, 85(4):749-750.
[7] Joyce DE, Gelbert L, Ciacha A, et al. Gene expression profile of antithrombotic protein C defines new mechanisms modulating inflammation and apoptosis[J]. J Biol Chem, 2001, 276(14):11199-11203.
[8] Taylor Jr FB, Stearns-Kurosawa DJ, Kurosawa S, et al. The endothelial cell protein C receptor aids in host defense againstEscherichiacolisepsis [J]. Blood, 2000, 95(5):1680-1686.
[9] DeAnna C Bublitz, Courtney E Noah, Jorge L Benach, et al. Francisella tularensis suppresses the proinflammatory response of endothelial cells via the endothelial protein C receptor[J]. J Immunol, 2010, 185(2): 1124-1131.
[10]李 巖,唐可欣,成 敏,等. 高糖對大鼠晚期內皮祖細胞增殖、遷移、黏附及分泌功能的影響[J]. 中國病理生理雜志,2011,27(12):2296-2301.
[11]Ceriello A, Johns D, Widel M, et al. Comparison of effect of pioglitazone with metformin or sulfonylurea (monotherapy and combination therapy) on postload glycemia and composite insulin sensitivity index during an oral glucose tolerance test in patients with type 2 diabe [J]. Diab Care, 2005, 28(2):266-272.
[12]Naka KK,Papathanassiou K, Bechlioulis A,et al.Effects of pioglitazone and metformin on vascular endothelial function in patients with type 2 diabetes treated with sulfonylureas[J]. Diab Vasc Dis Res, 2012,9(1):52-58.
[13]Papathanassiou K, Naka KK, Kazakos N, et al. Pioglitazone vs glimepiride: differential effects on vascular endothelial function in patients with type 2 diabetes [J]. Atherosclerosis, 2009, 205(1): 221-226.
[14]Davidson M, Meyer PM, Haffner S, et al. Increased high-density lipoprotein cholesterol predicts the pioglitazone-mediated reduction of carotid intima-media thickness progression in patients with type 2 diabetes mellitus [J]. Circulation, 2008, 117(16): 2123-2130.
EffectsofglucoseandpioglitazoneonexpressionofendothelialproteinCreceptorinhumanumbilicalveinendothelialcells
GUO Xiao-fang1,3, LIU Hai-bo2, REN Hui-long1, CHEN Hong-wei1, LAI Jing-bo1, GONG Wei-kun1, CHENG Xing-bo3, LU Guo-yuan4
(1DepartmentofEndocrinology,2DepartmentofCardiology,YinzhouPeople’sHospital,Ningbo315040,China;3DepartmentofEndocrinology,4DepartmentofNephrology,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou215006,China.E-mail:liuhaibo79@eyou.com)
AIM: To investigate the effects of glucose and pioglitazone on the expression of endothelial protein C receptor (EPCR) in human umbilical vein endothelial cells (HUVECs).METHODSCultured HUVECs were used as target cells. The expression of EPCR in HUVECs at mRNA and protein levels was confirmed by reverse transcription-polymerase chain reaction (RT-PCR) and flow cytometry, respectively. Different concentrations of glucose were added to the culture medium to establish the injury model of HUVECs. Pioglitazone was also added to the culture medium to observe the reversible influence. The mRNA levels of EPCR were measured by real-time quantitative PCR.RESULTSThe expression of EPCR in HUVECs was down-regulated by hyperglycemia in a dose-and time-dependent manner. Pioglitazone reversed the down-regulation of the mRNA expression of EPCR by hyperglycemia in HUVECs.CONCLUSIONHUVECs express EPCR mRNA at a high level. Hyperglycemia damages the function of endothelial cells by down-regulating the expression of EPCR. Pioglitazone attenuates the injury of HUVECs induced by hyperglycemia.
Endothelial cells; Glucose; Pioglitazone; Endothelial protein C receptor
R589.9
A
10.3969/j.issn.1000-4718.2012.09.006

