SNARE蛋白及其復合物在突觸融合過程中的作用*
梁麗娟,黃 薇
(天津醫藥集團津康制藥有限公司,天津 300270)
自從SNARE蛋白被發現以后,SNAREs就作為細胞膜融合蛋白復合體的關鍵組分而獲得普遍認同。盡管不同SNARE蛋白的基因組成序列存在差異,但是新型可設計的膜體系廣泛地被應用,均涉及細胞生長、膜修復、細胞骨架動力學和突觸傳遞等許多方面的細胞膜融合活動[1]。SNARE能夠啟動囊泡融合,參與蛋白質與膜轉運、調節性和非調節性囊泡的胞吐活動的激活和融合過程。俄亥俄州立大學的Dennis Bong教授認為,蛋白質與膜轉運等可以很好地控制化學分子釋放到目標分子,可以用于與生物科技和材料科學領域[2]。SNARE蛋白具有大約60個氨基酸殘基組成的細分子膜蛋白,SNARE蛋白組成了一個蛋白質超家族,在哺乳動物中超過35個。根據分布位置分為t-SNARE和v-SNARE。Rothman組和Scheller組發現syntaxin和SNAP-25具有t-SNARE的特性。而位于突觸囊泡膜上的VAMPs能特異性的降解SNARE蛋白的蛋白酶[3]。VAMP、syntaxin和 SNAP-25可以分別被破傷風毒素、肉毒毒素和金屬蛋白酶特異性的降解,從而不可逆地抑制突觸傳遞。體外重構實驗表明,分別含有v-SNARE和t-SNARE蛋白的脂質體能夠融合。基于快速冰凍蝕刻電子顯微鏡技術和X-射線衍射技術證明VAMP與syntaxin和SNAP-25形成將囊泡與質膜拉近并促進囊泡融合超螺旋核心復合體。
目前認為,SNARE核心復合物是突觸囊泡胞吐過程中的核心成分,而且參與幾乎所有分泌細胞的胞吐過程。其由三種蛋白質組成:位于突觸前膜的 t-SNARE(target-SNARE),包括syntaxin和突觸小體相關蛋白(synaptosome-associated protein of 25 kD,SNAP-25);位于突觸囊泡膜上的v-SNARE(vesicle-SNARE),為突觸囊泡蛋白/突觸囊泡相關膜蛋白vesicle-associated membrane protein,VAMP/synaptobrevin)[4]。SNARE的命名源于其最初是作為N-甲基馬來酰胺敏感因子(N-ethyl-maleimide-sensitivefactor,NSF)和可溶性 NSF附著蛋白(soluble NSFattachment proteins,SNAP)的膜受體,即 SNAPs蛋白受體。Syntaxin和VAMP均通過羧基末端的跨膜區分別錨定于突觸前膜和突觸囊泡膜上,而SNAP-25無跨膜區,其通過其中間區4個半胱氨酸殘基中的脂酰基錨定于突觸前膜。目前已在哺乳動物細胞中發現30多種SNARE超家族成員,多數成員在分泌過程中都有其特異的亞細胞定位。生化研究結果顯示,重組syntaxin、SNAP-25和VAMP三者結構中的僅螺旋形成區(coiled-coil domain)可形成一個穩定的核心復合物(core complex),該核心復合物可抵抗SDS的變性作用,蛋白酶的水解以及梭狀芽孢桿菌神經毒素的裂解作用,其熱穩定性可達到約90℃。SNARE三聚體核心復合物的親和力很高,但核心復合物相互作用的解離常數尚未確定[5-7]。
SNARE復合物是所有膜融合過程所需的核心蛋白復合物,SNARE蛋白的作用是保證識別的特異性,并介導運輸小泡與目標膜的融合。在神經系統中SNARE復合物介導神經遞質囊泡在突觸前膜的搭靠與融合過程,SNARE復合物的調節一直都是突觸傳遞研究中的熱點。SNAP-29被認為是一種在細胞內廣泛分布的target-SNARE蛋白,參與細胞內SNARE依賴的膜的轉運過程,其家族成員有 SNAP-25和SNAP-23。SNAP29在神經遞質釋放過程中是一個負向調節分子,其調節作用可能在于其抑制了突觸囊泡(SV)融合后SNARE復合物的解聚,阻礙SNARE蛋白參與到新的囊泡融合過程中,從而減慢囊泡循環翻新效率,最終對突觸傳遞起到抑制作用[8-10]。
1 SNARE蛋白質的結構
SNARE蛋白質的結構都具有60個氨基酸殘基組成的 SNARE的模體。有 syntaxin的氨基末端域和SNAP-25的中間中櫚酸酰化區域。VAMP氨基末端的富含脯氨酸域以及 syntaxin和 VAMP的跨膜區。Syntaxin的長氨基末端具有三個α-螺旋,稱為Habc。Habc可以與其羧基末端SNARE模體的α-螺旋形成封閉的結構。Habc可以減少溶液中SNARE蛋白核心復合體的形成,抑制具有SNARE蛋白的脂質體的融合。Munc-18能夠識別和結合 syntaxin、Habc結構域和SNARE模體α-螺旋所形成的封閉結構。當Munc-18的構象變化時,能夠使 syntaxin的 Habc與其自身SNARE模體 α-螺旋解離,形成開放結構,啟動SNARE蛋白的聚合物反應。因此,syntaxin的氨基末端域對囊泡激活和融合過程的調控具有重要的意義,也是SNARE蛋白之所以成為調節性胞吐過程膜融合基本分子構建的結構基礎[11]。盡管SNAP-25兩個α-螺旋中間的連接區域即富含半胱氨酸的中間結構域對其囊泡融合來說不是必要的,但連接區的四個半胱氨酸殘基棕櫚化后能夠將SNAP-25結合到細胞膜上,提高了SNAP-25的局部濃度,因而形成了足夠的SNARE復合物,對調節性分泌可能很重要。見圖1。
2 SNARE核心復合體與囊泡激活及膜融合
囊泡胞吐過程的膜融合由SNARE蛋白質介導。在SNARE模體的介導下,各SNARE蛋白聚合形成核心復合體。溶液中游離的SNARE模體為無定型結構,當適合的SNARE模體混合在一起時就能自發地聚合形成平行排列的超螺旋束。Synaptobrevin和syntaxin具有一個SNARE模體;SNAP-25有兩個SNARE模體;Synaptobrevin、syntaxin及SNAP-25按1∶1∶1的比例形成三聚體,這三類蛋白的四個SNARE模體的α-螺旋束平行排列聚合形成核心復合物。SNARE蛋白的聚合從遠離膜的氨基末端開始,以閉合拉鏈的形式向靠近膜的羧基端發展,通過synaptobrevin及syntaxin的連接區和跨膜域的傳遞,是囊泡膜和靶膜變形彎曲并相互靠攏,最終促使兩膜融合。此為“拉鏈”模型。SNARE蛋白聚合過程中,構象發生改變并且釋放能量,所釋放的能量用于克服囊泡膜與靶膜融合時的能量障礙。SNARE蛋白的聚合是一個可逆的過程,且存在著緊密結合和松散結合兩種物理狀態。緊密結合的SNARE蛋白聚合體對梭菌毒素不敏感,而結構松散結合的SNARE蛋白聚合體對梭菌毒素敏感且為可逆的結合狀態。多個SNARE蛋白復合體或者SNARE蛋白多聚體與磷脂形成融合孔。然后,SNARE蛋白擴散,融合孔擴大。融合孔形成后,t-SNARE和v-SNARE插在同一膜上,成為同位 -SNARE聚合體,NSF水解cis-SNARE復合物,是各SNARE蛋白游離開來,以便SNARE蛋白的循環利用。Ca2+為囊泡融合過程的觸發信號,synaptobrevin是 Ca2+感受器分子[12,13]。Ca2+、蛋白激酶、G 蛋白、Munc18 和 synaptatagmin等還可能參與對膜融合和融合孔動力學的調節。SNARE核心復合物具有15個疏水層和一個親水層。中間層為由親水性的3個谷氨酰胺和一個精氨酸殘基組成的離子層。屬于t-SNARE蛋白的 syntaxin和SNAP-25形成中間層anjisuan殘基為谷氨酰胺殘基,因而稱為Q-SNARE;v-SNARE的synaptobrevin為精氨酸殘基,也稱為R-SNARE。SNARE聚合物非常穩定,能夠抵抗SDS的滅活作用、蛋白酶的消化作用和神經毒素的裂解,并且有高達大約90℃的熱穩定性[14-16]。因而,核心復合體的各個 SNARE模體相互作用力很強大。SNARE核心復合體的晶體結構揭示這些相互作用力,包括疏水性相互作用、氨基酸殘基側鏈的氫鍵和鹽橋作用力。
3 SNARE蛋白復合體的解離
囊泡與靶膜融合后,各SNARE蛋白位于同一膜上。同位-SNARE必須解聚成為有力的單體才能用于新的囊泡激活和融合的過程,SNARE蛋白的循環利用可能是保證分泌細胞對高強度的重復刺激做出反應的重要因素之一。同位的SNARE解聚是由NSF完成。胞漿中的NSF在其適配蛋白α/β-SNAPs的協助下,水解ATP,將同位-SNARE聚合體解離。酵母的NSF/SNAPs同系物 sec18/sec17可以解聚異位 -SNARE[17,18]。
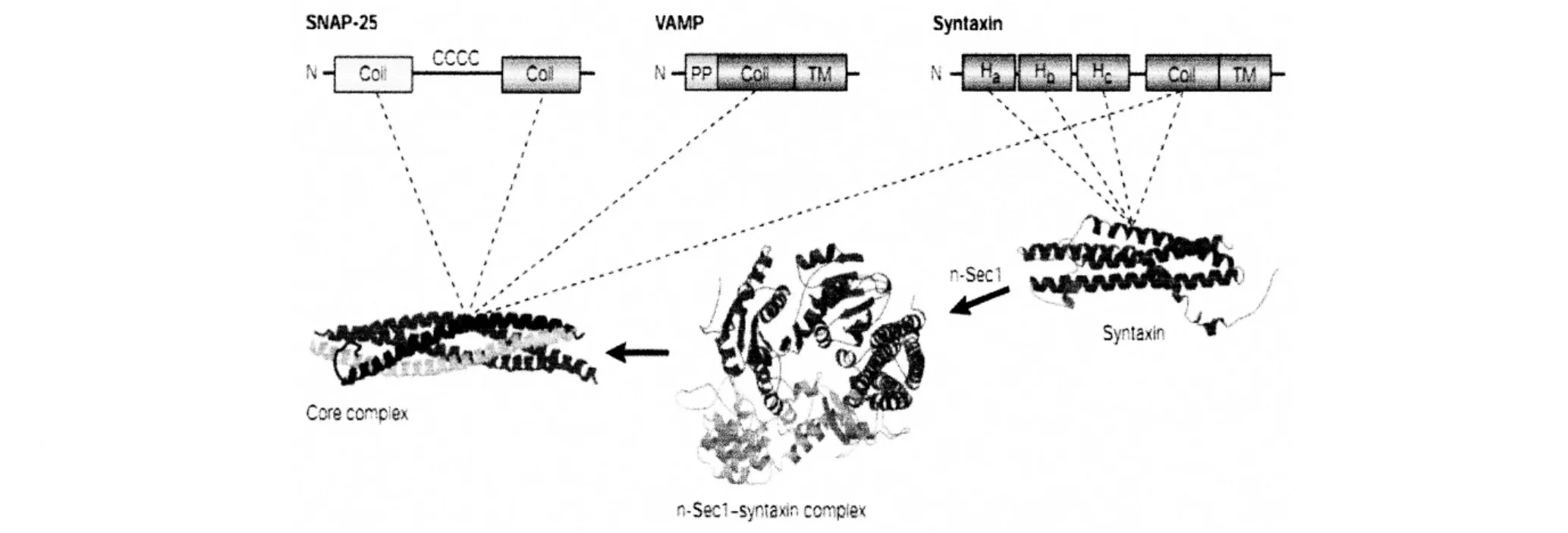
圖1 SNARE主要的結構域
4 囊泡胞吐的分子機制
Syntaxin與n-sec1結合,然后形成核心復合物。Rab可能幫助Syntaxin與n-sec1的分離,便于后續的三種神經元的 SNAREs、syntaxin和 SNAP-25結合。Ca2+引發了卷曲復合物的全部拉鏈,這導致膜融合和囊泡的內容物釋放[13]。在融合事件發生后,α-SNAP和NSF聚集,以及后續NSF水解ATP會引起SNARE的解聚。Syntaxin、VAMP和SNAP-25回收用作第二次胞吐。見圖2。
5 SNARE介導的脂質融合
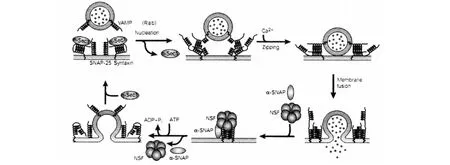
圖2 囊泡胞吐的分子機制

圖3 SNARE介導的脂質融合
首先是囊泡膜和質膜相互靠近,但是SNARE沒有接觸。SNARE從氨基端啟動拉鏈,引起兩個膜靠近。拉鏈收緊,引膜的曲度和側面張力增加,展現了雙分子層的本質。當間距足夠小時自發的半融合。側面的張力使膜斷裂,產生融合孔,融合孔擴張,膜塌陷。見圖3。總之,SNARE蛋白及其復合物由其介導的運輸囊泡膜與靶膜的錨靠、融合確保了各種胞內蛋白的定向運輸,從而保證了細胞生命活動的正常進行;同時通過對其結構及融合解離機制的深入研究,科研工作者在生物科技、生物醫藥和材料科學領域會有越來越令人興奮的發現,尤其是在現代新藥研究與開發過程中,其作為靶向藥物的藥物靶點的探索會越來越受到科研領域的矚目。
1 A Kashiwada,M Tsuboi,K Matsuda.Target- selective vesicle fusion induced by molecular recognition on lipid bilayers.Chem Commun,2009,6:695
2 Gong Y,Ma M,Bong D.Functional determinants of a synthetic vesicle fusion system,JAm Chem Soc,2008,130:6196
3 Sudhof,Rothman.Membrane fusion:grappling with SNARE and SM proteins.Science,2009,323:474
4 A S Lygina,K Meyenberg,R Jahn.Transmembrane Domain Peptide/Peptide Nucleic Acid Hybrid as a Model of a SNARE Protein in Vesicle Fusion.Angew Chem Int Ed,2011,50:8597
5 Karsten Meyenberg,Antonina S.SNARE derived peptide mimic inducingmembrane fusionw.Chem Commun,2011,47:9405
6 M Langer,D Langosch.Is lipid flippase activity of SNARE transmembrane domains required for membrane fusion?FEBS Letters,2011,585:1021
7 Yoon,Shin.Progress in understanding theneuronal SNARE function and its regulation.Cell Mol Life Sci,2009,66:460
8 Chen Y A,ScheUer R H.SNARE -Mediated Membrane Fusion.Nature Rev Mol Cell Biol,2001,2:98
9 Schoc h S,Deak F,Konigstorfer A.SNARE Function Analyzed in Synaptobrevin/VAMP Knockout Mice.Science,2001,294:1117
10 L V Chernomordik,M M Kozlov.Mechanics ofmembrane fusion.Nat Struct Mol Biol,2008,15:675
11 A T Brunger,K Weninger,M Bowen.Single - molecule studies of the neuronal SNARE fusion machinery.Annu Rev Biochem,2009,78:903
12 Heidelberger R,Heinemann C,Neher E.Calcium dependence of the rate of exocytosis in asynaptic terminal,Nature,1994,371:513
13 Peters C,Mayer A.Ca2+/calmodulin signals thecompletion of docking and triggers a late step of vacuolefusion.Nature,1998,396:575
14 Hu C.Fusion of cells by flipped SNAREs.Science,2003,300:1745
15 Sudhof T C,Rothman JE.Membrane fusion:Grappling with SNARE and SM proteins.Science,2009,323:474
16 Ohya T.Reconstitution of Rab-and SNARE -dependentmembrane fusionby synthetic endosomes.Nature,2009,459:1091
17 Mima J,Hickey C M,Xu H,et al.Reconstitutedmembrane fusion requiresregulatory lipids,SNAREs and synergistic SNARE chaperones.EMBO J,2008,27:203
18 Fasshauer D,Sutton R.Conserved structural features of the synaptic fusioncomplex:SNARE proteins reclassified as Q-and R-SNAREs.Proc Natl Acad,1998,95:15781

