敲低Aurora A基因增強替莫唑胺抗人腦膠質瘤U87細胞的作用☆
陳云鵬 張弩 丁之明 夏之柏
正常細胞分裂過程的任何偏差會造成中心體擴增、染色體異常分離以及非整倍體的產生,導致基因組不穩定,從而誘發腫瘤[1]。近年來,一種新的參與有絲分裂的絲氨酸蘇氨酸激酶家族——Aurora家族逐漸被認識,其分為3類:Aurora-A、Aurora-B 和 Aurora-C,其中 Aurora-A 最受關注[2]。研究發現Aurora A過表達不但使某些腫瘤如卵巢癌的侵襲性和轉移率明顯提高,而且與患者預后直接相關[3-4]。敲低 Aurora A 在喉癌細胞的表達可使其對順鉑的敏感性增加[5]。我們先前的研究也發現Aurora A在膠質瘤中存在過表達現象。在此基礎上,本文研究敲低Aurora A基因聯合替莫唑胺(temozolomide,TMZ)治療后細胞增殖變化,探討其作為腫瘤基因治療新靶點的可能性。
1 材料與方法
1.1 研究對象 U87細胞購自中國科學院細胞研究所;DMEM培養基、胎牛血清、胰蛋白酶購自美國Gibco公司;抗Aurora A抗體購自美國Bethyl公司;抗β-actin抗體、辣根過氧化物酶耦聯的抗兔IgG和抗鼠IgG購自武漢博士德;替莫唑胺由美國Schering-Plough公司提供;二甲基亞砜(dimethyl sulfoxide,DMSO) 購自美國 Sigma 公司;pshRNA Lentivector質粒、包裝質粒、基于人免疫缺陷病毒骨架的慢病毒包裝系統 (Lenti-Pac HIV Expression Packaging Kit)購自美國GeneCopoeia公司;中量質粒DNA提取試劑盒購自德國Qiagen公司;人膽囊收縮素八肽(CCK8)購自美國Invitrogen公司。
1.2 細胞培養 U87細胞培養于含10%新生牛血清的高糖DMEM培養液,內含青霉素、鏈霉素,置37℃、5%CO2條件下常規培養。
1.3 細胞轉染 構建Aurora A shRNA質粒載體(廣州復能基因公司協助構建)。按說明書用Lenti-Pac HIV Expression Packaging Kit慢病毒包裝系統進行慢病毒感染。慢病毒感染24 h后對樣品進行換液處理;48 h后用熒光顯微鏡檢查GFP表達;96 h開始添加濃度為7.5 μg/L的嘌呤霉素進行篩選。熒光顯微鏡下觀察轉染了Aurora A shRNA和空載體的U87細胞是否有熒光。細胞分未轉染組(U87)、 空載體組 (U87-GFP) 及轉染組(U87-shRNA)
1.4 RT-PCR檢測Aurora A mRNA表達 提取3組細胞總RNA,按Promega試劑盒說明進行反轉錄和PCR擴增。Aurora A上游5′-AATCTGGAGGCAAGGTTCGACTG-3′,下游 5′-TGGGAGATAAGT GGTTAAGGAGG-3′,GAPDH為內參照。產物經1.5%瓊脂糖凝膠電泳,紫外線下檢測并拍照。
1.5 Western blot檢測 Aurora A蛋白表達 提取3組細胞總蛋白,測定濃度;蛋白樣品(每泳道50 μg)行 7.5%SDS PAGE 電泳,100 mV 轉膜。牛奶封閉,加入 Aurora A 抗體(1∶200)和 β-actin 抗體(1∶500)4℃過夜,次日加入 HRP 標記二抗(1∶5000),37℃1 h,洗膜后ECL發光,X膠片曝光、顯影。
1.6 CCK8法檢測細胞活性 替莫唑胺用DMSO配制成濃度為 100 mmol/L的溶液,-20℃保存,臨用時用全培養液稀釋至所需濃度。取對數生長期的未轉染組、空載體組和轉染組細胞接種于96孔培養板,細胞密度 2 × 104/mL,置 37℃、5%CO2條件下培養24 h,分別加入濃度依次為10、25、50、100、200 μmol/L 的 TMZ,每孔加 100 μL 并設置空白對照組及陰性對照組(二甲基亞砜),每個藥物濃度設5個平行孔,繼續培養72 h。另取未轉染組、空載體組和轉染組細胞,加入 50 μmol/L TMZ分別作用24、48、72 h。完成處理后每孔加入CCK8試劑10 μL,37℃繼續培養 2 h,全自動酶標儀檢測波長450 nm的吸光度OD值。細胞生長抑制率(%)=(1-加藥組OD平均值/對照組OD平均值)×100%。實驗重復3次。做對數曲線算出IC50值。
1.7 流式細胞儀分析細胞 取對數生長期的未轉染組、空載體組和轉染組細胞,用TMZ同前處理。處理完成后,將細胞收集于流式管中,PBS洗滌,70%冰乙醇固定,再用PBS洗滌2次,每管加入預先配制好的PI染液l mL,室溫避光5 h,上機檢測細胞周期。
2 結果
2.1 Aurora A轉染U87細胞的鑒定 熒光顯微鏡下轉染組和空載體組細胞帶綠色熒光蛋白,表明轉染成功(圖1)。用ImageJ軟件分析條帶灰度。RT-PCR結果灰度值分別為:未轉染組 (31023±926)、 空載體組 (30124±1074)、 轉染組 (896±172),各組間的差異有統計學意義(F=2159.63,P<0.001),兩兩比較顯示轉染組灰度值低于其他兩組(P < 0.001);Western blot結果灰度值分別為:未轉染組 (39556±2306)、 空載體組 (39348±2738)、轉染組(574±96),各組間的差異有統計學意義(F=589.36,P < 0.001),兩兩比較顯示轉染組灰度值低于其他兩組(P<0.001)。實驗結果表明相對于空載體組及未轉染組,轉染組的Aurora A mRNA和蛋白表達均降低(圖2、3)。
2.2 細胞生長抑制的比較 表1顯示陰性對照組(二甲基亞砜)內,未轉染組、空載體組、轉染組間無統計學差異(F=0.35,P > 0.05)。表1、圖 4A 表明在一定TMZ濃度范圍內各組細胞生長抑制率隨著濃度的升高而增加,呈現濃度依賴性。經不同濃度的替莫唑胺作用不同時間后,轉染組細胞的TMZ劑量反應曲線左移。經直線回歸方程計算,未轉染組、空載體組、轉染組的半數有效抑制濃度(IC50) 分別為:(43.38±2.15)μmol/L、(43.76±1.52)μmol/L、(22.20±2.34)μmol/L,各組間差異具有統計學意義(F=184.06,P < 0.001),兩兩比較顯示轉染組半數有效抑制濃度(IC50)低于其他兩組(P < 0.001)。用 50 μmol/L TMZ 處理各組細胞,相同時間點各組的差異均有統計學意義,兩兩比較顯示,相同時間點下轉染組的細胞抑制均高于空載體組和未轉染組(P < 0.01)(表2、圖 4B)。
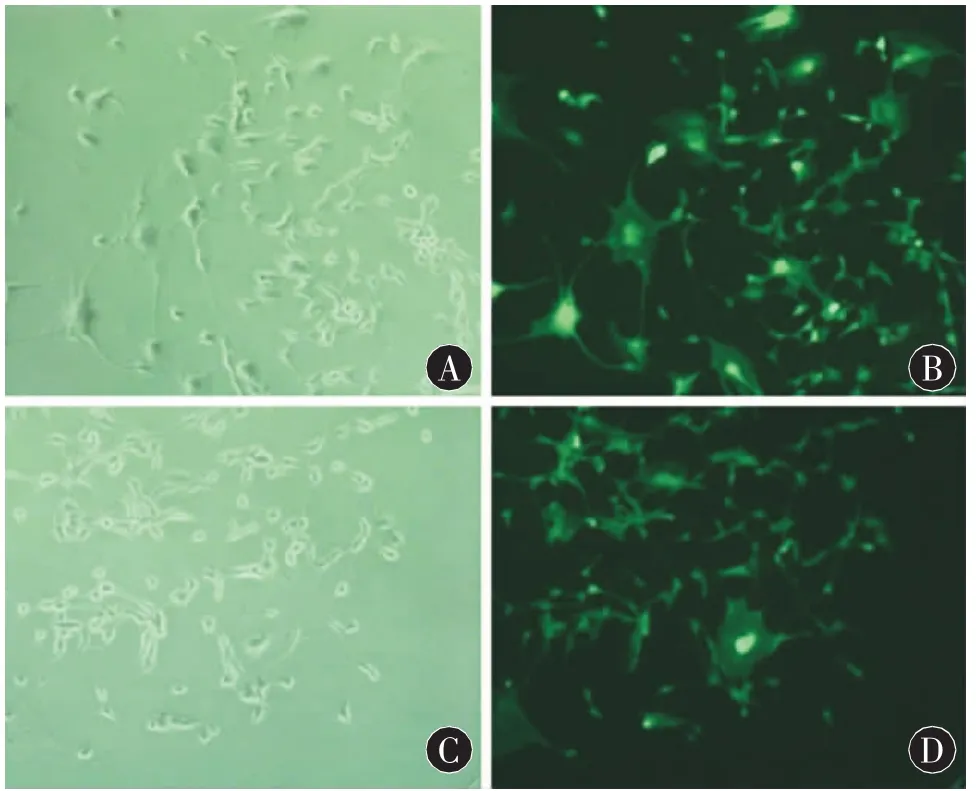
圖1 轉染組和空載體組細胞(×200,熒光顯微鏡)。A:轉染組(明場);B:轉染組(熒光);C:空載體組(明場);D:空載體組(熒光)
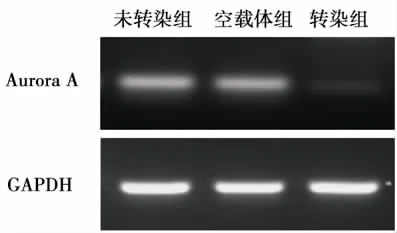
圖2 轉染前后U87細胞Aurora A mRNA表達(RT-PCR)
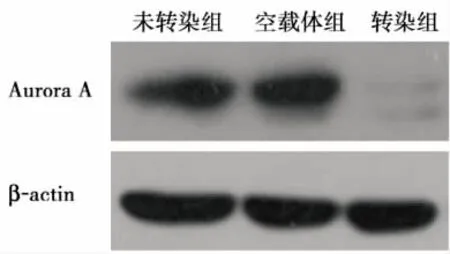
圖3 轉染前后U87細胞Aurora A蛋白表達(Western blot)
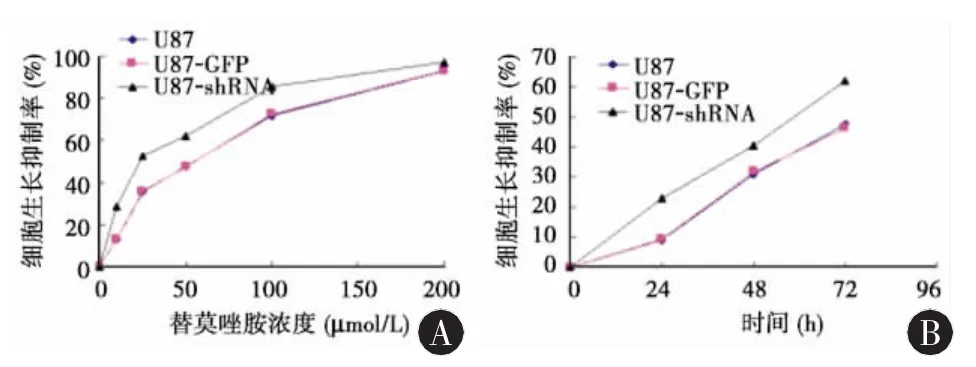
圖4 替莫唑胺對未轉染組、空載體組與轉染組細胞增殖的影響
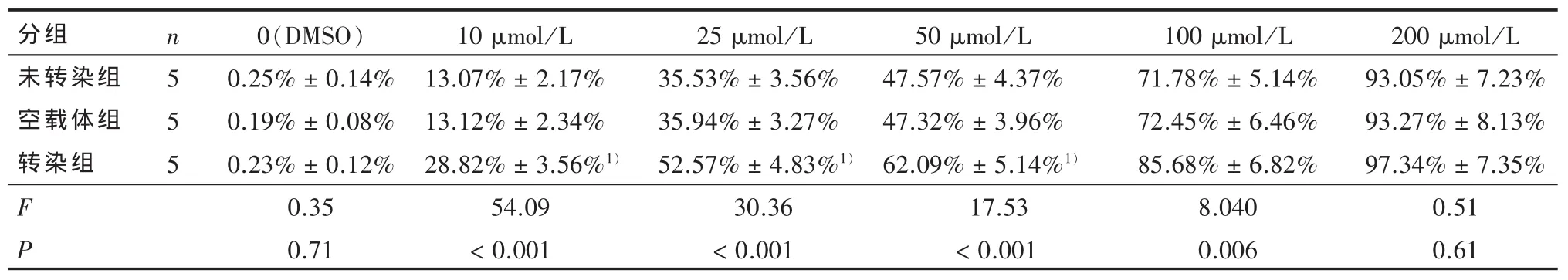
表1 不同濃度替莫唑胺作用于未轉染組、空載體組與轉染組細胞72 h的生長抑制率
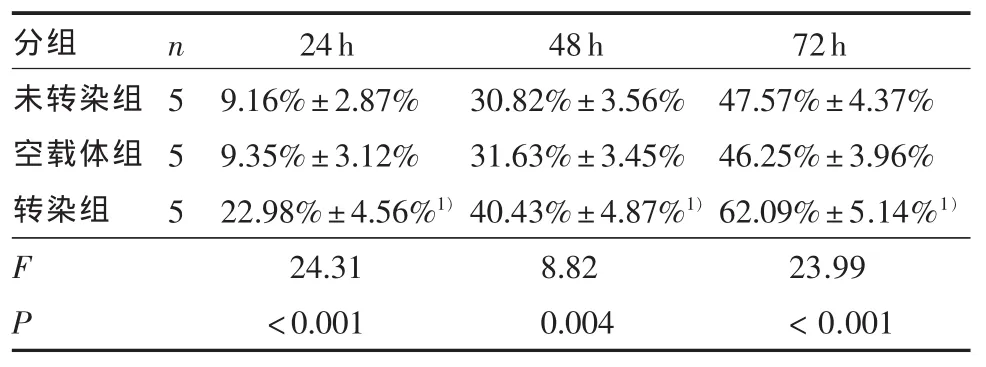
表2 未轉染組、空載體組與轉染組細胞在50 μmol/L替莫唑胺作用下不同時間點的細胞生長抑制率
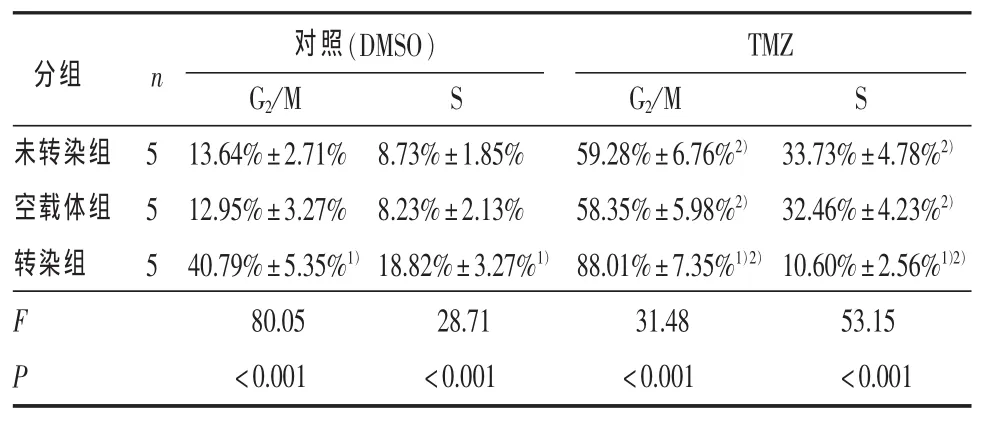
表3 未轉染組、空載體組與轉染組接受50 μmol/L替莫唑胺及對照(DMSO)處理72 h細胞周期變化(%)
2.3 細胞凋亡的比較 表3顯示兩種不同處理下未轉染組、空載體組和轉染組各組間G2/M期比例的差異均有統計學意義,兩兩比較顯示兩種不同處理下轉染組G2/M期比例均高于其他兩組 (P<0.01)。敲低Aurora A聯合TMZ比單獨敲低Aurora A或者單獨 TMZ 處理 G2/M 期阻滯明顯(P < 0.01)。
3 討論
Aurora A位于重要的癌基因區域20q13,在有絲分裂期定位于中心體和紡錘體,在中心體復制、分離、成熟的過程中發揮重要作用。Aurora A高表達通過干擾紡錘體組裝的檢測點,引起胞質分裂中止,最終出現中心體擴增形成非整倍體細胞。少數非整倍體細胞生存下來,其生長優勢高于鄰近的正常細胞,導致形成腫瘤的可能性大大增加[6]。
我們發現Aurora A基因在膠質瘤細胞高表達,敲低其表達后,細胞增殖明顯降低。Cammareri等[7]報道,直腸癌高表達Aurora A基因,沉默其表達后細胞增殖也明顯下降,對5-FU的敏感性也明顯增加。Lehman NL等[8]發現Aurora A過表達可促進喉鱗狀上皮癌細胞的增殖和轉移,敲低Aurora A基因表達可使喉鱗狀上皮癌對順鉑的敏感性增加。我們發現敲低Aurora A基因不但使替莫唑胺對膠質瘤細胞的IC50明顯降低,而且也可使細胞經較低濃度替莫唑胺作用后增殖活性顯著下降。綜上所述,敲低Aurora A基因表達不但能使多種腫瘤增殖活性下降,而且能增加腫瘤對化療的敏感性。
Aurora A基因表達下調增加腫瘤細胞化療敏感性的機理尚不清楚。我們的研究證實敲低Aurora A可使腫瘤細胞的G2/M比例增加,協同TMZ處理腫瘤細胞G2/M比例進一步增加,但凋亡并無增加。Marumoto等[9]在非霍奇金淋巴瘤中發現 Aurora A過表達破壞細胞G2/M檢查點的功能,導致細胞周期無法阻滯于G2/M期;并使細胞在DNA受損情況下繼續進行分裂,產生惡性轉化。故敲低Aurora A的表達,可能是通過恢復細胞G2/M檢查點的功能,使其得以發揮自身的監控作用,產生G2/M期阻滯,導致細胞生長抑制。Lee S 等[10]認為 Aurora A可對p53的315位絲氨酸磷酸化,導致其通過泛素化途徑降解。敲低Aurora A的表達可能恢復p53功能,產生G2/M期阻滯,達到抑制增殖的作用。p53功能降低或缺失,bcl-2表達水平過高,以及表皮生長因子受體表達過高可干擾細胞對DNA損傷的反應,降低對化療藥物的敏感性[11]。誘導惡性膠質瘤細胞發生自噬是替莫唑胺的重要作用。由于自噬的特點,藥物誘導腫瘤細胞產生自噬會出現兩種不同的結果:一是保護腫瘤細胞免受放化療損傷,另一種是啟動細胞主動性的Ⅱ型細胞死亡程序。自噬早期抑制劑抑制替莫唑胺誘導自噬的同時可削弱其抗腫瘤效應,而自噬晚期抑制劑可誘導凋亡增加替莫唑胺抗腫瘤效應[12]。
Zhang J等[13]發現在替莫唑胺耐藥細胞株中U373VR細胞中MGMT蛋白上調;SNB19VR細胞中的hMSH6表達缺失造成的MMR損傷。體外和臨床試驗研究均證實腫瘤的烷化劑抵抗性是由MGMT過表達或MMR缺陷介導的。而Aurora A的上調都可以使MGMT過表達或MMR缺陷介導,使腫瘤獲得對替莫唑胺導致的損傷耐受或修復的能力。因此敲低Aurora A除可延長細胞有絲分裂G2期外還有下調MGMT修復MMR的功能,從而增強替莫唑胺的抗腫瘤作用。Aurora A的敲低不僅其本身就具有抗腫瘤作用,而且能增強腫瘤對替莫唑胺等化療藥物的敏感性,因此Aurora A基因將是未來膠質瘤基因治療和聯合化療的重要靶基因。
[1]Endersby R,Baker SJ.PTEN signaling in brain: neuropathology and tumorigenesis[J].Oncogene,2008,27(41):5416-5430.
[2]Barton VN,Foreman NK,Donson AM,et al.Aurora kinase A as a rational target for therapy in glioblastoma[J].J Neurosurg Pediatr,2010,6(1):98-105.
[3]Yang SB,Zhou XB,Zhu HX,et al.Amplification and overexpression of Aurora-A in esophageal squamous cell carcinoma[J].Oncol Rep,2007,17(5):1083-1088.
[4]Landen CN Jr,Lin YG,Immaneni A,et al.Overexpression of the centrosomal protein Aurora-A kinase is associated with poor prognosis in epithelial ovarian cancer patients[J].Clin Cancer Res,2007,13(14):4098-4104.
[5]Loh JK,Lieu AS,Chou CH,et al.Differential expression of centrosomal proteins at different stages of human glioma[J].BMC Cancer,2010,10(7):268-295.
[6]Lehman NL,O′Donnell JP,Whiteley LJ,et al.Aurora A is differentially expressed in gliomas,is associated with patient survival in glioblastoma and is a potential chemotherapeutic target in gliomas[J].Cell Cycle,2012,11(3):489-502.
[7]Cammareri P,Scopelliti A,Todaro M,et al.Aurora-a is essential for the tumorigenic capacity and chemoresistance of colorectal cancer stem cells[J].Cancer Res,2010,70 (11):4655-4665.
[8]Lehman NL,O'Donnell JP,Whiteley LJ,et al.Aurora A is differentially expressed in gliomas,is associated with patient survival in glioblastoma and is a potential chemotherapeutic target in gliomas[J].Cell Cycle,2012,11(3):489-502.
[9]Marumoto T,Hirota T,Morisaki T,et al.A novel Aurora kinase A inhibitor MK-8745 predicts TPX2 as a therapeutic biomarker in non-Hodgkin lymphoma cell lines[J].Leuk Lymphoma,2012,53(3):462-471.
[10]Lee S,Cimica V,Ramachandra N,et al.Aurora A Is a Repressed Effector Target of the Chromatin Remodeling Protein INI1 /hSNF5 Required for Rhabdoid Tumor Cell Survival[J].Cancer Res,2011,71(9):3225-3235.
[11]張俊平,魏大年,史泓瀏,等.體外藥敏試驗及化療耐藥和敏感分子特征指導的惡性腦膠質瘤臨床個體化化療研究[J].中國神經精神疾病雜志,2009,35(8):476-480.
[12]Lin CJ,Lee CC,Shih YL,et al.Resveratrol enhances the therapeutic effect of temozolomide against malignant glioma in vitro and in vivo by inhibiting autophagy[J].Free Radic Biol Med,2012,52(2):377-391.
[13]Zhang J,Stevens MF,Laughton CA,et al.Acquired resistance to temozolomide in glioma cell lines: molecular mechanisms and potential translational applications[J].Oncology,2010,78(2):103-14.

