雞HOPX基因的克隆及表達分析
張 坤,張志威,王維世,閆曉紅,李 輝,王 寧
(東北農業大學動物科學技術學院,農業部雞遺傳育種重點實驗室,哈爾濱 150030)
HOPX基因(Homeodomain only protein X)又名OB1(Odd homeoBox 1),其編碼的蛋白是一個非HOX家族蛋白,該蛋白非常小,僅有73個氨基酸殘基構成[1]。與HOX家族蛋白不同,HOPX僅有一個非典型的同源異型結構域(Homeodomain)。由于突變,該結構域不能結合DNA,而主要是參與蛋白間的互作。HOPX的作用取決于與其互作的蛋白[2]。目前已發現HOPX蛋白可與血清反應因子(Serum response factor,SRF)[3-4]、組蛋白去乙酰化酶2(HDAC2)[5]等發生蛋白互作。HOPX基因在的哺乳動物腦、胎盤、心臟、脾臟、肺臟、膀胱、平滑肌等多種組織和器官表達[6]。HOPX基因調控心臟發育[7-9]、平滑肌[10-12]、骨骼肌[13]、上皮角質細胞[14-15]以及滋養層細胞的分化[16]。很多有關癌癥的研究表明,HOPX基因是一個腫瘤抑制因子,HOPX基因啟動子的甲基化能導致食管鱗狀細胞癌[17],子宮內膜癌[18]和胃癌的發生[19],HOPX還是肺癌和絨毛膜癌的抑制因子[20-22]。對HOPX基因的功能和調控的研究,目前多集中于哺乳動物,禽類HOPX基因的相關研究尚未見報道。本實驗室的雞組織轉錄表達譜分析及Northern blot分析發現,HOPX基因在雞脂肪組織的表達量顯著高于其它組織。
為深入研究該基因在脂肪生長發育過程中的作用,本研究擴增和克隆雞HOPX基因全長的CDS區,對其進行了序列分析,采用real-time RT-PCR和半定量RT-PCR的方法,進行該基因的組織表達譜分析、該基因在東北農業大學高、低脂雞脂肪組織發育過程中的表達差異分析以及在雞脂肪細胞分化過程中的表達分析。本研究為開展HOPX基因在脂肪生長發育過程中的作用及其作用機制研究奠定基礎。
1 材料與方法
1.1 材料
1.1.1 試驗材料
本研究實驗動物為10日齡商品AA肉仔雞和東北農業大學高、低脂系雙向選擇品系第14世代肉雞。實驗雞按常規商品肉雞飼養程序進行飼養。在無菌條件下,從1~12周齡的高、低脂系肉雞中,每周齡分別選取高、低脂系雞各5只,采集腹部脂肪組織,且7周齡時,同時采集腎臟(K),心臟(H),肝臟(L),睪丸(Te),脾臟(Sp),十二指腸(D),回腸(I),空腸(J),肌胃周圍脂肪(GF),腹部脂肪(AF),腺胃(P),肌胃(G),大腦(Cr),胸肌(PM)和腿肌(LM)15種組織樣。
1.1.2 感受態細胞和克隆載體
大腸桿菌TOP10感受態細胞(購自北京康為世紀生物技術有限公司);克隆載體pMD-18T Vector(購自大連寶生物工程有限公司)。
1.1.3 試劑
瓊脂糖凝膠DNA回收試劑盒和質粒小量制備試劑盒(購自Axygen(杭州)有限公司);瓊脂糖(Agarose)(購自北京原平皓生物技術公司);內切酶EcoRI和SacI、oligo dT引物、dNTP、Taq酶、RNase Inhibitor及SYBR Premix ExTaq試劑盒(均購自大連寶生物工程有限公司);總RNA極速提取試劑盒(購自上海飛捷生物技術有限公司);DNA Marker(購自北京全式金生物技術有限公司);半定量RT-PCR試劑盒、RNase H2O(購自Promega公司);DMEM/F12(1:1)培養液和I型膠原酶(購自GIBCO公司)。
1.1.4 引物設計
根據NCBI數據庫(http://www.ncbi.nlm.nih.gov/)提供的HOPX基因(NM_204556)和GAPDH基因(K01458)的核酸序列,采用Primer Premier 5.0軟件設計引物,分別用于HOPX全長CDS區擴增以及HOPX基因和內參基因的表達分析。引物由上海英駿(Invitrogen)生物技術有限公司合成。

表1 HOPX基因PCR引物序列、退火條件及產物Table 1 Primer sequences,PCR product and annealing temperatures of chicken HOPX gene
1.2 方法
1.2.1 雞RNA提取和cDNA的制備
從1至12周齡,每周齡分別選取高、低脂系雞各5只,每個周齡屠宰一批肉雞,在無菌條件下,采取腹部脂肪組織,其中在7周齡時,同時還采取其他14種組織樣品。樣品迅速凍存于液氮中,然后再保存在-80℃冰箱中。采用總RNA提取試劑盒(上海飛捷生物技術有限公司),提取脂肪組織等各組織樣的總RNA。cDNA制備的具體操作如下:分別取1 μg雞各組織總RNA,采用Oligo-dT引物,按照Promega提供的試劑說明進行反轉錄。反轉錄反應液組成是總RNA 1 μg,Oligo-dT Primer 0.5 μL,RNAse Free Water 3.5 μL,ImProm-II Buffer 4 μL,MgCL22.5 μL,dNTP 1 μL,RNAse Inhibitor(40 U·μL-1)0.5 μL,ImProm-II Reverse Transcriptase 1 μL,RNAse Water 6 μL,總體系為20 μL。反轉錄反應條件為70℃5 min,冰浴5 min,25℃5 min,60℃60 min,70℃15 min。所得到的cDNA在-20℃保存。
1.2.2 雞HOPX基因CDS區的擴增、克隆和序列分析
以雞脂肪組織cDNA為模板,用引物GHOPX1(F和R)擴增HOPX的編碼區。反應液的組成是ExTaq酶0.5 μL,10×Ex Taq Buffer 10 μL,dNTP 8 μL,cDNA 5 μL,上/下游引物(GHOPX1)各 2 μL,H2O 72.5 μL,總體系為 100 μL。 PCR 反應條件是94℃ 5 min,30個循環(94℃ 30 s;55.3℃ 30 s;72 ℃30 s),72 ℃ 5 min。
將HOPX基因CDS區的擴增產物,采用凝膠回收試劑盒回收,克隆到pMD-18T載體中,轉化大腸桿菌TOP10感受態細胞,在平板培養基挑取單菌落,加入到含有氨芐抗性的LB液體培養基中,放于37℃搖床中過夜。用菌液PCR和雙酶切法鑒定。挑選陽性的克隆,送上海英駿(Invitrogen)生物技術有限公司測序,應用ClusterW2.0(http://www.ebi.ac.uk/Tools/msa/clustalw2/)進行HOPX蛋白序列的同源性分析。
1.2.3 Real-time RT-PCR反應
以反轉錄得到的cDNA為模板,進行HOPX基因mRNA表達量的定量分析。反應液的組成是SYBR 5 μL,ROX 0.2 μL,上/下游引物(GHOPX2)各 0.2 μL,H2O 3.4 μL,cDNA 1 μL,總體系為 10 μL。反應條件為95℃30 s,40個循環(95℃5 s;60 ℃ 25 s),95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。GAPDH基因作為內參基因,反應液的組成及反應條件同上述。用ABI 7500 Software軟件分析表達結果。
1.2.4 半定量RT-PCR反應
以反轉錄得到的cDNA為模板,進行HOPX基因的PCR擴增。反應液組成為EasyTaq酶0.05 μL,上/下游引物(GHOPX2)各 0.2 μL,H2O 7.25 μL,cDNA 0.5 μL,10×Buffer 1 μL,dNTP 0.8 μL,總體系為10 μL。反應條件為94℃5 min,23個循環(94 ℃ 30 s;55.3℃ 30 s;72 ℃ 30 s),72 ℃ 5 min。GAPDH基因作為內參基因,退火溫度設為41.5℃,其余條件同上述。PCR產物經2%瓊脂糖凝膠電泳檢測。
1.2.5 前脂肪細胞培養和分化
取10日齡商品AA肉仔雞,無菌采取腹部脂肪組織,放入裝有PBS的平皿中,反復沖洗,盡量除去血管和筋膜,用眼科剪剪碎組織,隨即轉入含有膠原酶的消化液試管中,于37℃消化60 min(每5 min震蕩一次)。消化完畢,加入培養液終止消化,然后分別經100目和600目的不銹鋼篩網過濾。將濾液分裝入離心管,2 000 r·min-1離心10 min,除去培養液,用紅細胞裂解液重懸細胞,制成細胞懸液,室溫孵育10 min后,2 000 r·min-1離心10 min,細胞沉淀,用培養液(DMEM/F12)洗1~2次,最后重懸細胞,獲得雞基質-血管細胞(S-V細胞),即雞前脂肪細胞。
將分離的前脂肪細胞記數后,按1×105cells·mL-1左右的密度接種,置于CO2培養箱中培養,48 h后,洗去未貼壁的細胞,再在培養液中加入油酸(160 μmol·L-1)誘導分化,以后每2 d換液1次。收集不同分化時間點細胞,提取細胞總RNA,采用real-time RT-PCR分別檢測HOPX基因和GAPDH(內參)基因的表達,引物見表1。采用2-△△Ct的方法計算HOPX基因mRNA的相對表達量。
2 結果與分析
2.1 HOPX基因全長CDS區的擴增、克隆及序列分析
HOPX基因CDS區的PCR擴增產物經2%瓊脂糖凝膠電泳檢測,可見一條240 bp特異性帶(預期的擴增片段上下游包括兩個酶切位點),與預期相符(見圖1)。膠回收PCR產物,采用pMD-18T載體克隆。陽性重組質粒酶切鑒定如圖2所示,雙酶切獲得了預期大小的DNA片段。測序結果與NCBI數據庫序列(NM_204556)一致,表明試驗已成功獲得雞HOPX基因。序列分析顯示,HOPX的CDS區全長222 bp,編碼73個氨基酸。SMART結構域分析顯示,與人和鼠等的HOPX相似,雞HOPX也僅有一個非典型的HD結構域,不能能結合DNA。

圖1 PCR產物凝膠電泳圖譜Fig.1 Agarose gel electrophoresis of RT-PCR products corresponding mRNA coding chicken HOPX

圖2 重組質粒雙酶切鑒定圖譜Fig.2 Identification of the recombinant HOPX plasmid by double digestion
查詢EMBL數據庫(http://www.ebi.ac.uk/)共獲得雞HOPX蛋白的20個同源序列,這20個物種分別為火雞,牛、豬、人,大小鼠、豚鼠、熊貓、兔、獼猴、狨猴、大猩猩、長臂猿、大象、倉鼠、鴨嘴獸、三文魚、斑馬魚和河豚。多序列比對分析顯示,這些HOPX蛋白序列的在不同物種間的保守性較高,表現出物種間進化關系越近,序列間相似度越高的規律(見表2)。
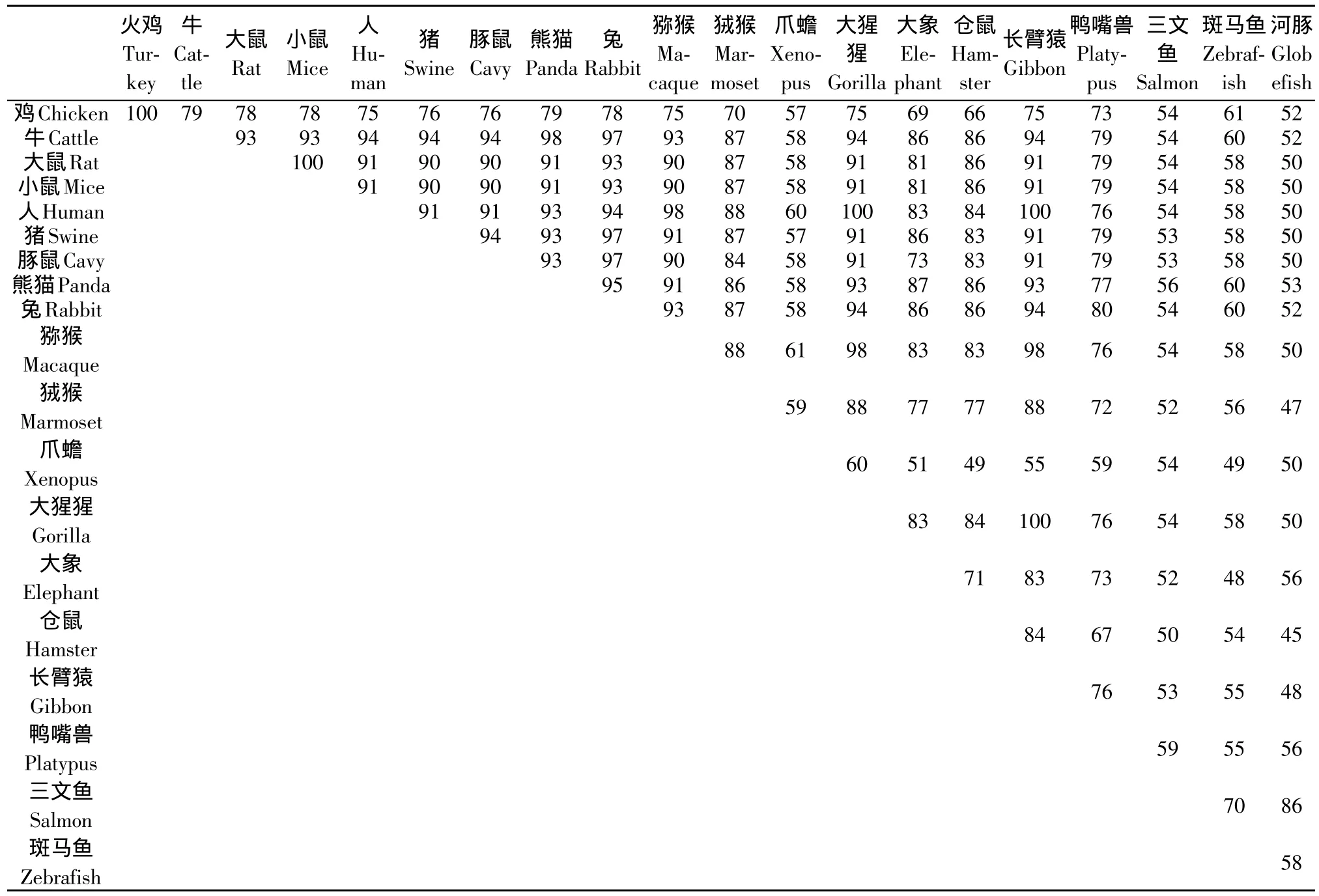
表2 雞與其他物種HOPX氨基酸序列同源性比較Table 2 Comparison of amino acid sequences of HOPXs from 20 different species
例如,人和大猩猩、長臂猿間;雞和火雞間;大鼠和小鼠間序列相似度均為100%。哺乳類牛、豬、人、鼠、大象、猿類、兔、大熊貓等序列相似度大于86%,斑馬魚與三文魚序列的相似度為86%,而雞與哺乳類HOPX蛋白的序列相似度在69%~79%間,與魚類的相似度則小于61%。
2.2 HOPX基因的表達分析
2.2.1HOPX基因在不同組織中的表達情況
以GAPDH基因(glyceraldehyde-3-phosphate dehydrogenase)作為內參基因,采用real-time RTPCR的方法,檢測HOPX基因在肉雞高,低脂系7周齡公雞的腎臟(K)、心臟(H)、肝臟(L)、睪丸(Te)、脾臟(Sp)、十二指腸(D)、肌胃周圍脂肪(GF)、 肌 胃 (G)、 腹 部 脂 肪 (AF)、 回 腸 (I)、 大 腦(Cr)、腿肌(LM)、胸肌(PM)、空腸(J)和腺胃(P)共 15種組織中的表達。結果顯示,HOPX基因在脂肪組織(腹部脂肪組織和肌胃周圍脂肪組織)的表達量最高。HOPX基因雖也在雞的其它多個組織有表達,但其表達量較低,尤其在胸肌、腿肌及腎臟表達量最低(見圖3),這與本實驗室早期表達譜芯片和Northern blot分析結果一致。進一步比較HOPX基因在高、低脂系肉雞不同器官和組織中的表達情況,可見,在睪丸和脾臟組織中,低脂系雞HOPX基因的表達量顯著高于高脂系(P<0.05);在腿肌、心臟、肌胃組織中,低脂系雞HOPX基因的表達量極顯著高于高脂系(P<0.01),而在空腸中,高脂系雞HOPX基因的表達極顯著地高于低脂系(P<0.01)。除此之外,高、低脂系肉雞的其他供試組織中HOPX基因的表達量差異不顯著(見圖3)。
半定量RT-PCR方法的驗證如圖4所示,其結果與real-time RT-PCR的結果基本吻合。

圖3 雞HOPX基因在7周齡15種組織中的表達特性(real-time RT-PCR)Fig.3 Tissue expression characterization of HOPX gene in 7-week-old broilers of NEAUHLF(real-time RT-PCR)
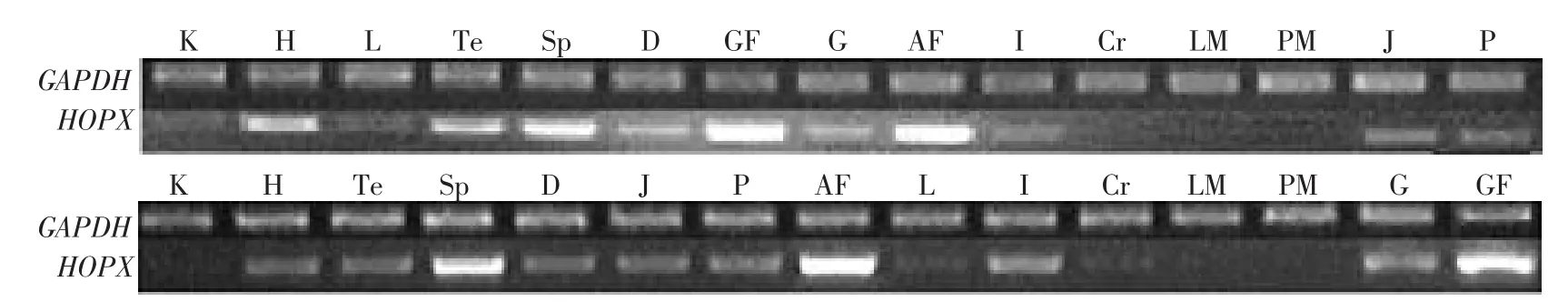
圖4 雞HOPX基因在7周齡15種組織中的表達特性(半定量RT-PCR)Fig.4 Tissue expression characterization of the HOPX gene in 7-week-old broilers of NEAUHLF(semi-quantitation RT-PCR)
2.2.2HOPX基因在高、低脂系肉雞脂肪發育過程中的表達情況
HOPX基因在脂肪組織中高表達,提示HOPX基因在脂肪組織的生長和發育中發揮作用。為了解HOPX基因在脂肪生長發育中的作用,采用real-time RT-PCR方法,檢測HOPX基因在高、低脂系肉雞脂肪組織生長發育過程中的表達規律及差異。結果顯示,隨著雞齡的增長和脂肪組織的生長發育,雞脂肪組織中,HOPX基因的表達呈上升趨勢;到7周齡時,HOPX基因在高、低脂兩系脂肪組織中表達量均略有下降,但之后又都持續上升;至9到12周齡時,HOPX的表達量趨于穩定。高、低脂兩系間脂肪組織HOPX基因表達量的比較分析還表明,高脂系雞的脂肪組織中HOPX基因的表達量均高于低脂系中的表達量,且在2、3、5、6、10、12周齡時,HOPX的表達量差異顯著(P<0.05),在1、8、11周齡時,HOPX的表達量差異極顯著(P<0.01),在4、7、9周齡時差異不顯著(見圖5)。
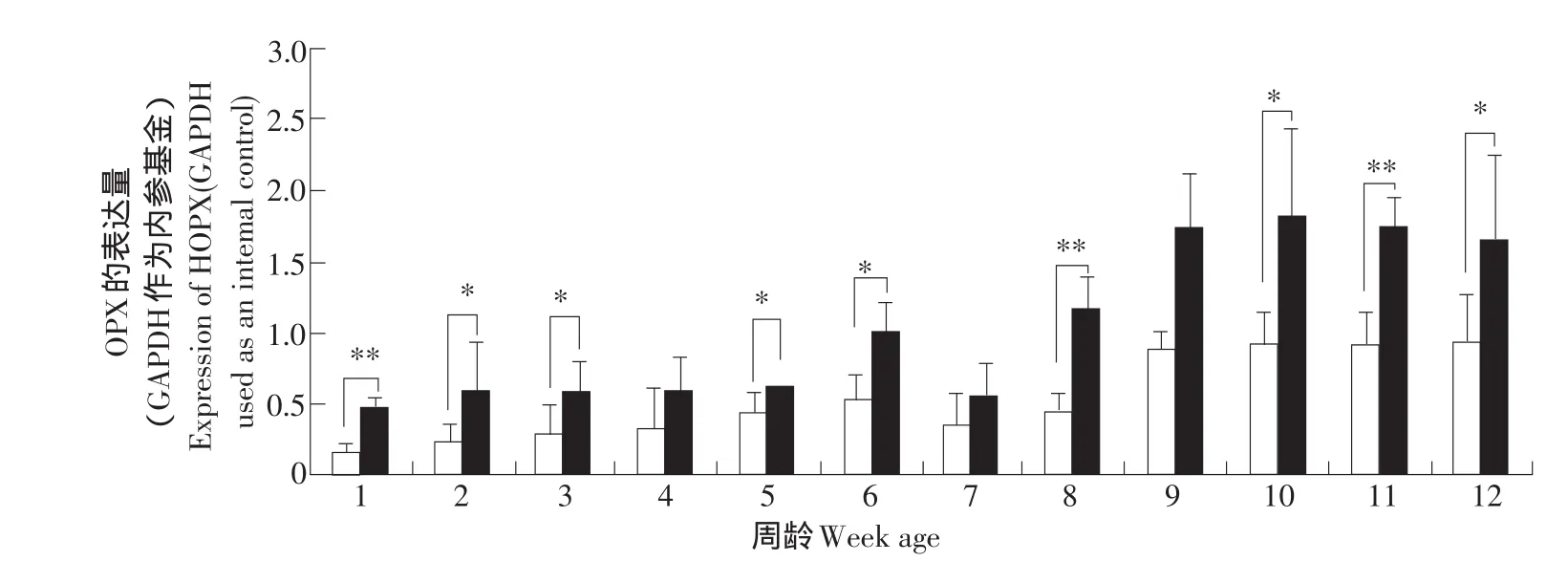
圖5 雞HOPX基因在高、低脂雞脂肪組織發育過程中的表達規律和差異(real-time RT-PCR)Fig.5 Tissue expression characterization of the HOPX gene in abdominal fat tissue of broilers of NEAUHLF(real-time RT-PCR)
2.2.3HOPX基因在脂肪細胞分化過程中的表達情況
脂肪組織的生長發育包括細胞的增殖和分化。為了進一步研究HOPX基因對于脂肪生長發育的作用,我們檢測了HOPX基因在脂肪細胞分化過程中的表達情況,結果見圖6。HOPX基因在脂肪細胞分化初期表達量下降,但隨著脂肪細胞的分化,其表達上升,在細胞分化72 h,表達量達到最高,隨后表達量下降。
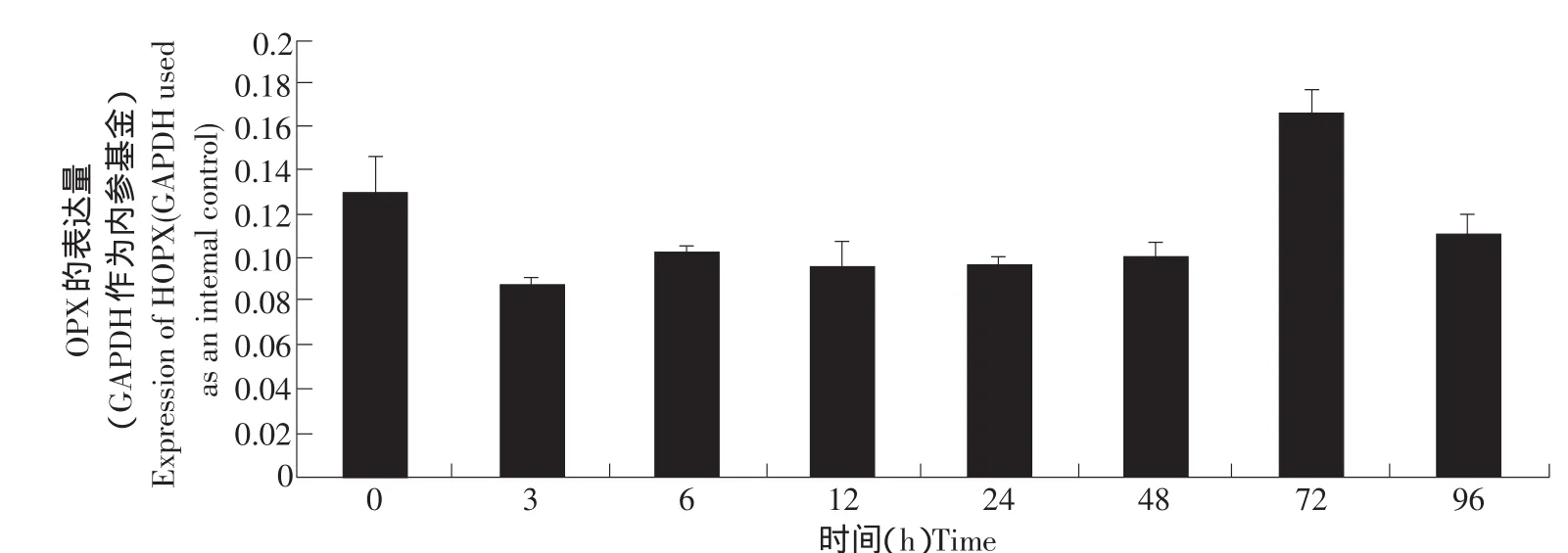
圖6 HOPX基因在脂肪細胞分化過程中的表達規律(real-time RT-PCR)Fig.6 Expression characterization of the HOPX gene in adipocyte differentiation(real-time RT-PCR)
3 討論與結論
本研究成功地克隆了雞HOPX基因的全長CDS區,所得序列與NCBI數據庫中已有的mRNA序列一致。雞HOPX基因與其他物種HOPX基因的同源性很高,其中,與火雞的同源性達100%,與鼠和人HOPX基因的相似度達75%以上,預示在不同物種中HOPX基因的作用相似。結構域分析顯示,與人和鼠等其他動物的HOPX相似,雞HOPX蛋白序列僅含有一個非典型HD結構域,不能結合DNA,這表明HOPX作用機制相似,通過蛋白間的互作參與調控基因表達。
本實驗室早期組織表達譜芯片分析和Northern blot分析發現,HOPX基因在雞脂肪組織中的表達量遠遠高于其它組織[23],本研究的HOPX基因的組織表達分析顯示,HOPX基因在脂肪組織中高表達,HOPX基因雖然在其他組織也有表達,但遠低于脂肪組織。研究表明,機體不同部位的脂肪組織存在異質性,不同部位脂肪組織細胞的增殖能力、脂滴沉積能力、誘導凋亡的敏感性以及相關轉錄因子的表達水平都不同[24-26],這可能是肌胃周圍脂肪組織和腹部脂肪組織HOPX基因表達量不同的原因。高、低脂雞脂肪組織表達分析顯示,高、低脂系雞的脂肪組織中,HOPX基因的表達存在顯著差異,表現為高脂系雞脂肪組織中的表達高于低脂系雞,提示HOPX可能參與脂肪的生長發育調控。HOPX基因在雞脂肪細胞分化過程中的表達檢測發現,隨著細胞分化程度的升高,HOPX基因的表達量逐漸增加,即分化程度高的脂肪細胞其HOPX基因的表達水平高。與低脂系雞相比,高脂系雞脂肪組織脂肪細胞的分化程度高,成熟脂肪細胞數量多[27],這可能是高脂系雞脂肪組織HOPX基因表達高于低脂系雞的原因。這些表達數據提示,HOPX基因在脂肪組織生長發育過程中發揮作用。
對哺乳動物研究顯示,HOPX基因參與心臟發育、心肌細胞分化、上皮細胞分化等的調控。目前尚未見HOPX基因在脂肪細胞分化中的研究報道,本研究首次報道了HOPX基因在脂肪組織中高表達;HOPX基因在高、低脂系肉雞脂肪組織生長發育過程存在表達差異,且隨著脂肪細胞分化程度的升高,其表達量逐漸增加。HOPX基因在脂肪細胞分化中的作用及作用機制還不清楚,有待深入研究。
[1] Adu J,Leong F T,Smith N R,et al.Expression of mOb1,a novel atypical 73 amino acid K50-homeodomain protein,during mouse development[J].Mech Dev,2002,119(Suppl 1):43-47.
[2] Kook H,Yung W W,Simpson R J,et al.Analysis of the structure and function of the transcriptional coregulator HOP[J].Biochemistry,2006,45(35):10584-10590.
[3] Zhang X,Azhar G,Zhong Y,et al.Identification of a novel serum response factor cofactor in cardiac gene regulation[J].J Biol Chem,2004,279(53):55626-55632.
[4] Wang D,Chang P S,Wang Z,et al.Activation of cardiac gene expression by myocardin,a transcriptional cofactor for serum response factor[J].Cell,2001,105(7):851-862.
[5] Trivedi C M,Zhu W,Wang Q,et al.HopxandHdac2 interact to modulate Gata4 acetylation and embryonic cardiac myocyte proliferation[J].Dev Cell,2010,19(3):450-459.
[6] Asanoma K,Kato H,Inoue T,et al.Analysis of a candidate gene associated with growth suppression of choriocarcinoma and differentiation of trophoblasts[J].J Reprod Med,2004,49(8):617-626.
[7] Kook H,Epstein J A.Hopping to the beat.Hop regulation of cardiac gene expression[J].Trends Cardiovasc Med,2003,13(7):261-264.
[8] Chen F,Kook H,Milewski R,et al.Hop is an unusual homeobox gene that modulates cardiac development[J].Cell,2002,110(6):713-723.
[9] Shin C H,Liu Z P,Passier R,et al.Modulation of cardiac growth and development by HOP,an unusual homeodomain protein[J].Cell,2002,110(6):725-735.
[10] Du KL,Ip H S,Li J,et al.Myocardin is a critical serum response factor cofactor in the transcriptional program regulating smooth muscle cell differentiation[J].Mol Cell Biol,2003,23(7):2425-2437.
[11] Wang Z,Wang D Z,Pipes G C,et al.Myocardin is a master regulator of smooth muscle gene expression[J].Proc Natl Acad Sci U S A,2003,100(12):7129-7134.
[12] Chen J,Kitchen C M,Streb J W,et al.Myocardin:a component of a molecular switch for smooth muscle differentiation[J].J Mol Cell Cardiol,2002,34(10):1345-1356.
[13] Kee H J,Kim J R,Nam K I,et al.Enhancer of polycomb1,a novel homeodomain only protein-binding partner,induces skeletal muscle differentiation[J].J Biol Chem,2007,282(10):7700-7709.
[14] Yang J M,Sim S M,Kim H Y,et al.Expression of the homeobox gene,HOPX,is modulated by cell differentiation in human keratinocytes and is involved in the expression of differentiation markers[J].Eur J Cell Biol,2010,89(7):537-546.
[15] Obarzanek-Fojt M,Favre B,Kypriotou M,et al.Homeodo-mainonly proteinHOPis a novel modulator of late differentiation in keratinocytes[J].Eur J Cell Biol,2011,90(4):279-290.
[16] Asanoma K,Kato H,Yamaguchi S,et al.HOP/NECC1,a novel regulator of mouse trophoblast differentiation[J].J Biol Chem,2007,282(33):24065-24074.
[17] Yamashita K,Kim M S,Park H L,et al.HOP/OB1/NECC1 promoter DNA is frequently hypermethylated and involved in tumorigenic ability in esophageal squamous cell carcinoma[J].Mol Cancer Res,2008,6(1):31-41.
[18] Yamaguchi S,Asanoma K,Takao T,et al.Homeobox geneHOPXis epigenetically silenced in human uterine endometrial cancer and suppresses estrogen-stimulated proliferation of cancer cells by inhibiting serum response factor[J].Int J Cancer,2009,124(11):2577-2588.
[19] Ooki A,Yamashita K,Kikuchi S,et al.Potential utility ofHOPhomeobox gene promoter methylation as a marker of tumor aggressiveness in gastric cancer[J].Oncogene,2010,29(22):3263-3275.
[20] Chen Y,Pacyna-Gengelbach M,Deutschmann N,et al.Homeobox gene HOP has a potential tumor suppressive activity in human lung cancer[J].Int J Cancer,2007,121(5):1021-1027.
[21] Chen Y,Petersen S,Pacyna-Gengelbach M,et al.Identification of a novel homeobox-containing gene,LAGY,which is downregulated in lung cancer[J].Oncology,2003,64(4):450-458.
[22] Asanoma K,Matsuda T,Kondo H,et al.NECC1,a candidate choriocarcinoma suppressor gene that encodes a homeodomain consensus motif[J].Genomics,2003,81(1):15-25.
[23] 王洪寶.影響雞脂類代謝重要基因的篩選及調控通路分析[D].哈爾濱:東北農業大學,2008:79,96-97.
[24] van Harmelen V,Skurk T,Rohrig K,et al.Effect of BMI and age on adipose tissue cellularity and differentiation capacity in women[J].Int J Obes Relat Metab Disord,2003,27(8):889-895.
[25] Tchkonia T,Giorgadze N,Pirtskhalava T,et al.Fat depot-specific characteristics are retained in strains derived from single human preadipocytes[J].Diabetes,2006,55(9):2571-2578.
[26] Tchkonia T,Tchoukalova Y D,Giorgadze N,et al.Abundance of two human preadipocyte subtypes with distinct capacities for replication,adipogenesis,and apoptosis varies among fat depots[J].Am J Physiol Endocrinol Metab,2005,288(1):E267-E277.
[27] Guo L,Sun B,Shang Z,et al.Comparison of adipose tissue cellularity in chicken lines divergently selected for fatness[J].Poult Sci,2011,90(9):2024-2034.

