林蛙油灌胃對小鼠肝組織中Cu/ZnSOD基因表達的影響
杜智恒,王慰慰,白秀娟
(東北農業大學動物科學技術學院,哈爾濱 150030)
中國林蛙(Rana chensinensis)作為一種藥用動物,其輸卵管的干燥物即林蛙油是我國傳統名貴藥材,具有補血壯體安神、美容養顏抗衰老、補腎延年益壽、平喘潤肺抗疲勞等功效。人體衰老是由于體內產生過量自由基而沒有得到及時清除引起的,而超氧化物歧化酶(Superoxide dismutase,SOD)則是清除這些自由基的重要酶之一[1],SOD廣泛存在于生物體內,能夠催化超氧陰離子發生歧化反應,專門清除生物體內超氧陰離子,平衡機體氧自由基,防止機體發生各種生理病變[2-4]。例如由于機體某些病理或生理(如衰老)原因,常常會出現因SOD驟減而導致自由基劇增等現象的發生[5]。目前已發現林蛙油能夠顯著延長果蠅平均壽命和最高壽命,其機制為升高SOD活性,降低過氧化脂質生成[6]。
根據SOD結合金屬離子不同,將其分為FeSOD、MnSOD、Cu/ZnSOD、NiSOD、MnFeSOD和Fe/ZnSOD六種類型[7],目前研究較多的是Cu/ZnSOD和MnSOD。MnSOD主要存在原核生物和真核生物線粒體中,在甲殼類細胞質中也有存在[8],而Cu/ZnSOD廣泛存在于細胞內,是集體防御氧化損傷的一種重要金屬酶,能轉移性地清除超氧陰離子自由基,在維持氧自由基平衡方面起著重要作用[9],并且占總SOD的90%。杜金芳等進行豬Cu/ZnSOD基因mRNA表達對肌肉抗氧化及肉質特性影響的研究,結果表明Cu/ZnSOD基因的mRNA表達存在品種和組織差異,品種間Cu/ZnSOD基因mRNA的差異表達通過影響肌肉中SOD活性,進而參與調控肉質特性形成[10]。Yuan等研究豚鼠(Cavia porcellus)不同組織中不同發育時期的抗氧化酶基因Cu/ZnSOD和MnSOD mRNA的表達水平。結果表明青春期豚鼠CuZnSOD mRNA表達由強至弱順序:肝>腎>肺>脾>心;MnSOD mRNA表達在心中最高,其組織特異性表達順序:心>腎>肝>肺>脾。說明在不同發育階段Cu/ZnSOD和MnSOD發揮著不同的作用[11]。
本研究以小鼠為動物模型,通過直接灌胃方法,驗證林蛙油抗氧化、抗衰老作用;利用Realtime PCR的方法分析小鼠肝臟組織中與抗氧化相關基因Cu/ZnSOD時空表達規律。
1 材料與方法
1.1 材料
1.1.1 實驗分組
雌性5周齡鼠和雌性15月齡鼠各120只,分別隨機分為4組,其中每組各30只,分籠飼養,每籠5只[1]。
1.1.2 林蛙油的處理
本試驗所用林蛙油為經過烘焙碾碎的林蛙油細粉(由哈爾濱大通集團有限公司提供),每次灌胃前用豆油稀釋林蛙油細粉,豆油添加量為每只鼠0.3~0.6 mL。
1.1.3 林蛙油給藥劑量及時間
根據人和小鼠用藥劑量的換算方法,小鼠用藥劑量是人用藥劑量的9倍[12],換算出小鼠每天的用藥劑量應為0.45 g·kg-1。本試驗共分3個劑量組,其中低劑量組給藥量為0.45 g·kg-1,中劑量組給藥量為1.35 g·kg-1,高劑量組給藥量為2.25 g·kg-1;最后一組為對照組,該組小鼠只以豆油灌胃。
給藥時間為每天1次,連續45 d。每天下午3點灌胃,試驗期每間隔7 d稱體重1次。
1.1.4 組織樣品采集
本實驗所用組織樣品為小鼠肝臟組織,采集時間分別在灌胃小鼠15、30和45 d時,通過屠宰小鼠采集肝臟組織。每次所采集的肝臟組織樣品均置于-80℃冰箱中保存待用,用于提取總RNA。
1.2 方法
1.2.1 總RNA的提取
每個樣品取約400 mg肝臟組織放入坩堝,立即倒入液氮進行充分研磨,按海基RNA提取試劑盒說明書推薦方法提取總RNA。將經紫外分光光度計和瓊脂糖凝膠甲醛變性電泳檢測合格的RNA,按照北京天根生物工程公司反轉錄試劑盒說明書要求將其反轉錄成cDNA備用。
1.2.2 引物設計
在NCBI中檢索小鼠目的基因序列,根據引物設計原則,設計實時熒光定量PCR引物。引物序列見表1。
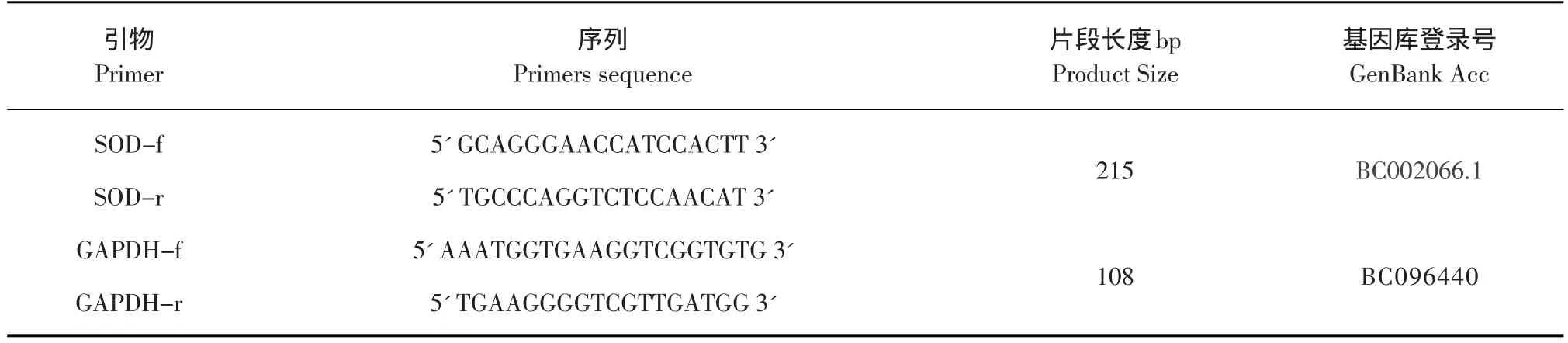
表1 Real time PCR引物序列Table1 Real time PCR primers sequence
1.2.3 RT-PCR反應條件
反應物組成:共25 μL體系,其中包括:滅菌去離子水,cDNA模板1 μg·μL-1,10× PCR Buffer,dNTP 2.5 mmol·L-1,特異引物10 pm·μL-1,rTaq聚合酶0.5 U·μL-1。反應體系為水16.3 μL,Buffer2.5 μL,dNTP2.0 μL,上下游引物各1 μL,cDNA模板2.0 μL,rTaq酶0.2 μL。
PCR擴增的循環參數為94℃5 min;94℃30 s,59℃30 s,72℃30 s循環次數為35;72℃延伸7 min。
1.2.3 標準曲線的制作
將同一組織cDNA混合作為標準品,以5×梯度稀釋:5-4,5-3,5-2,5-1,1,共 5 個梯度。引物分別為管家基因GAPDH和SOD基因的引物。每個基因的每個梯度做3次重復。SOD基因在各脅迫處理中表達的檢測與標準曲線均在同一次PCR循環中進行,以保證標準曲線和樣品擴增的PCR條件的一致性。PCR結束后,由7500PCR儀所得數據進行計算分析,根據某一基因標準曲線所得的線性計算公式,將該基因在各樣品中的Ct值代入線性公式,得到相對濃度。同一模板中SOD基因和GAPDH基因相對濃度比值即為SOD基因的相對表達水平。其中,SOD基因在灌胃豆油的對照組表達量設定為1.0。
1.2.4 Real time PCR反應條件
按照哈爾濱海基生物科技有限公司熒光定量PCR試劑盒(SYBR Green)說明書操作:
1.50μL標準PCR定量反應體系:

2.混勻定量體系,切忌劇烈震蕩。
3.分裝。
4.Real-Time PCR反應條件,采用兩步法:

5.將PCR管放入熱循環儀并啟動循環程序。
6.進行PCR產物融解曲線的分析。
1.2.5 統計分析方法
所有數據均以均數±標準差(X±S)表示,運用SPSS 17.0軟件采用f檢驗進行統計分析。P<0.05或P<0.01有統計學意義。
2 結果與分析
2.1 總RNA的分離
獲得小鼠肝臟組織的總RNA經紫外分光光度計測定,A260/A280比值均為1.8~2.0之間,甲醛凝膠電泳后可清晰見到18S和28S兩條核糖體RNA條帶(見圖1),說明本試驗肝臟組織在保存和提取過程中無明顯RNA降解發生,總RNA是完整的。
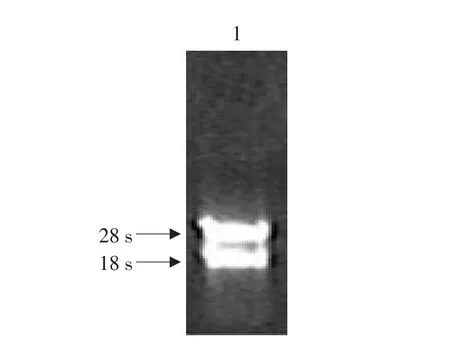
圖1 小鼠肝臟組織總RNA 1%甲醛瓊脂糖凝膠電泳分析Fig.1 1%formaldehyde agarose gel electrophoresis analysis of liver total RNA from mice
2.2 RT-PCR擴增結果
根據小鼠(BC096440)GAPDH基因和(BC002066.1)SOD基因的DNA序列各設計一對引物,均得到一條特異性擴增條帶,與預期擴增片段大小相一致,大約為108 bp(見圖2)和215 bp(見圖3)。
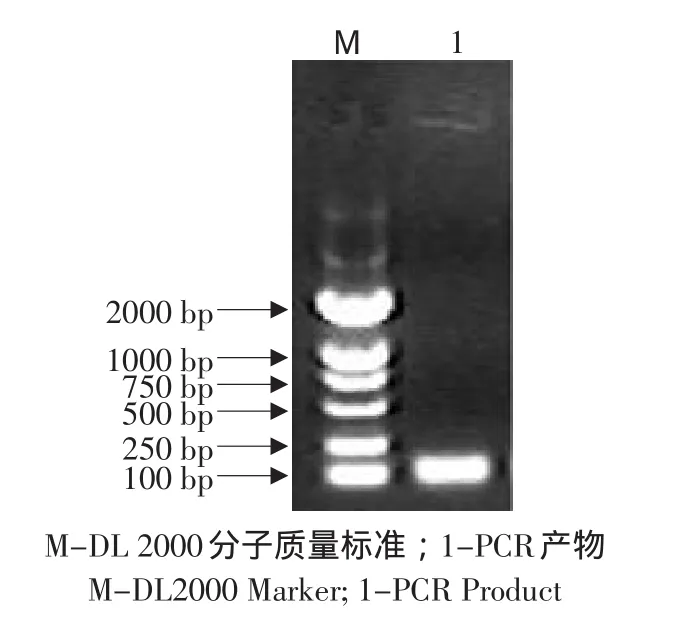
圖2 引物GAPDH RT-PCR擴增片段Fig.2 PCR amplify results of primer GAPDH
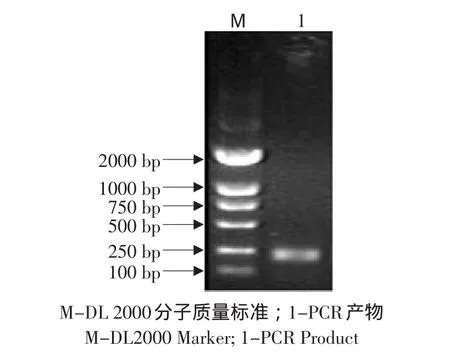
圖3 引物SOD RT-PCR擴增結果Fig.3 PCR amplify results of primer SOD
2.3 GAPDH基因標準曲線的制作
利用Real time PCR的標準曲線法,GAPDH基因在肝臟組織中的標準曲線和融解曲線如圖4、5所示。
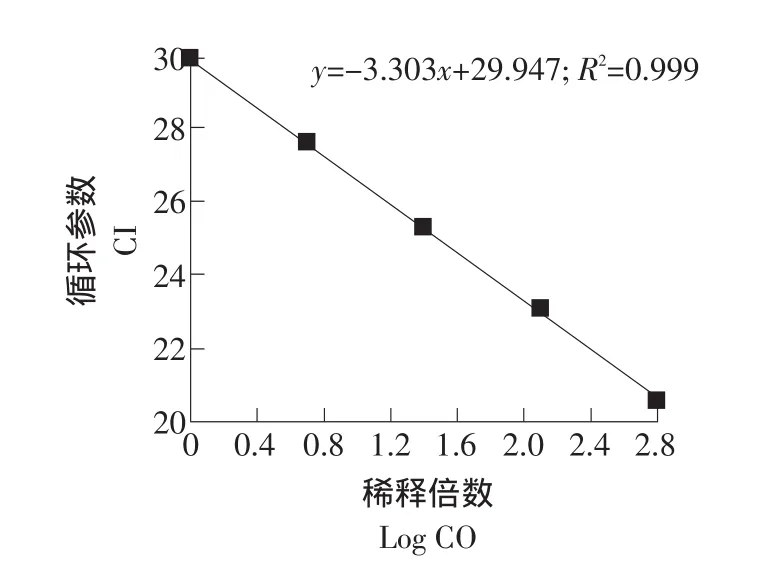
圖4 肝臟中GAPDH基因的標準曲線Fig.4 Standard curve of GAPDH gene in the liver
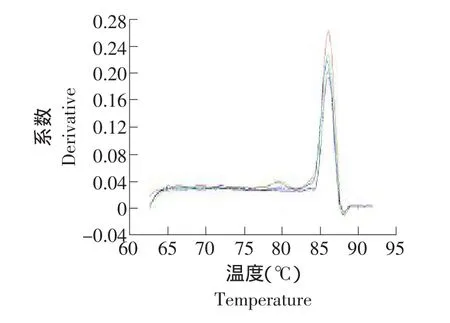
圖5 肝臟中GAPDH基因的融解曲線Fig.5 Dissociation curve of GAPDH gene in the liver
2.4 SOD基因在肝臟中的表達
2.4.1 SOD基因標準曲線的制作
以GAPDH基因作參照,用引物SOD擴增,每個梯度重復3次。SOD基因在肝組織中的標準曲線和融解曲線見圖6、7。
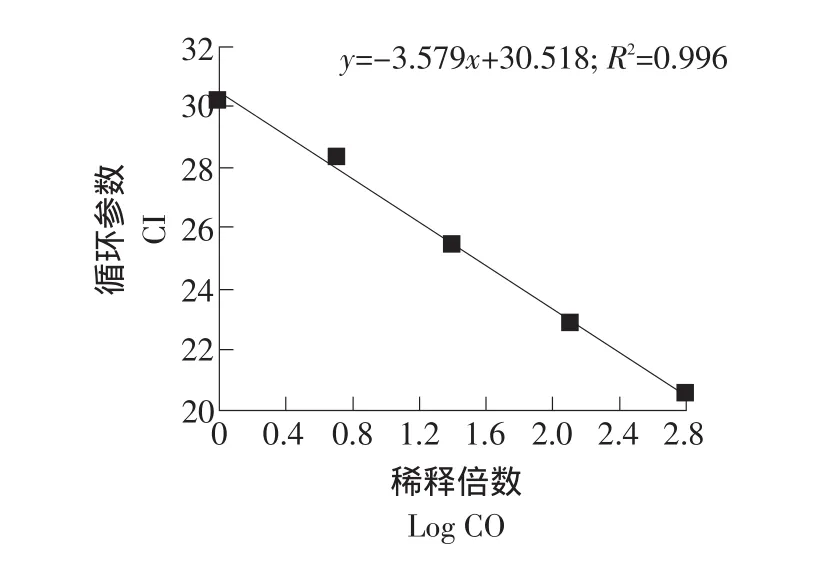
圖6 肝臟中SOD基因的標準曲線Fig.6 The standard curve of SOD gene in the liver
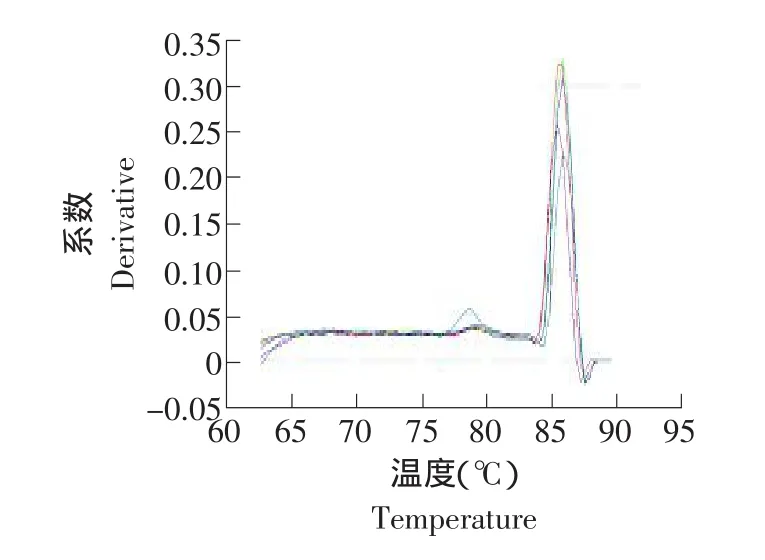
圖7 肝臟中SOD基因的融解曲線Fig.7 Dissociation curve of SOD gene in the liver
2.4.2 SOD基因在不同齡小鼠肝組織中的表達
根據標準曲線計算出SOD基因相對表達量,檢測不同劑量林蛙油灌胃后肝組織中SOD基因表達差異(見圖8、9)。
經數據統計分析發現,5周齡鼠灌胃第15天時0.45 g·kg-1劑量組肝組織中SOD基因表達量增加,與對照組差異極顯著(P<0.01),2.25 g·kg-1劑量組SOD基因表達量有增加的趨勢,但不顯著;灌胃30和45 d時,各劑量組與對照組基本一致,2.25 g·kg-1劑量組有一個抑制SOD基因表達的趨勢。說明5周齡鼠灌胃0.45 g·kg-1劑量15 d時,肝組織中SOD基因表達量最高(見表2、圖8)。
15月齡鼠灌胃15 d時,1.35g·kg-1劑量組與對照組相比肝組織中SOD基因表達量有增加的趨勢;灌胃第30天和45天時1.35 g·kg-1劑量組肝臟SOD基因表達量增加,與對照組差異極顯著(P<0.01),其他劑量組與對照組比較差異不顯著。因此15月齡鼠在灌胃1.35 g·kg-1劑量30 d時,肝組織中SOD基因表達量最高(見表3、圖9)。
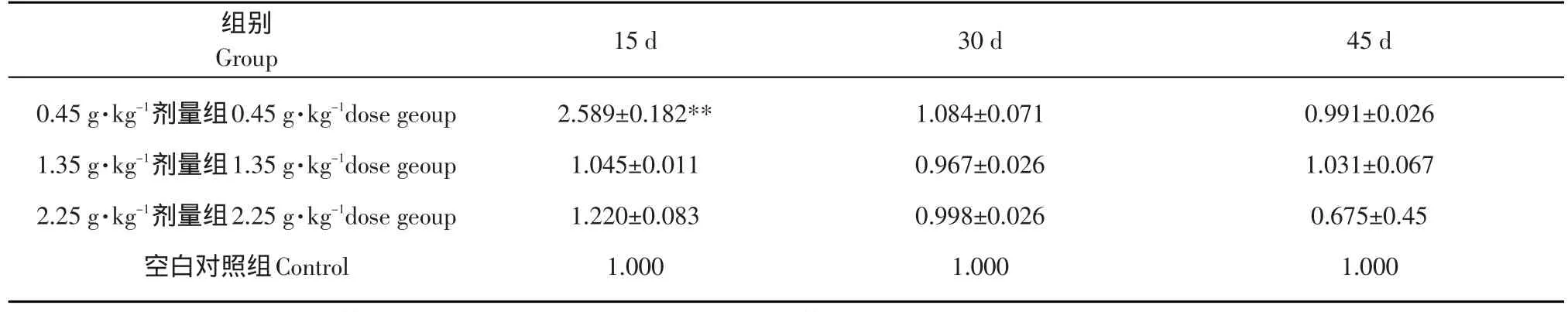
表2 SOD基因在不同灌胃劑量組5周齡鼠肝臟組織中的表達量Table2 SOD genes expression with different amounts of gastric lavagethe in youth rat liver
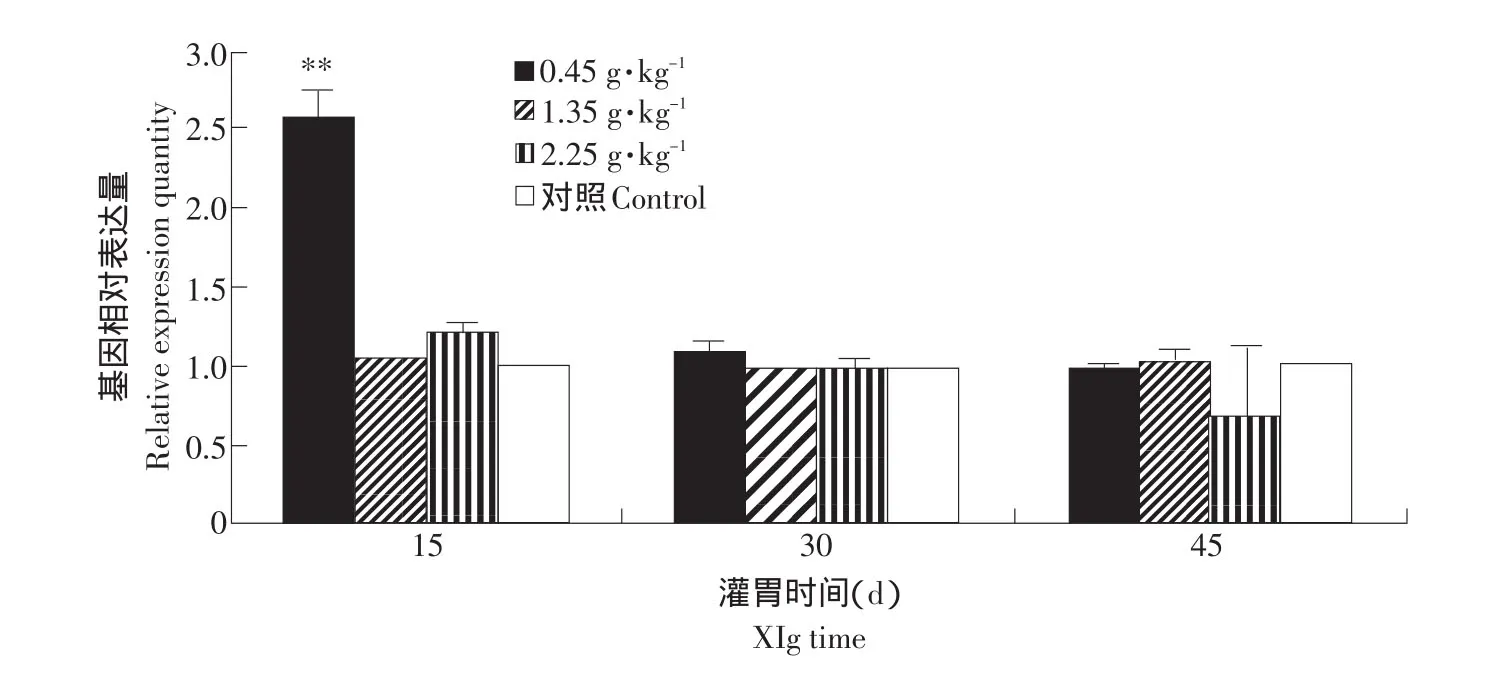
圖8 SOD基因在不同灌胃劑量組5周齡鼠肝臟組織中表達量的變化Fig.8 Volume changes of SOD gene fed the liver tissue in the different dose groups of young rats
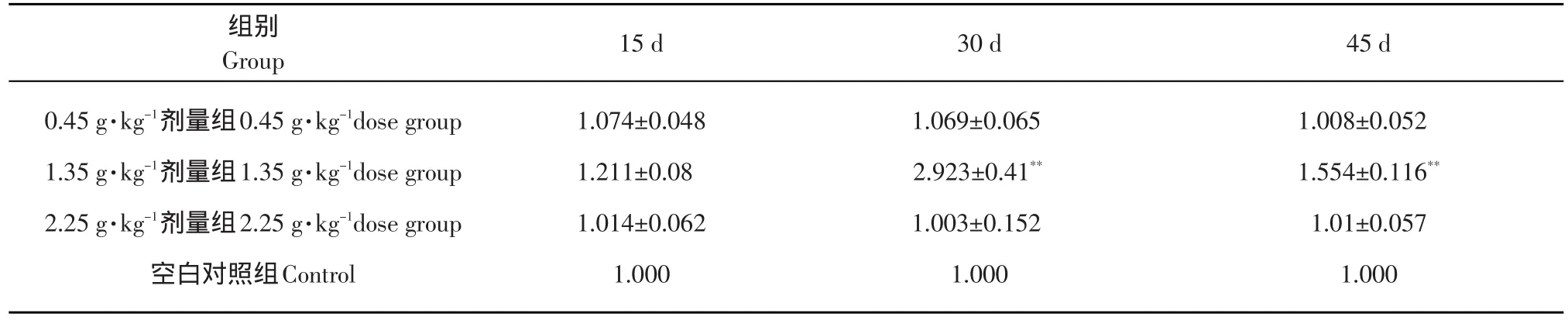
表3 SOD基因在不同灌胃劑量組15月齡鼠肝臟組織中的表達量Table3 SOD genes expression with different amounts of gastric lavagethe in old rat liver
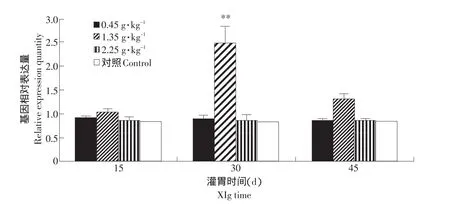
圖9 SOD基因在不同灌胃劑量組老年鼠肝臟組織中表達量的變化Fig.9 Volume changes of SOD gene fed the liver tissue in the different dose groups of old rats
3 討論與結論
據研究,一定劑量林蛙油可以增加卵巢、紅細胞及血清中SOD活性,降低肝臟及腦組織中MDA含量[13]。本試驗通過對小鼠灌胃不同劑量的林蛙油,檢測其肝組織中Cu/ZnSOD基因的表達規律。結果表明,5周齡組和15月齡組小鼠灌胃林蛙油后,肝組織中Cu/ZnSOD基因表達量顯著增加,但總體上看,5周齡鼠0.45 g·kg-1劑量組Cu/ZnSOD基因表達增加量要普遍高于2.25 g·kg-1劑量組,但與1.35 g·kg-1劑量組差異不顯著;而15月齡鼠1.35 g·kg-1劑量組Cu/ZnSOD基因表達增加量要顯著高于0.45 和2.25 g·kg-1劑量組,但0.45和2.25 g·kg-1劑量組差異不顯著;15月齡組Cu/ZnSOD基因表達量升高的速度較慢,一般在灌胃第30天或第45天才出現顯著差異。高濃度與低濃度林蛙油對Cu/ZnSOD基因表達影響的差異,可能是由于過高濃度的林蛙油已經超過了小鼠身體所能接受的極限值,從而引起機體的一些不適反應,對目的基因mRNA轉錄有一定的抑制作用。并且15月齡鼠與5周齡鼠相比,體內SOD酶活性已經降低、SOD基因表達量亦下降,林蛙油的活性物質作用于靶器官時對自由基造成的損傷需要時間修復,因此15月齡鼠的Cu/ZnSOD基因表達量上調緩慢。表明SOD在衰老過程中扮演著重要角色。Orr曾將Cu/ZnSOD基因導入果蠅,導致轉基因株具有多個復制的Cu/ZnSOD基因,從而壽命比野生型長1/3[14]。另外,2004年王春花研究發現,不同月齡快速老化模型鼠肝細胞中Cu/ZnSOD基因表達隨年齡的增加其mRNA的表達量具有明顯的下降趨勢(P<0.01)[15]。
本研究證明林蛙油具有明顯的抗氧化抗衰老作用。在衰老過程中SOD基因隨年齡的增長,其表達量呈下降趨勢。其機制是自由基直接與核酸反應引起RNA主鏈斷裂,堿基降解及氫鏈破壞,對熱的穩定性發生改變。由于MDA引起交聯,使遺傳物質破壞,從而影響傳遞信息的功能以及轉錄與復制的特性,導致以mRNA為直接模板的蛋白質合成能力下降并產生合成差錯,從而引起酶的減少和失活。隨著分子生物學技術的日趨發展,衰老機制的研究達到基因水平,本研究為從分子水平上闡明抗氧化抗衰老作用機制奠定初步理論基礎。
[1]Kakarla P,VadluriG,Reddy K S,et al.Vulnerability of themid aged rat myocardium to the free age2 induced oxidative stress:Influence of exercise training on antioxidant defense system[J].Radic Res,2005,39:121-127.
[2]傅曉龍,劉洪珍.運動性腎組織氧化損傷與抗氧化能力[J].中國臨床康復,2006,10(36):123-125.
[3]Carter A B,Tephly L A,Venkataraman S,et al.High levels of catalase and glutathione peroxidase activitydampen H2O2signaling in human alveolar macrophages[J].Am J Resp Cell Mol Biol,2004,31(1):43-53.
[4]Crack P J,Taylor J M.Reactive oxygen species and the modulation of stroke[J].Free Radical Biol Med,2005,38(11):1433-1444.
[5]曾慶平,郭勇.SOD基因的組織結構、表達與分子克隆[J].藥物生物技術,1995,2(2):46-51.
[6]姚暉,姚銳,原海曉,等.哈蟆油對D-半乳糖致衰老模型雌性大鼠的實驗研究[J].時珍國醫國藥,2010,2(5):1148-114.
[7]張克烽,張子平,陳蕓,等.動物抗氧化系統中主要抗氧化酶基因的研究進展[J].動物學雜志,2007,42(2):153-160.
[8]Winton Cheng,Ying-Hsiu Tung,Tzu-Ting Chiou,et al.Cloning and characterisation of mitochondrial manganese superoxide dismutase(mtMnSOD)from the giant freshwater prawn Macrobrachium rosenbergii[J].Fish Shellfish Immunol,2006,21(4):453-466.
[9]Noor R,Mittal S,Iqbal J.Superoxide dismutase-applications and relevance to human diseases[J].Med Sci Moint,2002,8(9):210-215.
[10]杜金芳,曾勇慶,陳偉,等.豬CuZnSOD基因的克隆、表達及功能分析[J].遺傳,2010,32(10):1037-1042.
[11]Yuan H T,Bingle C D,Kelly F J.Differential patterns of antioxidant enzyme mRNA expression in guinea pig lung and liver during development[J].Biochim Biophys Acta,1996,1305(3):163-171.
[12]黃繼漢,黃曉暉,陳志揚,等.藥理試驗中動物間和動物與人體間的等效劑量換算[J].中國臨床藥理學與治療學,2004,9(9):1069-1072.
[13]金莉莉,劉德文,王秋雨.中國林蛙卵卵油及輸卵管對紅細胞SOD活性的影響[J].中國公共衛生,2002,18(5):607.
[14]Orr W C,Sohal R S.Extension of life-span by overexpression of superoxide dismutase and catalase in Drosophila melanogaster[J].Science,1994,263(5150):1128-1130.
[15]王春花,劉克明,劉玉清.SOD基因表達與衰老的相關性[J].中國公共衛生,2004,20(8):953-954.

