宮頸癌中Survivin mRNA的表達及其臨床價值
湖北省武漢市第五醫院婦科
黃 玲 鄧梅先 宋 芳 劉敏娟 沈漢斌
惡性腫瘤的發生、發展是一個涉及到多基因的分子水平變化的多階段過程。近年分子生物研究表明,宮頸癌為多基因、遺傳、環境等致癌因素等誘導下綜合作用的結果,細胞凋亡在宮頸癌發生發展過程中起重要作用。survivin也稱生存素或生存蛋白,是凋亡抑制蛋白家族(IAP)的成員,在體外能夠直接抑制細胞凋亡下游效應器caspase的活性,具有強大的抗凋亡作用[1,2]。在此我們運用RTPCR方法對22例宮頸癌及其癌旁組織,以在mRNA水平評價survivin基因表達及其變化,了解其與新輔助化療療效之間的相關性,為新輔助化療尋找有效的預測因子。
1 資料與方法
1.1 病例及分組 宮頸癌組:選取2003~2009年間我院收療的宮頸癌組織22例,病理診斷均為宮頸癌。年齡29~59歲,平均年齡37.2歲。22例宮頸癌中腺癌4例,鱗癌18例。臨床病理分期為:Ⅰb期12例,Ⅱa期8例,Ⅱb期2例。癌旁組織組:標本取自上述22例病例距腫瘤2cm以遠的組織,經病理檢查均無癌。所有樣品取出后均凍存于-70℃待檢。
1.2 化療方案 所有患者接受PVB或PF方案的新輔助化療方案,10天為1個周期,共進行2個療程。在接受新輔助化療前接受臨床觸診估測及超聲檢測,每周期化療結束后重新測量腫瘤大小,全部化療結束后再檢測。腫瘤對化療的臨床評價根據WHO標準[3],腫瘤對化療反應的組織學評價根據Ogston的分級方法[4]。
1.3 Survivin mRNA檢測 Trizol試劑購自Gibco公司。MMLV逆轉錄酶、RNA抑制物為Promega公司產品。DNA聚合酶購自日本Takara公司。兔抗人survivin多克隆抗體為Santa Cruz公司產品。辣根過氧化物酶標記的羊抗兔IgG購自北京中山生物工程公司。
取凍存組織50~100mg,加入1ml Trizol(Gibco公司)充分勻漿,按照二步法提取組織中的總RNA。取少量樣本測定RNA的濃度(計算濃度公式為:樣品的A260值×40×稀釋倍數,單位是μg/ml)和純度(樣品的A260/A280比值),紫外分光光度儀A260nm/A280nm讀數在1.8~2.0之間方繼續試驗。
應用20μl反應體系,每管中加入模板RNA1μg,oligo(dT)50pmol,5×PCR反應緩沖液4μl,dNTP混合物(10mmol/L)2μl,R Nase Inhibitor20U,MMLV反轉錄酶10U,加DEPC處理的水至20μl。混合后2500r/min離心2min,室溫放置10min后轉入42℃反應1h,99℃5min滅活反轉錄酶活性,冰水中冷卻2min,完成cDNA合成。人類survivin的PCR引物為5′-CTCAAGGACCACCGCATCTC-3′和5′-CCTCAATCCATGGCAGCCAG-3′,合成產物為392bp,合成產物247 bpβ-actin作為內參照。所有引物由上海生工生物工程公司合成。
1.4 統計學方法 采用SPSS 12.0統計軟件分析。根據數據性質采用χ2檢驗。P<0.05有統計學意義。
2 結果
2.1 Ssurvivin mRNA表達 宮頸癌組標本中Survivin mRNA陽性率為77.3%(17/22),而癌旁組織組表達陰性。而β-actin在宮頸癌組織和對照的癌旁組織中的表達強度基本一致(見圖1)。
2.2 新輔助化療的效果 22例患者經過新輔助化療后,有1例獲得臨床完全緩解(cCR),占4.5%(1/22);12例獲得臨床部分緩解(PR),占54.5%(12/22);9例獲得臨床穩定(SD),占40.9%(9/22),無1例發生疾病進展(PD)。
2.3 Ssurvivin mRNA在宮頸癌患者各特征性因素中的表達 Survivin mRNA表達陽性在37.2歲以下為10/12(83.3%),37.2歲以上為7/10(70.0%);病理分型:腺癌為4/4(100.0%),鱗癌為13/18(72.2%);腫瘤分期:Ⅰb為9/12(75.0%),Ⅱa期為6/8(75.0%),Ⅱb期為2/2(100.0%);Survivin mRNA的表達與患者的年齡、病理分型、分期均無關(P>0.05);Survivin mRNA表達陽性在新輔助化療后完全緩解(cCR)的患者中為0/1(0.0%)、獲得臨床部分緩解(PR)的患者為8/12(66.7%)和獲得臨床穩定(SD)的患者為9/9(100.0%),差異有統計學意義(P<0.05)。
3 討論
宮頸癌是發病率和病死率僅次于乳腺癌的最常見的女性惡性腫瘤。近40年來隨著宮頸癌篩查的普及開展,其發病率及病死率已明顯下降,但有年輕化趨勢,關于這種趨勢的原因和特點已引起國內外的廣泛關注[5]。宮頸癌細胞的侵襲和轉移是一個復雜過程,涉及到血管、淋巴管新生、細胞外基質降解和細胞凋亡調控等很多因素。
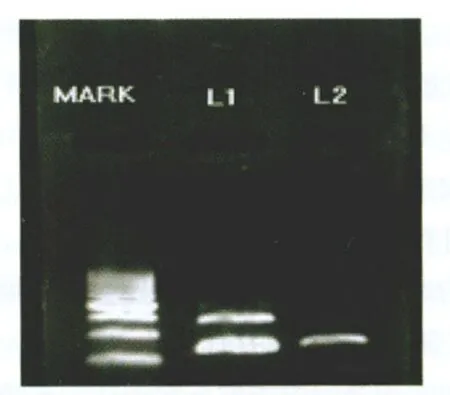
注:L1為宮頸癌擴增電泳結果(392bp);L2為宮頸癌旁組織電泳結果
近年研究發現,凋亡抑制蛋白(Inhibitors of apoptosis proteins,IAPs)家族在細胞凋亡的基因調控中發揮重要作用[6],凋亡不僅在正常生理調節中起關鍵作用,在惡性病變過程中也起著重要作用。細胞凋亡過程受凋亡抑制基因與凋亡活化基因的共同調節[7,8]。survivin是凋亡抑制蛋白家族的新成員,是IAP家族中最小的成員,它由定位在人染色體17q25位點的單拷貝基因編碼,是含有142個氨基酸、相對分子質量為16 500的蛋白,具有抑制凋亡和調節細胞分裂的作用[7]。survivin其結構獨特,僅含有一個桿狀病毒凋亡抑制蛋白重復序列(BIR)分子,作用于各種凋亡通路末端效應分子,是迄今發現最強的凋亡抑制因子之一。實驗研究證實[9],survivin能抑制Fas、caspase、bax及某些化療藥物誘導的細胞凋亡。survivin的組織分布特征具有明顯的細胞選擇性,在正常成人組織中幾乎未檢測到survivin基因的表達[10]。而在大多數腫瘤組織內有survivin的表達,這種重新表達的機制目前尚不明確[11]。survivin具有周期依賴性表達及抗凋亡作用。
Kim等[12]采用免疫組化方法檢測了4l例宮頸內皮瘤和宮頸鱗狀細胞癌,結果顯示survivin在低度鱗狀上皮內瘤樣病變、高度鱗狀上皮內瘤樣病變及SCC中的陽性表達率分別是66.7%、87.5%和100%,差異有統計學意義(P<0.01),表明sruvivi陽性表達與宮頸腫瘤的進展密切相關。本研究對宮頸癌組織Survivin mRNA表達測定發現,宮頸癌細胞高表達Survivin mRNA,本組陽性率為77.3%。腫瘤細胞Survivin mRNA表達水平較正常宮頸組織明顯增高,表明其與宮頸癌發生發展密切相關,可能是參與抑制惡性瘤細胞的凋亡過程中的關鍵因素。Survivin mRNA表達與臨床特征相關性的分析顯示,腫瘤內Survivin mRNA的表達與宿主年齡、病理分型、分期均無關。
研究顯示,survivin與宮頸癌的形成和發展有著密切的關系[13],其過度表達可克服凋亡的關卡,通過有絲分裂促進轉化細胞的異常增殖;survivin的過表達可能與化療藥物的耐藥性相關[14]。本研究結果顯示,宮頸癌化療Survivin mRNA的表達水平與新輔助化療療效存在相關性,即新輔助化療后獲得臨床穩定(SD)的患者、獲得臨床部分緩解(PR)和完全緩解(cCR)的患者相比,后者的化療療效好于前者。本研究結果顯示了Survivin mRNA的表達陽性的化療療效效果差也可能與順鉑耐藥相關。
通過對宮頸鱗癌組織及癌旁組織中Survivin mRNA表達的研究,提示宮頸癌的發生、發展與細胞凋亡調節異常及細胞增殖活性增加有關。Survivin mRNA的異常表達與宮頸癌的發生、發展相關,可以作為宮頸癌新輔助化療療效的手段之一。Survivin mRNA在宮頸癌組織中的異常表達,導致細胞凋亡減少,對宮頸癌的發生起到重要作用,可為臨床篩查宮頸癌及判斷預后提供新的依據和診斷指標。
[1] Li F,Ambrosini G,Chu EY,et al.Control of apoptosis and mitotic spindle checkpoint by surviving[J].Nature,1998,396(6711):580 -584.
[2] Zhao J,Tenev T,Martins LM,et al.The ubiquitin proteasome pathway regulates survivin degradation in a cell cycle dependent manner[J].J Cell Sci,2000,113(23):4363-4371.
[3] Miller AB,Hoogstraten B,Straquet M,et al.Reporting results of cancer treatment[J].Cancer,1981,47(1):207-214.
[4] Ogston KN,Miller I,Payne S,et a1.A new histological grading system to assess response of breast cancers to primary chemotherapy:prognostic significance and surviva1[J].Breast,2003,12(5):320-327.
[5] Bulk S,Visser O,Rozendaal L,et al Cervical cancer in the Netherlands 1989-1998:decrease of squamous cell carcinoma in older women,increase of adenocarcinoma in younger women[J].Cancer, 2005,113(6):1005-1009.
[6] Nachmias B,Ashhab Y,Ben-Yehuda D.The inhibitor of apoptosis protein family(IAPs):an emerging therapeutic target in cancer[J].Semin Cancer Biol,2004,14(4):231-243.
[7] Mita AC,Mita MM,Nawrocki ST,et al.Survivin:key regulator of mitosis and apoptosis and novel target for cancer therapeutics[J].Clin Cancer Res,2008,14(16):5000-5005.
[8] Pennati M,Folini M,Zaffaroni N.Targeting survivin in cancer therapy:fulfilled promises and open questions[J].Carcinogenesis,2007,28(6):1133-1139.
[9] Lee JP,Chang KH,Hart JH,et a1.survivin,a nocel anti-apoptosis inhibitor,expression in uterine cervical cancer and relationship with prognostic factors[J].Int J Gynecol Cancer,2005,15(1):113-119.
[10] Ambrosini G,Adida C,Altieri DC.A novel anti-apoptosis gene,survivin,expressed in cancer and lymphoma[J].Nat Med,1997,3(8):917 -921.
[11] Adida C,Crotty PL,Mograth J,et al.Developmentally regulated expression of the novel cancer anti-apoptosis gene surviving in human and mouse differentiation[J].Am J Pathol,1998,152(1):43-49.
[12] Kim HS,Shiraki K,Park SH.Expression of survivin in CIN and invasive squamou cell carcinoma of uterine cervix[J].AnticancerRes,2002,22(2A):805-808.
[13] Kim HS,Shiraki K,Rark SH.Expression of survivin in CIN and invasive squamous cell carcinoma of uterine cervix[J].Anticancer Res,2002,22(2A):805-808.
[14] Xiong HH,YU SY,Zhang L,et a1.Changes of survivin mRNA and protein expression during paclitaxel treatment in breast cancer cells[J].JHuazhongUniversity of science and Technology,2007,27:65-67.

