醋酸鉛對豚鼠耳蝸橄欖束傳出神經毒性的研究
高映勤 馬靜 張鐵松 林建云 林墾 李正才 阮標
鉛是廣泛存在于自然界的一種重金屬,隨著現代工業的發展,鉛隨煙塵、礦塵、污水、廢渣等多種載體進入工作區和生活環境,對機體生長發育、神經系統產生不可逆的損害。近年來,鉛對聽覺系統的損害已逐漸引起人們的重視,但其對聽覺系統損害的確切機制和部位尚不清楚。內側橄欖耳蝸傳出神經系統對正常聽覺發揮著重要作用,是進行音調定位組合并對雙耳聲音進行整合的場所,其功能在于提高聽神經閾值,從而能在噪聲環境中對足夠的聲信號源產生反應。鉛中毒是否會導致耳蝸傳出神經形態及功能異常的研究目前尚未見報道,本研究采用乙酰膽堿酯酶組織化學染色方法和畸變產物耳聲發射(DPOAE)對側聲抑制效應檢測,定量分析醋酸鉛對豚鼠內側橄欖耳蝸傳出神經纖維的影響。
1 材料與方法
1.1主要試劑 醋酸鉛(上海化學試劑廠分析純030802),臨用前將醋酸鉛溶于去離子水,配成濃度為0.25%的溶液;碘代乙酰硫膽堿為英國SIGMA公司生產。
1.2實驗動物與造模方法 選用健康成年豚鼠70只,雌雄不拘,耳廓反射靈敏,體重250~300 g(昆明醫學院動物科提供)。隨機分為高鉛組(30只)、低鉛組(30只)和對照組(10只)。實驗前喂養觀察一周后,高鉛組、低鉛組分別按40 mg/kg和10 mg/kg醋酸鉛腹腔注射,每天1次,連續1周,對照組腹腔注射生理鹽水1 ml,連續一周。每組分別于停藥后14天和28天各取15只分別行DPOAE對側抑制效應及血鉛含量檢測后斷頭處死,進行耳蝸基底膜鋪片染色。
1.3DPOAE檢測 3%戊巴比妥40 mg/kg腹腔內注射麻醉后將豚鼠置于屏蔽室,應用ILO92(Nicolet,美國)耳聲發射儀,將直徑為2 mm的硅膠管制成自制探頭套于與其配套的嬰兒探頭,封閉外耳道口。f2/f1=1.20,初始音強度為L1=65 dB SPL,L2=55 dB SPL,疊加次數80~120次,對側均以隨機順序給以60 dB SPL白噪聲,分別測試有無對側白噪聲時的DPOAE幅值,以DPOAE幅值大于本底噪聲3 dB為引出標準,以2 kHz處幅值變化為準測出其抑制幅度。
1.4血鉛含量的測定 采用石墨爐原子吸收法于各時間點分別檢測各組動物血清鉛的含量。
1.5乙酰膽堿酯酶組織化學染色 暴露耳蝸及卵圓窗、圓窗,去掉鼓膜張肌,開放蝸尖,新鮮配置的4%多聚甲醛行耳蝸灌流。固定24小時后,取出基底膜,浸入0.1 mol/L醋酸鹽緩沖液30分鐘。將樣品移入新鮮配制的乙酰膽堿酯酶組化反應液[含6.5 ml 0.1 mol/L醋酸鹽緩沖液(pH=6.0),5 mg碘代乙酰硫膽堿,0.5 ml 0.1 mol/L枸櫞酸鈉溶液,1 ml 30 mmol/L硫酸銅,1 ml 雙蒸餾水和1 ml 5 mmol/L鐵氰化鉀溶液]在室溫下作用30分鐘,用0.1 mol醋酸鹽緩沖液(pH=6.0)漂洗基底膜樣品3次,每次1分鐘;將樣品移入1%硫化銨溶液顯色1分鐘;用0.1 mol/L硝酸鈉溶液漂洗樣品5次,每次1分鐘;將樣品浸入0.1%硝酸銀溶液1分鐘,用0.1 mol/L硝酸鈉溶液漂洗樣品1分鐘后再用0.1 mol/L醋酸緩沖液漂洗1分鐘[1],將染色好的基底膜按解剖學位置分回截斷,各回一一放在已滴好甘油的玻片上,蓋片封片,顯微鏡觀察。在網格測距器下計數100 μm基底膜內側耳蝸橄欖束傳出神經(media olivocochlear efferent nerve,MOC)纖維平均根數。
1.6統計學方法 采用SPSS10.0統計軟件,對數據進行單因素方差分析(ANOVA),組間比較用最小顯著差法(LSD)檢驗,相關性用相關分析,方差不齊用秩和檢驗。
2 結果
2.1各組豚鼠的血鉛含量(表1) 低鉛組和高鉛組的血鉛含量均比正常對照組顯著增高(P<0.01),但隨著時間的延長,低鉛組血鉛濃度逐漸下降,而高鉛組血鉛代謝緩慢。染毒動物的血鉛含量隨劑量的增高而增加,存在確切的劑量-反應關系(r=0.799,P<0.01)。
2.2醋酸鉛對豚鼠內側橄欖耳蝸傳出神經的影響 乙酰膽堿活性的反應產物為亞鐵氰化銅棕黑色沉淀,清晰的定位在傳出神經纖維及末梢。對照組MOC纖維及末梢在耳蝸各回的分布不一致(表1),鉤回、第一、二回傳出神經分布差別不大,第三、第四回傳出神經末梢逐漸減少,底回神經纖維較粗,而頂回纖維較細(圖1)。高鉛組停藥2周后,傳出神經纖維連續性中斷,耳蝸乙酰膽堿酯酶終末反應物減少,以鉤回、第一回神經纖維損傷嚴重(圖2),4周后鉤回、第一回僅殘留少量的神經末梢(圖3);低鉛組耳蝸傳出神經未見明顯損傷(圖4)。定量分析顯示(表1):醋酸鉛可對豚鼠內側橄欖耳蝸傳出神經系統產生不可逆性的損害,鉤回、第一回和停藥后4周傳出神經纖維損害最顯著。經方差分析,高鉛組MOC纖維平均根數較低鉛組和對照組顯著減少,差異有顯著統計學意義(P<0.01)。
2.3DPOAE和對側抑制效應測試結果 對照組和低鉛組均引出DPOAE,并出現了不同程度的對側聲抑制現象,對照組對側聲抑制幅度3.64±1.70 dB,低鉛組停藥后14天和28天分別為3.06±1.19dB和2.86±1.33 dB,與對照組抑制幅值均值相比差異無統計學意義(P>0.05)。高鉛組停藥14天后,15耳中9耳未引出耳聲發射,另6耳耳聲發射存在,給予對側白噪聲后出現抑制現象,抑制幅度為0.65~1.38 dB,因多數無抑制現象,故其均值為0.74±0.61 dB,與對照組抑制幅值均值相比差異有統計學意義(P<0.05);高鉛組停藥后28天DPOAE均未引出。
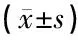
表1 各組豚鼠血鉛含量、傳出神經纖維在耳蝸的分布
注:*與對照組及低鉛組同一時間比較,P<0.01

圖1 正常耳蝸基底膜鉤回傳出神經密度均勻,纖維連續(×100)圖2 高鉛組用藥2周后鉤回神經纖維連續性中斷,乙酰堿酯酶終末反應物減少(×100)圖3 高鉛組用藥4周后鉤回神經纖維絕大部分消失(×100)圖4 低鉛組用藥4周后鉤回神經纖維均勻,分布清晰(×100)
3 討論
耳蝸橄欖束是將信息由大腦皮質或高位聽覺中樞傳至低位聽覺中樞或外周聽覺器官的傳出神經束,其胞體位于上橄欖復合體內,其功能在于提高聽神經閾值,使之對掩蔽噪聲不太敏感從而能在噪聲環境中對足夠的信號源產生反應。聽覺系統對鉛的毒性較敏感,鉛可對聽覺系統產生持續的影響,但鉛中毒對聽覺系統損害的確切機制與部位仍不十分清楚。鉛是一種強神經毒物,其神經毒性和神經系統細胞的凋亡有關[2]。鉛通過對神經細胞膜的離子代謝、酶的活性、神經遞質的釋放、攝取和儲存及第二信使系統的干擾,影響細胞和神經的代謝活動。細胞內游離的鈣離子直接參與調節耳蝸傳出神經系統的活動,包括去極化、復極化、神經遞質的傳遞,在聽覺系統傳導和頻率調諧方面起著重要的作用。鉛能競爭性阻斷細胞膜上Ca2+攝取和釋放,使細胞膜的極性發生改變,阻止線粒體對Ca2+的攝取,干擾了細胞的能量代謝;鉛中毒時神經元動員Ca2+的能力大幅度提高,導致神經元內Ca2+濃度升高,鈣離子調節能力下降使細胞信號傳導功能下降,從而引起細胞內一系列的生化過程[3]。
已有研究發現染鉛Wistar大鼠的聽性腦干反應波Ⅰ潛伏期延長,聽功能明顯下降,其原因可能是因為鉛誘發組織中脂肪酸構成的變化及增加脂質過氧化物引起的聽神經損害,同時還發現鋅、硒對鉛的毒性有拮抗作用,可保護大鼠由于鉛中毒引起的聽力損害[4]。研究證實機體易感性可能是鉛毒性作用的決定因素,鉛可通過抑制δ-氨基―γ―酮戊酸脫水酶的活性引起血紅蛋白合成障礙和紅細胞游離原卟啉增加,而造成間接的聽神經毒性[5]。
本研究結果顯示,支配耳蝸外毛細胞的傳出神經纖維在耳蝸的分布密度不一致,耳蝸底回到頂回傳出神經支配逐漸減少,越靠內排的毛細胞接收的傳出纖維越多。大劑量鉛中毒時(高鉛組)耳蝸傳出神經纖維受到明顯的損害,隨著染毒時間的延長損害程度呈進行性加重,并且以耳蝸鉤回、第一回受損最明顯,逐漸向頂回發展。小劑量的鉛(低鉛組)對豚鼠內側橄欖耳蝸束未產生明顯損害,這可能與傳出神經的解剖學分布有關,另外,血鉛濃度較低時鉛可通過代謝逐漸排出,避免了鉛持續長時間侵襲神經。耳蝸傳出神經系統和外毛細胞形成突觸,近年來有學者發現,鉛可通過抑制突觸終端的囊泡纖夫蛋白的活性使神經遞質傳遞失平衡,囊泡纖夫蛋白是第一個被分離出來的突觸囊泡整合蛋白,在神經組織和非神經組織中均有表達。鉛可阻礙囊泡纖夫蛋白和突觸前膜列陣蛋白的作用,導致囊泡導向與融合無法完成,因而干擾了耳蝸傳出神經和外毛細胞間的突觸傳遞[6]。
耳聲發射已廣泛用來探討聽覺傳出神經系統與耳蝸微機械活動的關系,利用外毛細胞受橄欖耳蝸系統激活刺激,可以耳聲發射對側抑制幅度作為評估聽覺傳出系統功能指標,故本研究采用對側聲刺激誘發的DPOAE抑制幅度作為橄欖耳蝸傳出系統功能測試的方法。文中結果顯示,對照組和低鉛組均引出DPOAE并出現了不同程度的對側抑制現象,而高鉛組停藥后多數未引出DPOAE,且少數耳的對側抑制幅度明顯低于低鉛組及對照組,這與耳蝸傳出神經受損的形態學相符[7]。楊烽[8]通過大鼠原代培養技術發現鉛能明顯抑制大鼠皮層神經元的存活和突起成長,隨著鉛濃度的升高其抑制作用逐漸增大,存在著明顯的劑量效應關系。本研究結果也證實了血鉛濃度越高,其對耳蝸傳出神經的損傷越重。
鉛對耳蝸橄欖束的影響很可能是造成聽覺系統損害的分子神經毒理學機制之一。由于耳蝸橄欖束和外毛細胞形成突觸,并且鉛中毒時皆可引起損傷,但兩者損害之間是否存在著某種因果關系,其確切發生機制及其損害的關聯性仍有待于深入研究。
4 參考文獻
1 謝鼎華,主編.基礎與應用聽力學[M].長沙:湖南科學技術出版社,2003.152~153.
2 Adhikari N, Sinha N, Narayan R, et al.Lead-induced cell deaths in tests of young rats[J]. J Appl Toxicol,2001, 21:275.
3 Ddevoto P, Flore G, Ibba A, et al. Lead intoxicating during intrauterine life and lactation but not during adulthood reduces nucleus accumbens dopamine release as studied by brain microdialysis[J]. Toxicol Lett, 2001,121:199.
4 高希寶,史麗,玄永慶,等. 鋅硒對鉛致大鼠聽力損傷的影響研究[J]. 微量元素與健康研究,2004,21:6.
5 Kelada SN,Shelton E, Kanfmann RB, et al. Dela-aminolevulinic acid dehydratase genotype and lead-toxicity: a huge review[J]. Am J Epidemiol, 2001, 154: 1.
6 Bouton CM, Frelin LP, Forde CE, et al. Synaptotagmin Ⅰis a molecular target for lead[J]. J Neurochem,2001,76:1 724.
7 Maison S,Micheyl C,Andeol G,et al.Activalion of medial olivocochlear efferent system in humans: influenee of stimulus band width[J].Hear Res,2000,140:111.
8 楊烽,李積勝,楊芳.不同濃度醋酸鉛對大鼠原代培養大腦皮層神經元的影響[J].中華勞動衛生職業病雜志,2004,22:217.

