大花萱草不同外植體初代培養的比較研究
柏文琴,閆桂琴,李瑞艷,于志輝
(山西師范大學生命科學學院,山西 臨汾 041004)
大花萱草為百合科(Liliaceae)萱草屬(HemerocallisL.)多年生宿根草本,又叫多倍體萱草(HemetocallisfulvaVar.florepleno),具短根狀莖和肉質肥厚的紡錘狀塊根.葉基生,條形排成兩列,長度、寬度依品種不同而有差別.花葶粗壯,螺旋狀聚傘花序,著花數十朵,花冠漏斗狀,單朵花僅開1天,但一花開完它花繼放,花期長,花期在5-10月,依品種不同而不同.大花萱草具有較強的抗旱、抗寒、抗鹽堿、抗病蟲害、耐半蔭等特性.大花萱草可叢植于草坪中或于花壇、路旁栽植,是理想的觀花賞葉的地被植物.另外,大花萱草也是優良環保植物,對二氧化硫有較強的抗性[1].
大花萱草結實率低,一般不采用種子繁殖,而是采用分蘗等無性繁殖方式進行增殖.但由于其速度慢,一般一株大花萱草每年僅可繁殖3~4株,個別品種每年繁殖1~2株,因而難以適應市場商品化生產的需求.利用植物組織培養技術是解決大花萱草大量繁殖的最有效途徑.此外,組織培養技術也為大花萱草的品種選育提供了技術基礎.而初代培養是組織培養技術中的首要環節,前人對于大花萱草組織培養雖有研究[2-7],但在初代培養這一環節缺乏系統的研究,而且不同品種、不同外植體得出的結論差異很大.本試驗選用大花萱草新品種“baltimore oriole”的7種不同外植體進行誘導的比較研究,以期篩選出較適宜的外植體材料與激素濃度及配比,為大花萱草快速繁殖提供依據.
1 材料與方法
1.1材料美國進口的大花萱草新品種“baltimore oriole”.
1.2 研究方法
1.2.1 外植體選擇及處理 選取生長健康、無病蟲害的大花萱草新品種“baltimore oriole”的葉片、根段、莖尖、花莖、花托、花瓣和子房7種外植體,用洗潔精清洗干凈后,用流水沖洗,75%乙醇處理30 s,0.1% HgCl2處理10 min(根和莖尖處理時間相應延長),蒸餾水沖洗7~8次.滅菌處理后,葉片和花瓣,切成1 cm×1 cm大小;根和幼嫩花莖取0.5 cm長;花托切成0.5 cm×0.5 cm大小;莖尖切成0.5 cm×0.5 cm×0.5 cm大小;子房一切為二.將處理好的外植體分別接入表1培養基中培養.
1.2.2 初代培養的培養基 根據Heuser的報道[8],選用MS培養基作為基本培養基[9],同時參閱前人有關萱草及其同屬、同科植物的愈傷組織的培養基配方[2-7],以及預試驗的基礎上,設計了5種激素組合進行試驗(見表1),每種培養基中均含有3%蔗糖,瓊脂0.6%,pH調至5.8~6.0.
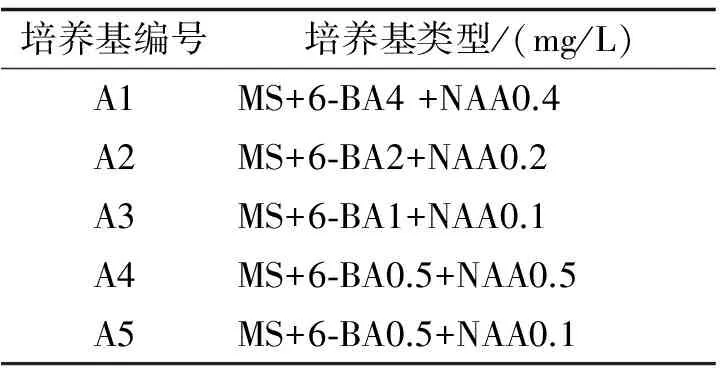
表1 愈傷組織誘導培養基
1.2.3 繼代培養基 將莖尖誘導的叢生芽、花托、花莖和子房誘導的愈傷組織切成小塊接種到各自初代培養的最佳培養基中進行培養,以考察初代培養物繼續生長狀況.
1.2.4 培養條件 25 ℃恒溫培養,每天光照12 h,光照強度為2 000~2 500 lx.
2 結果與分析
2.1 不同外植體初代培養結果及分析
2.1.1 葉片、花瓣和根段初代誘導結果 葉片和花瓣在5種培養基上的生長情況相似,僅有面積的擴大,而無愈傷組織產生,30 d后,均干枯死亡.根段經過一段時間培養同樣干枯死亡.說明葉片、花瓣和根段不適宜作為大花萱草初代培養的外植體.
2.1.2 莖尖初代誘導結果 莖尖經過30 d的培養,在5種培養基中均出現兩種情況:一種是莖尖直接長出獨苗,苗子濃綠,粗壯(見圖1);另一種是一個莖尖長出2個甚至多個叢生芽,顏色略黃,較弱(見圖2).兩種情況都很少產生愈傷組織.不同的激素組合對莖尖產生的叢生芽數有很大的影響(見表2).
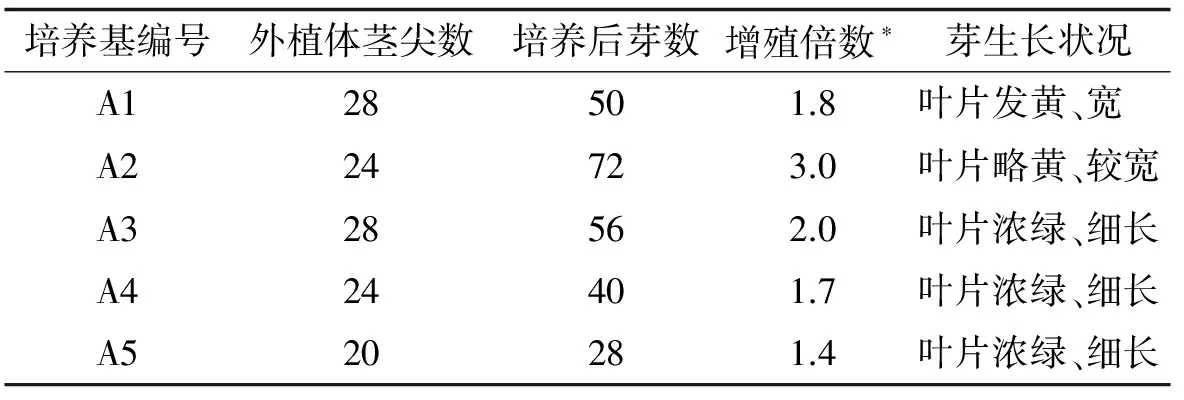
表2 莖尖在不同培養基中芽增殖結果
*增殖倍數=培養后芽數/外植體莖尖數
其中在A2培養基中芽增值倍數最高,為3.0,而在A5培養基中芽增殖倍數最低,僅1.4.說明莖尖是較適宜的初代培養外植體,合適的細胞分裂素和生長素濃度(6-BA濃度為2 mg/L,NAA濃度為0.2 mg/L)及比例(10/1)有利于誘導莖尖產生叢生芽.
2.1.3 花莖的愈傷組織誘導 花莖培養2周左右,與培養基接觸部位開始膨大,4周左右長出大量愈傷組織(見圖3),并有少量芽點,5周左右愈傷組織分化出大量芽(見圖4).花莖在5種培養基中均能誘導形成質地緊密、淡黃綠色的愈傷組織.但不同的激素組合對愈傷組織的誘導率有很大的影響.在A1、A2、A3、A4和A5中愈傷組織的誘導率分別為29.4%、66.7%、23.5%、17.8%和86.7%,在A5培養基中誘導率最高,而在A4培養基中愈傷組織的誘導率最低.說明花莖是初代培養較適宜的外植體,合適的細胞分裂素和生長素濃度(6-BA濃度為0.5 mg/L,NAA濃度為0.1 mg/L)及比例(5/1)有利于誘導花莖產生愈傷組織.

圖1 莖尖萌發獨苗

圖2 莖尖長出叢生芽
2.1.4 子房和花托的愈傷組織誘導 子房和花托在5種培養基中1周左右開始膨大,但是很難形成愈傷組織,子房只在A3和A4培養基中有愈傷產生(見圖5),誘導率分別為40%和20%.花托只在A3培養基中有愈傷產生,誘導率為29.4%,愈傷組織水浸狀、且質地疏松(見圖6),其余培養基中只有膨大而無愈傷組織,隨著培養時間的延長,膨大的子房和花托逐漸干枯死亡.因此,雖然子房和花托外植體可以誘導產生愈傷組織,但是從誘導率和愈傷組織形態分析可知,子房和花托不適宜作為大花萱草初代培養的外植體.

圖3 花莖上誘導產生大量愈傷

圖4 愈傷組織上分化出芽
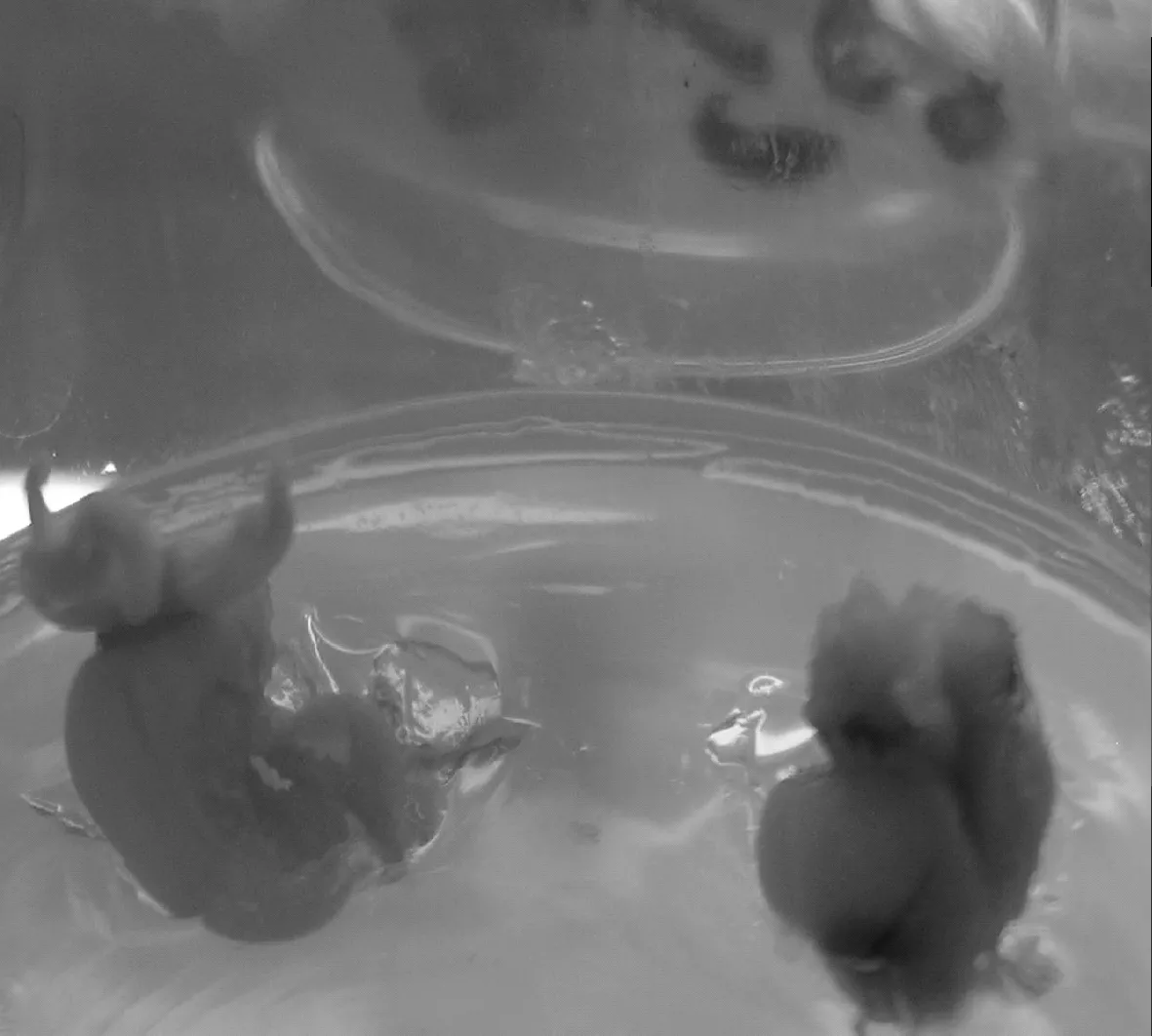
圖5 子房誘導產生愈傷組織

圖6 花托誘導產生愈傷組織
2.2愈傷組織及芽的繼代培養將花莖、子房和花托誘導產生的愈傷組織切成合適大小接種到繼代培養基中,子房和花托產生的愈傷組織在培養過程中逐漸死亡,而花莖誘導的愈傷組織接種到繼代培養基后,愈傷組織不斷增加,上面的芽點逐漸長成一株株小苗,且不斷分化產生新的不定芽,每塊愈傷組織上約有4~5個芽(見圖7).莖尖誘導的芽在繼代培養基中不產生愈傷組織,只繼續產生叢生芽(見圖8),但是芽的增殖倍數不高,每個周期約3倍左右.從繼代培養結果可以進一步證實莖尖和花莖是大花萱草初代培養的較適宜的外植體.

圖7 愈傷組織誘導出芽

圖8 芽誘導產生叢生芽
3 討論
植物愈傷組織的誘導主要受外植體本身、培養基和培養環境三大因素的調控.不同植物的器官和組織,其形態發生能力大不相同,即使同種植物不同外植體,所需要的營養和外源激素的濃度及比例也不相同,原因可能是由于它們的生理狀態和所處的生育時期不同,其內源激素濃度和比例不同[10].因此在初代培養中選擇合適的外植體和適宜的激素濃度及比例是非常重要的.
莖尖是植物頂端的原生分生組織和它衍生的分生組織,具有非常旺盛的細胞分裂能力和很強的生命力.大花萱草新品種“baltimore oriole”的莖尖,在含2 mg/L 6-BA 和0.2 mg/L NAA的MS中,會形成叢生芽,增殖倍數達3.將叢生芽切割成幾份新的外植體,接入相同培養基中進行增殖培養.這種繁殖方式產生的芽遺傳性狀穩定,是大花萱草快速繁殖的一種有效途徑[11].缺點是莖尖的剝離困難,而且損壞花苗,且由于與土壤接觸,葉片層層包裹,不易徹底滅菌,因而初代培養中污染率很高.因此,當繁殖優良性狀的品種且有一定數量的種質資源時,可選擇莖尖為外植體.
植物葉片、子房、花藥、胚珠、葉柄等成熟組織經過恢復分生能力,誘導出愈傷組織,再從愈傷組織誘導不定芽.這種分化類型可能會發生變異,用于良種繁殖時應注意[8].本實驗選用葉片、根段、花莖、花托、花瓣和子房這幾種成熟組織進行愈傷組織的誘導,結果表明不同成熟外植體誘導愈傷組織的能力不同,葉片、根段和花瓣,在5種培養基中難以誘導出愈傷組織,隨著培養時間延長,逐漸干枯死亡.花托和子房雖有一定數量的愈傷組織,但是誘導率很低,且在隨后的繼代培養中逐漸干枯死亡.花莖在0.5 mg/L 6-BA 和0.1 mg/L NAA的MS中,愈傷組織的誘導率最高,達到86.7%,而且繼代培養中愈傷組織全部能分化產生不定芽,每塊愈傷組織上平均有4~5個芽.因此,可以選用花莖作為大花萱草“baltimore oriole”繁殖的外植體,但是存在缺點:一是取材時間受限制,只能選擇每年的花期,而且要求花莖處于幼嫩階段;二是經過愈傷組織階段,有變異的可能性.
因此,大花萱草“baltimore oriole”初代培養時,可根據實際情況,選擇花莖或莖尖作為外植體.不同外植體所需激素濃度和配比不同,花莖作為外植體較適宜的激素濃度是0.5 mg/L 6-BA 和0.1 mg/L NAA,莖尖作為外植體較適宜的激素濃度是2 mg/L 6-BA 和0.2 mg/L NAA.
[1] 儲博彥,趙玉芬,牛三義,等.大花萱草品種介紹及栽培管理技術[J].河北林業科技,2006,10(5):60-61.
[2] 王曉娟,金樑,陳家寬.大花萱草不同外植體誘導愈傷組織的比較研究[J].生命科學研究,2005,9(3): 242-246.
[3] 解有利,陳蘭芬,石進朝.大花萱草組織培養研究[J].北京農業職業學院學報,2007,21(5):25-27.
[4] 周南镚,黃一青,范林浩,等.大花萱草的組織培養與植株再生[J].安徽農學通報,2006,12(6):157.
[5] 趙玉芬,儲博彥,尹新彥,等.大花萱草工廠化快繁技術研究[J].園藝學報,2011,(2):152-155.
[6] 李艷梅,王桂蘭,陳超,等.大花萱草新品種“紅運”快繁體系的建立[J].河南農業科學,2006,(8):120-122.
[7] 劉志洋,李海濤,朱祥春,等.大花萱草組織培養研究[J].東北農業大學學報,2008,39(1): 43-45.
[8] Heuser C W,Apps D A. In vitro plantlet formation from flower petal explants ofHemerocalliscv. “Chipper Cherry”[J].Can J Bot,1976,54:616-618.
[9] Murashige T,Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture[J].Physiol Plant,1962,15:473-497.
[10] 周維燕.植物細胞工程原理與技術[M].北京:中國農業大學出版社,2001: 76-77.
[11] 熊麗,吳麗芳.觀賞花卉的組織培養與大規模生產[M].北京:化學工業出版社,2002:12-31.

