廣東省清遠市2008~2010年各年第一季度藥品不良反應報告分析
楊廉平,練美容,黃惠明
[1.華中科技大學同濟醫學院醫藥衛生管理學院,武漢 430030;2.廣東省韶關市第一人民醫院(廣東醫學院附屬韶關醫院)急診科,512000;3.廣東省清遠市食品藥品監督管理局藥品不良反應工作站,511500]
2007年8月28日 ,廣東、廣西、海南及重慶等十省、自治區、直轄市藥品不良反應(ADR)監測中心簽定了《泛珠三角區域藥品不良反應監測系統建設合作協議》,確定共建區域ADR監測信息管理平臺。近年來,患者因ADR而致住院、手術以及生產力損失等的相關費用,甚至超出了藥物治療本身的費用。據統計,我國每年因ADR而住院治療的患者超過500萬例次,約19.2萬例死于 ADR[1]。另一方面,至少60%的ADR是可預防的[2]。筆者對廣東省清遠市2008~2010年每年第一季度ADR報告進行回顧性比較分析,以期更好地開展ADR監測工作,促進合理用藥。
1 資料與方法
通過泛珠三角區域ADR管理平臺收集2008~2010各年清遠市上報且經廣東省不良反應監測中心評價的ADR報告,確定每年前3個月(第一季度)為研究時間段,避開其他干擾因素的影響,其中2008年第一季度108例(非中成藥94例,中成藥14例);2009年第一季度277例(非中成藥244例,中成藥33例);2010年第一季度306例(非中成藥266例,中成藥40例)。采用回顧性和描述性研究方法,進行歷史同期對比研究,運用Excel表以原始表格內容為基礎,對電子報告表中有關數據格式進行適當轉換或增加統計項。
2 結果
2.1 各年第一季度收集的ADR數量 見表1。2009年第一季度同比增長156.48%;2010年第一季度同比增長10.47%;3 a平均同期增長率35.40%。特別是2008年報告的嚴重ADR例數是0。
2.2 報告表來源統計 2008年第一季度107例ADR報告來自醫療衛生機構,占99.07%;1例來自監測機構,占0.93%。2009年第一季度、2010年第一季度ADR報告百分之百來自醫療衛生機構。綜合3 a第一季度的情況來看,生產、經營企業、個人的報告數都為0。
2.3 報告人職業分布情況 見表2。
2.4 不同給藥途徑發生的ADR統計 見表3。
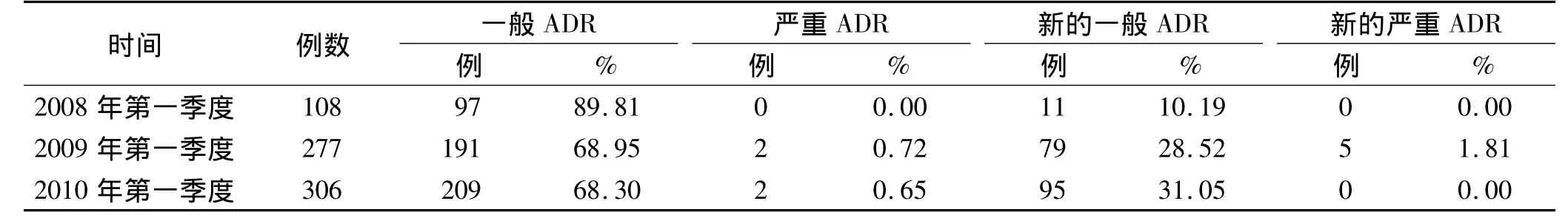
表1 不同時段ADR報告數量

表2 ADR報告人職業分布情況統計
2.5 引起ADR最多的藥品種類統計 見表4。
2.6 各種藥理作用的非中成藥統計 由于中成藥的藥理作用機制難以區分清楚,在此不予分析,各種藥理作用的非中成藥分析見表5。
3 分析
3.1 報告數量增長明顯,ADR分級粗略 清遠市不良反應工作站在信息管理平臺建立后,報告數量以同期35.40%平均速率增長,增長明顯,目前已處于廣東省各市前列。2009年全市平均年百萬人報告數量502份,超過了WHO關于成熟藥品安全檢測體系每百萬人口報告數200~400份的標準。
現行網上ADR呈報系統引用國家食品藥品監督管理局的分級方法,將ADR分為新的或舊的,每類再分為嚴重的或一般的ADR。雖然目前的分級法具有很好的臨床操作性,突出了嚴重的ADR,但是所分的新、舊程度與ADR對患者的危害性并無直接關聯,其嚴重程度僅分2級,過于粗略,不易區分各類ADR的危害程度。導致多數ADR分析研究仍僅以ADR發生頻率與其誘發因素之間的相關性分析為主,很難涉及其嚴重程度和用藥頻率的影響。
3.2 報告表來源始終以醫療衛生機構為主 2008~2010各年第一季度醫療衛生機構的ADR報告幾乎都占據了報告總數的百分之百,除了2008年第一季度有1例ADR來自于監測機構外,其他生產企業、經營企業、個人等非醫療衛生機構的報告數為0例。我國《藥品不良反應報告和監測管理辦法》第13條明確規定:藥品生產、經營企業和醫療衛生機構必須指定專(兼)職人員負責本單位生產、經營、使用藥品的ADR報告和監測工作,發現可能與用藥有關的不良反應應詳細記錄、調查、分析、評價、處理。生產、經營企業未能正確認識ADR監測的重要意義,片面追求短期經濟利益而忽視上市后ADR監測。
3.3 報告人職業分布始終以醫生為主 醫生分別占到了各年第一季度報告數的85.19%,79.42%,85.29%,護士、藥師加起來不到20%。護士和患者密切接觸,直接從事給藥和護理操作的人員,在發現和處理ADR的關鍵環節上起著重要作用。國外報道,護士報告的質量和醫生相似[3]。另外,臨床藥師在藥物的篩查、排除過程中具有藥理學方面的優勢,可避免藥物“再激發試驗”可能帶來的危險,故也要發揮其在監測體系中的作用。
3.4 給藥途徑與ADR 無論是非中成藥,還是中成藥引發ADR的給藥途徑都以靜脈給藥(包括靜脈滴注、靜脈注射)常見。注射劑型的藥物經注射直接進入人體血液系統,繞過肝臟首關效應,極可能導致過敏遞質釋放或補體系統激活等,引起假變態反應。尤其對于應用中藥注射劑型的患者,即使無過敏史,也不能放松警惕,以防假性變態反應引起的過敏性休克。
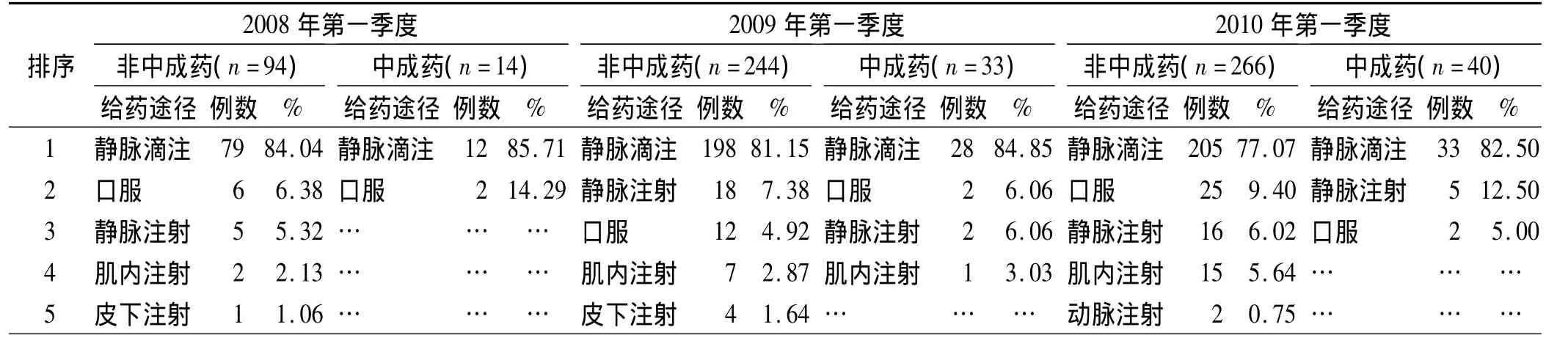
表3 ADR給藥途徑統計(前5位)
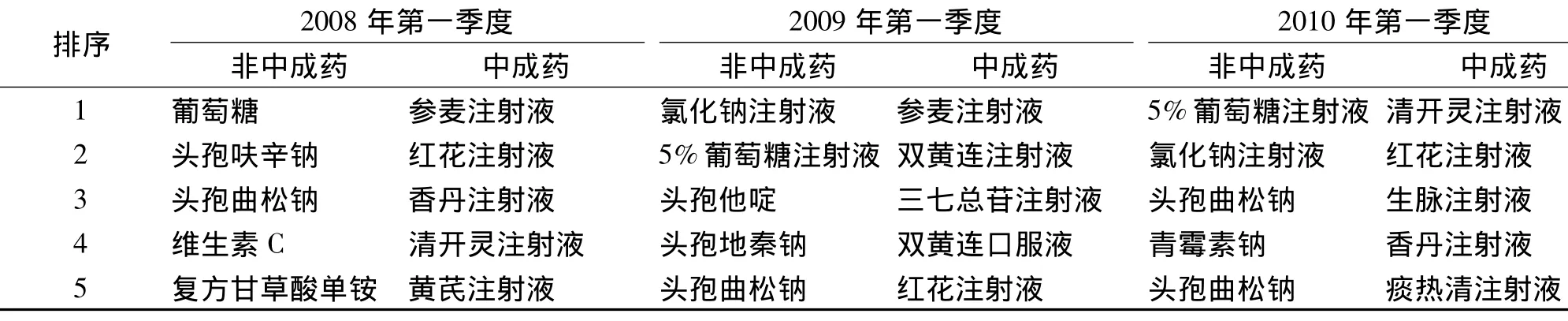
表4 引起ADR最多的藥品種類統計(前5位)
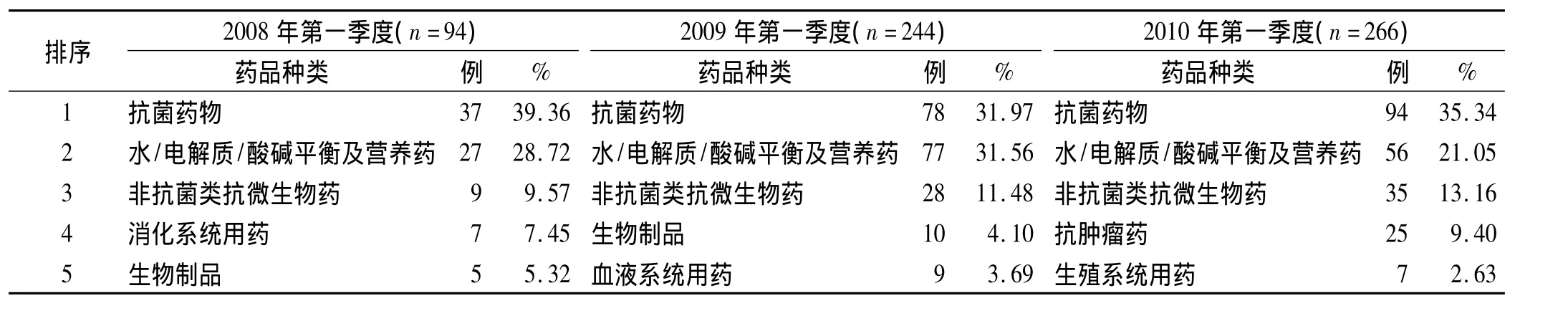
表5 各種藥理作用非中成藥所致ADR統計(前5位)
3.5 抗感染藥物ADR 清遠市2008年、2010年抗感染藥物(包括抗菌藥物、非抗菌類抗微生物藥物)ADR發生率都高于其他地區的46.45%[4],其中喹諾酮類、青霉素類、頭孢菌素類抗菌藥物ADR頻發。因抗感染藥物的使用覆蓋醫院各個科室,且在用藥中存在較多的如預防用藥多、用藥劑量大、療程長等不合理現象,由此導致的ADR也多。
3.6 中成藥注射劑ADR 中成藥注射劑所致ADR問題日益突出,位于前10位的中成藥制劑所致ADR中有八九種都是注射劑型,尤以清開靈注射液、雙黃連注射液、香丹注射液和參麥注射液嚴重。中成藥注射劑致ADR原因主要有以下幾方面:多為復方制劑,成分復雜,動植物蛋白、鞣質等物質極易引起ADR;制劑中的添加劑、增溶劑、穩定劑等與中藥在進行化學合成中產生的雜質能成為過敏原物質;現實生產工藝的局限難以掌控藥品的純度和雜質含量;中藥注射液與輸液配伍后導致不溶性微粒增加。另外,抗感染抗病毒、改善微循環(活血化瘀)、抗腫瘤/增強免疫力這3類中藥注射劑,根據簡單的藥理作用說明使用很容易擴大適應證,缺乏更具體的藥理作用依據,造成這些藥成為治療疾病的通用藥,無疑也會增加ADR的發生風險。
4 建議
4.1 對ADR嚴重程度“一般的”進一步分級 為達到促進合理用藥的目標,從臨床用藥的安全性來考慮,ADR嚴重程度的影響更為顯著。基于現行的分級標準基礎之上,針對“一般的”程度分級,可參考美國用藥失誤分級、疾病嚴重程度分級評分等,重新來制定分級更為明確、可量化且操作性較強的ADR嚴重程度分級標準,并引入ADR嚴重度指數(severity index of ADR,SIADR)的概念[5]。用平均分值定義 SIADR=∑S/N[S為某(類)藥品所致ADR個案的嚴重程度評分值,N為所研究藥品ADR的例數]。
4.2 督促生產、經營企業實現多元化報告 通過對企業不斷加強ADR方面知識的教育、擴大相關國家法律法規的宣傳來提高其上報意識,令其正確認識到監測報告是回顧自己產品信息的一種途徑,是作為風險管理的一個信號指示器。針對有企業沒有上報定期匯總報告的問題,可借鑒北京ADR監測中心采取的定期匯總報告與產品換發藥品批準文號相結合的做法。
4.3 發揮護士、藥師在監測報告環節的作用 把護士長作為網絡終端責任人,使護士在ADR監測中的作用得到發揮,將現流程改為護士在匯報醫生的同時要匯報護士長,護士長負責督促醫生、護士共同進行跟蹤監測,完成報告填寫[6]。隨著臨床藥學工作的開展,增加臨床藥師的人員配備和藥師在臨床的工作時間,明確ADR監測作為藥師在臨床實踐中的重要工作;其次藥學人員與臨床醫生還應該在多項ADR監測基礎上開展科研協作,以期更快、更準甄別ADR。
4.4 抗感染藥物、中藥注射劑明確為重點監測對象抗感染藥物和中藥注射劑是ADR高發領域,應加強對這類藥物的監測和干預工作,充分考慮ADR的潛在危險,運用循證藥學主動干預ADR的發生發展[7]。積極推進計算機系統在ADR監測方面的應用,在科學分類和數學模型的基礎上,開發針對抗感染藥物、中藥注射劑不良反應監測工作的預警系統。另外,藥品監管部門加強與衛生行政部門的協作,加大對醫生處方的審查、規范;開展ADR監測工作的定期檢查和評估,及時反饋信息促進臨床合理用藥和安全用藥。
[1] 趙彬,李曉靜,陶靖環.淺談藥品不良反應監測工作的體會[J].中國民族醫藥雜志,2004,4(2):43.
[2] 世界衛生組織.藥物:藥物安全和藥品不良反應[EB/OL].http://www.who.int/mediacentre/factsheets/fs293/zh/.
[3] MORRISON G S.The report of medicine side-efects written by nurses[J].Lancet,2003,361(10):1347-1348.
[4] 王蔓琳,徐玉紅,李成,等.2006年抗菌藥品不良反應報告分析[J].中國藥物警戒,2007,16(4):232-236.
[5] 李利軍,胡晉紅,王卓,等.藥品不良反應嚴重程度分級評分標準的制定及藥品不良反應嚴重度指數的應用[J].藥學服務與研究,2008,8(1):9-13.
[6] 盛芝仁,黃善定,楊青雅,等.護士在藥品不良反應監測中的作用[J].中華護理雜志,2009,44(4):308-310.
[7] 胡忠杰,苗佩宏.循證藥學與合理使用抗菌藥物[J].醫藥導報,2008,27(6):721-723.

