基于分子生物學的大慶油田聚驅后內源微生物資源評價
柏璐璐
( 大慶油田有限責任公司 勘探開發研究院,黑龍江 大慶 163712 )
0 引言
近年來,基因組學和現代分子技術的成熟逐漸滲透到有關生命科學的整個領域,也為微生物生態學提供了新的研究方法和機遇.自1985年Pace等以核酸測序技術研究微生物的生態和進化以來,對微生物的多樣性研究進入一個新階段,并逐步發展形成成型的分子微生物生態學(Molecular Ecological Technology of Microorganisms)方法和技術[1].目前,微生物分子生態學研究的焦點主要集中在具有保守序列的16S rRNA上,研究方法包括16S rRNA序列分析、核酸探針雜交法等.
由于石油資源短缺和勘探費用的不斷增加,以及注水采油后幾乎有60%~70%的原油留在油藏中,使得三次采油方法日益受到廣泛重視.其中,微生物提高原油采收率技術(Microbial Enhanced Oil Recovery, MEOR)是最有希望的方法之一,通過激活油藏中的微生物提高采收率的技術得到重視和開發.大港油田與俄羅斯合作,從2001~2006年共開展8個區塊的礦場實驗,取得明顯增油降水效果[2].從所用的微生物區分,MEOR技術主要包括激活油層內源微生物群落和注入地下起作用的外源微生物2種方法.較外源微生物采油技術相比,內源微生物采油技術省去菌種開發與評價、菌液發酵等繁瑣過程,具有適應性廣、成本低的優勢,是一項潛力巨大的微生物提高采收率技術.在闡述分子生態學技術的基礎上,筆者評價大慶油田聚驅后區塊內源微生物資源.
1 技術背景
1.1 16S rRNA序列分析
16S rRNA序列測定與分析方法對不同細菌的16S rRNA序列進行同源性比較分析,是推斷細菌的系統發育及進化關系的重要方法.它是從微生物樣本中的16S rRNA的基因片段,通過克隆、測序或酶切、探針雜交獲得16S rRNA序列信息;再與16S rRNA數據庫中的序列數據或其他數據進行比較,從序列差異計算它們之間的進化距離,確定其在進化樹中位置,從而鑒定樣本中可能存在的微生物種類.Gerrit V等[3]通過16S rRNA基因擴增克隆測序研究加拿大北部油田微生物群落的多樣性,檢測到多種革蘭氏陰性的SRB和許多有限數量的厭氧菌、發酵菌或產醋酸菌.Yah T等[4]研究日本新瀉縣Kubiki 油藏內的超嗜熱菌(hyperthermophiles)及其生化性質,通過16S rRNA序列分析,發現其中的超嗜熱菌主要是熱球菌屬(Thermococcus)和棲熱袍菌(Thermotoga),超嗜熱的球菌和桿菌能通過增強自身的抗饑餓能力和抗變溫能力在地下油藏內生活,說明它們在地下有很大分布.
1.2 核酸探針雜交技術
核酸分子雜交技術是20 世紀70 年代發展起來的一種分子生物學技術.核酸雜交技術快速、靈敏地探測環境微生物中特殊的核酸序列,并且用光密度測定法可以直接比較核酸雜交所得到的陽性條帶或斑點得出定量的結果,從而反映相關微生物的存在及功能.探針可以是長探針,也可以是短的寡核苷酸;雜交方式可以是全細胞雜交(whole-cell hybridization) 、數量印跡雜交(quantitative dot blot)、原位雜交(in situ hybridization) 及生物芯片(biochip) .
1.2.1 數量印跡雜交
從環境樣品中提取的DNA作數量印跡雜交,可獲得有關特定DNA序列豐度的信息.它是基于專一性探針(如特定16S rRNA基因探針)、通用型探針(如總16S rRNA基因探針)和環境樣品中分離的總DNA分別進行雜交,其特定DNA(如16S rRNA 基因序列)的相對豐度用此2類探針雜交信號的比值加以確定,用以間接反映特定的微生物細胞的數量或特定種群的相對生理活性等.Sharon A C等[5]研究被原油污染的土壤中的多環芳烴(PHA)降解菌,使用編碼萘—加雙氧酶的nahA基因作為探針,評估萘—加雙氧酶和分枝桿菌屬菌株CH1中PHA 降解酶的相似度.
1.2.2 原位雜交
熒光原位雜交(Fluorescence in situ hybridization,FISH)是目前原位雜交技術中較為常用的方法.它是根據已公布的、定位在不同分類等級的rDNA分子的特征位置,設計以rDNA為靶點的寡核苷酸探針;然后用熒光標記探針,用于原位鑒定單個細胞.該技術可以同時對不同類群的細菌在細胞水平上進行原位的定性、定量分析和空間位置標示.Kazuya W等[6]采用FISH研究地下儲油罐中排出的地下污水,認為FISH容易低估生長緩慢且rRNA水平較低的細菌的豐度,需要配合其他方法進行研究.Yumiko K等[7]利用古生球菌屬的特異性探針對被原油污染的地下水微生物群落進行FISH,對其中的古生球菌的多樣性、豐度及活性進行研究.
1.2.3 生物芯片
核酸印跡雜交技術的集成化正在使分子生物學技術發生一場革命,即生物芯片(biochip)技術,又稱基因芯片或DNA 陣列(DNA array),它是成千上萬的網格狀密集排列的基因探針.通過已知堿基順序的DNA片段,結合被標記的具有堿基互補序列的DNA或RNA,確定其相應的類別,并由此推斷環境樣品中微生物的類群.盡管目前針對16S rRNA的基因芯片還處在基礎研究階段,但隨著16S rRNADNA技術的廣泛應用,這類產品的市場化是必然趨勢.Elizaveta A B等[8]對俄羅斯西伯利亞地區Samotlor油田高溫油藏內的嗜熱性微生物群落進行寡核苷酸微芯片(microchip)分析,并針對嗜熱菌和古生球菌設計探針.
1.3 聚合酶鏈式反應法(PCR)
目前依靠在PCR試驗中使用具有類群特異性的引物,不進行酶切、變性、克隆和電泳等后續手段,也能夠鑒別特定微生物類群的存在.競爭性PCR(competitive PCR)是其中較為常用的方法,在同一反應條件下,同一試管內同步擴增一段靶序列和另一段內參序列,作為競爭模板的內參序列與靶序列使用相同的引物,并以相同效率擴增.擴增后,當二者的質量分數相同時,理論上其模板質量分數也應相同.將待測標本與10倍系列稀釋的競爭模板混合,擴增后分別用各自的熒光探針雜交,當混合標本中目的基因和內參序列信號值相同時,待測標本質量分數即為該混合物中競爭模板的稀釋質量分數.Kazuya W等[9]使用8對通用古生菌引物對地下儲油罐中排出的地下污水中的古菌進行16S rRNA序列分析,將其分為5個基因型,分別是KuA1、KuA6、KuA12、KuA16和KuA22,通過競爭性PCR的研究,在所有古菌拷貝中KuA12質量分數最豐富,達到50%.
1.4 PCR基因指紋圖譜技術
環境樣品中的微生物DNA提取物必然是不同微生物的DNA 混合物,被稱為宏基因組(metagenom).將宏基因組經PCR擴增,其產物是序列等長但不同源DNA片段的混合物.混合物中序列的多樣性和不同序列的豐度在一定程度上反映原始樣品中微生物種群的多樣性和不同物種的豐度.如果將這些序列等長但不同源DNA片段分離開,則可對樣品中微生物群落的組成進行初步分析.現在已有多種DNA指紋技術,如變性梯度凝膠電泳(Denaturing Gradient Gel Electrophoresis,DGGE)、溫度梯度凝膠電泳(Temperature Gradient Gel Electrophoresis,TGGE)、限制性片段長度多態性分析(Restriction Fragment Length Polymorphism,RFLP)和末端限制性片段長度多態性分析(Terminal RostrictionFragment Length Polymorphism,T-RFLP).其中DGGE、TGGE和RFLP在石油微生物研究中使用較為廣泛.
1.4.1 變性梯度凝膠電泳(DGGE)
DGGE技術檢測核酸序列是通過不同序列的DNA片段在各自相應的變性劑濃度下變性,發生空間構型的變化,導致電泳速度的急劇下降,最后在其相應的變性劑梯度位置停滯,經過染色后可以在凝膠上呈現為分散的條帶.它的分辨精度比瓊脂糖電泳和聚丙烯酰胺凝膠電泳更高,可以檢測到1個核苷酸水平的差異.Roling等對被石油污染的海岸進行模擬研究,分析營養物質的投放及投放方式對微生物群落降解石油的影響.他們利用DGGE對微生物群落結構的變化進行表征,與沒有營養物質的投放相比,固體營養物質的投放能夠使石油降解速度加快,使微生物群落結構的變化加快,而液體營養物質的效果更加明顯,并發現營養物質的投放使具有相同結構的微生物種群產生不同的降解速率,使具有不同結構的微生物種群產生相同的降解速率.
1.4.2 溫度梯度凝膠電泳(TGGE)
TGGE 技術的基本原理與DGGE 技術相似,含有高濃度甲醛和尿素的凝膠溫度梯度呈線性增加,這種溫度梯度凝膠可以有效分離PCR產物及目的片段.TGGE與DGGE相比,梯度形成更加便捷,重現性更強.Pu-Yi Cheung等研究石油污染土壤微生物降解多環芳烴(PAH),使用分枝桿菌(Mycobacterium)的特異性引物對環境樣品進行擴增,對產物進行TGGE分離,TGGE圖譜顯示,重度污染土壤中微生物群落的多樣性低于輕度污染土壤中微生物群落的.
1.4.3 限制性片段長度多態性分析(RFLP)
PCR-RFLP法是將PCR引物中的1條加以熒光標記,反應后用合適的限制酶切、電泳分析;再根據片斷的大小以及標記片斷種類和數量,分析群落的結構及組成多樣性或檢測因環境改變引起的微生物群落的變化.因此,人們利用PCR-RFLP研究環境微生物的多樣性.Orphan等研究美國加利福尼亞州高溫富硫油藏內的嗜熱微生物群落,分別用細菌通用引物和古生菌引物對環境DNA 樣品進行PCR擴增,建立細菌克隆文庫和古生菌克隆文庫;然后利用RFLP對克隆文庫分別進行分析,發現硫降解菌、產甲烷菌在油藏內部具有廣泛的分布,并且對C、H、S的地球生物化學循環有重要作用[1].
1.4.4 末端限制性片段長度多態性(T-RFLP)
T-RFLP又被稱為16S rRNA基因的末端限制性片段(Terminal Restriction Fragment,TRF)分析技術,是一種新出現的研究微生物多態性的分子生物學技術.相對于其他的分子生物學手段,T-RFLP技術具有3個明顯的優勢:(1)序列數據庫具有直接參考意義,即從消化產物中獲得所有的末端片段大小,可以與序列數據庫中的末端片段對比,可以作系統發育的推斷.(2)核酸測序技術要比DGGE所依賴的電泳系統獲得的結果更為可靠.(3)T-RFLP 的毛細管凝膠電泳分析更為快速,而且結果是以數據的形式輸出.這是一種理想的群落對比分析方法,越來越受到人們的重視.Wen Tso Liu等利用T-RFLP法分析活性污泥、生物反應器內污泥、含沙水層中微生物種群的多樣性,是最早利用T-RFLP技術進行微生物群落對比分析的研究之一.因此,可以考慮將這種分子生物學技術應用到對石油微生物群落結構的檢測中,建立環境中各優勢菌群的峰值圖譜,在短時間內確定石油微生物種群的豐度及均勻度等各特征值,為快速檢測石油微生態系統的變化提供可靠的檢測標準.
2 群落組成
分別從大慶油田第一至第十采油廠的采出井、注水反排井采樣126個.利用微生物的培養和計數方法,檢測不同采油廠樣品中含有硫酸鹽還原菌、石油烴降解菌、腐生菌、鐵細菌、發酵菌、硫細菌、產乙酸菌、產甲烷菌、反硝化菌等.大慶油田第一采油廠典型油井樣品中各種微生物檢測結果見表1.由于油井采出液直接來自于油藏油井周圍的地層,而注水井反排水來自注水井周圍的油藏地層,所以這些樣品中的微生物反映油藏地層水中微生物群落組成,也在一定程度上反映油藏中“本源”微生物組成,所以在大慶油田油藏中各種微生物普遍存在,表現很高的多樣性.
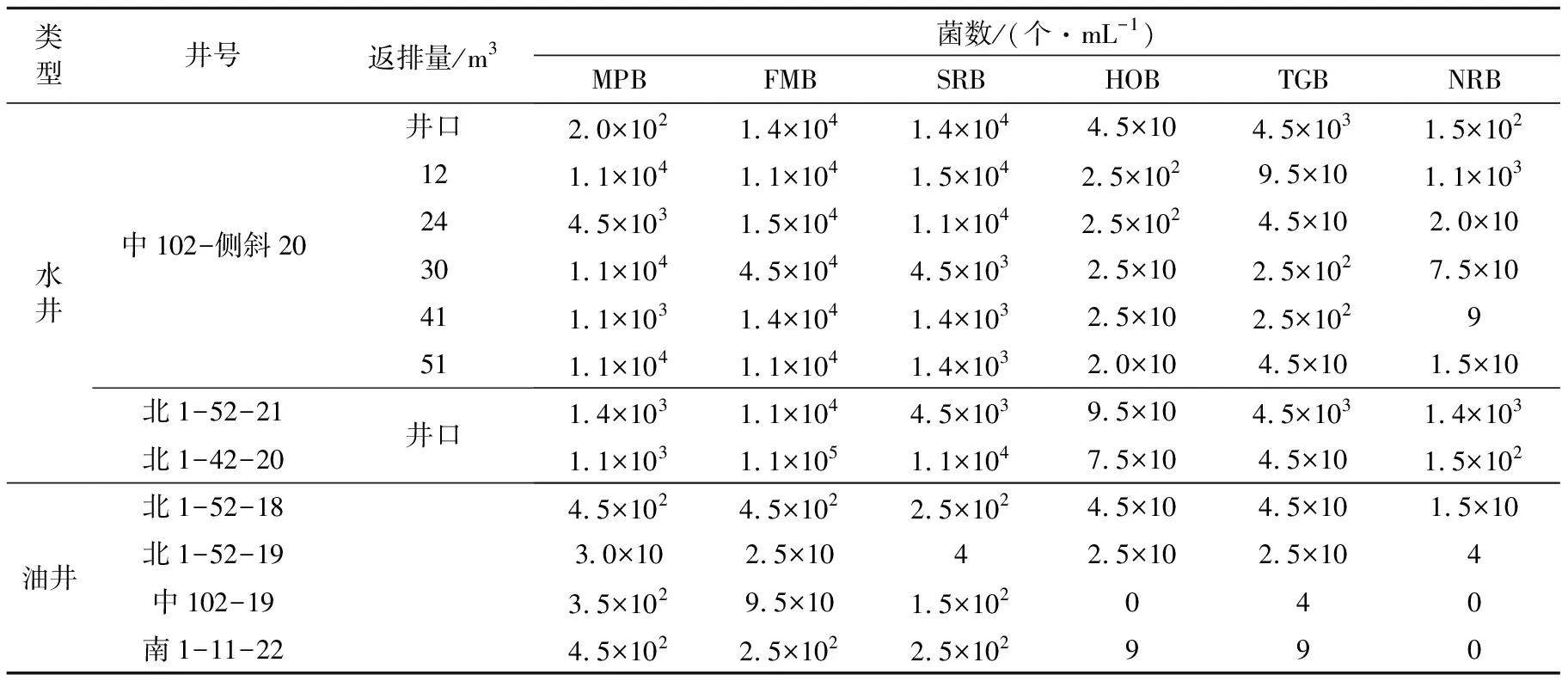
表1 大慶油田第一采油廠油井產出水內源微生物計數結果
通過對各采油廠的水驅和聚驅油層的內源微生物資源調查研究,注入水的返排水中內源微生物種類也明顯多于采出水.注水井與油井的地層水中存在大量的內源微生物.注水井中存在大量的烴氧化菌、發酵菌和硫酸鹽還原菌.在油井地層水中,好氧微生物數量較注水井厭氧微生物比例高,其中甲烷菌是主要的厭氧菌.好氧微生物與厭氧微生物的分布情況與本原微生物采油機理吻合.
3 水驅和聚合物驅
3.1 微生物分布狀態
大慶油田主要采用水驅和聚合物驅油2種技術進行石油開采,所以水驅后和聚驅后油藏是大慶油田分布廣泛的重要油藏.
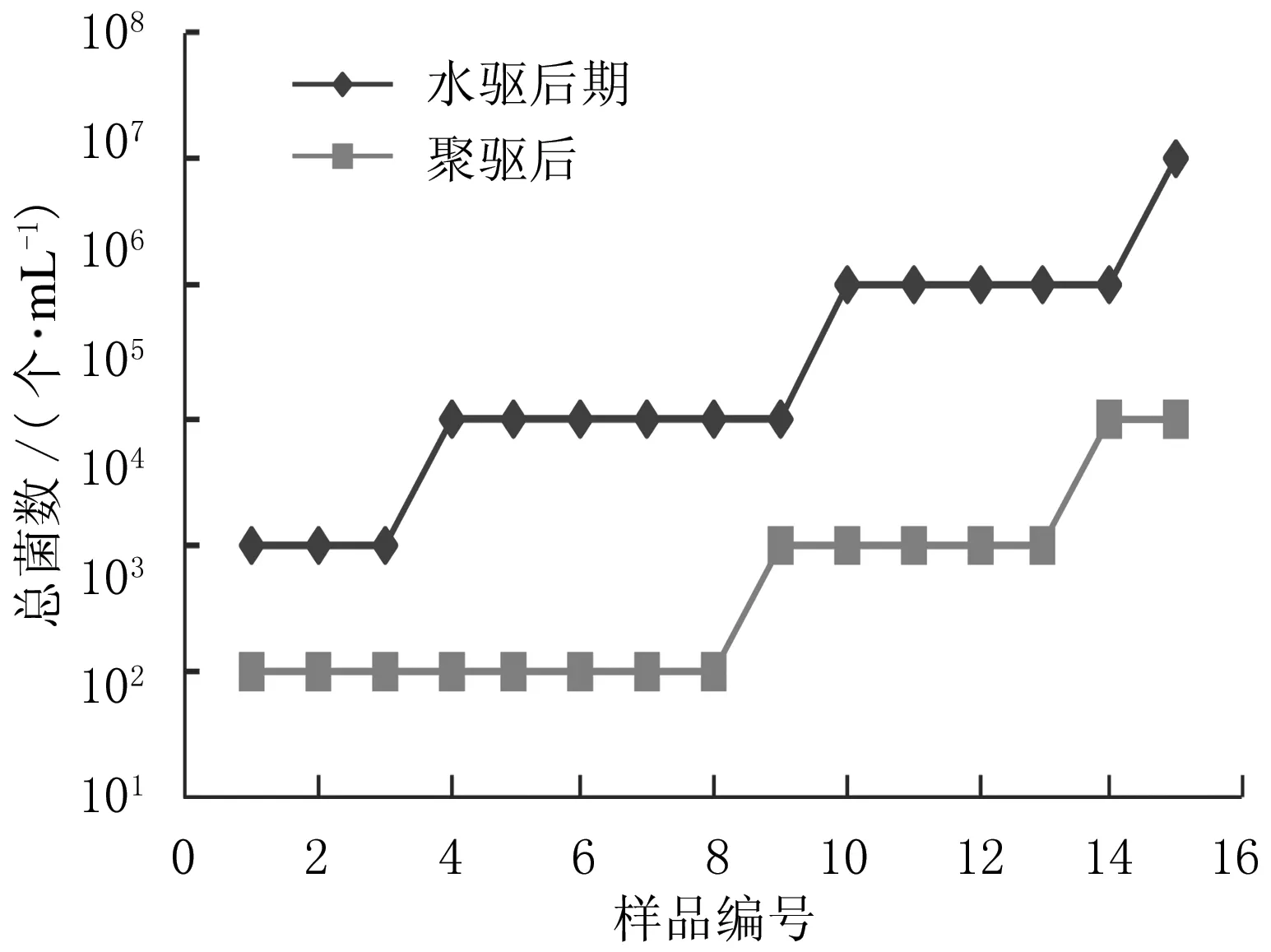
圖1 水驅后與聚驅后細菌總菌數分布
在水驅和聚驅后,利用微生物的功能強化原油開采代表石油開采技術的最新發展方向.為了開發水驅和聚驅后油藏微生物采油技術,分析這2類油藏油層中內源微生物的分布狀態.
分別從水驅后和聚驅后油藏采取15個典型油藏采出液樣品,分析其中總菌數(見圖1).由圖1可知,利用聚丙烯酰胺驅油后,油井采出液中微生物總數較水驅后期油藏采出液中微生物總數低2個數量級.水驅后期油藏更適合于微生物采油技術的應用.聚驅后的油藏中殘留部分聚合物可以作為油藏本源菌的營養源,殘留有機物的合理利用為調控聚驅后油藏微生物、開采剩余油提供途徑.
3.2 驅油模式
研究含水率為95%以上的水驅后與聚驅后細菌分布,分析不同區塊2種樣品的結果.水驅后菌群結構是烴氧化菌—厭氧發酵菌—產乙酸鹽菌—產甲烷菌的結構模式.
由于聚丙稀酰氨可以被發酵菌直接利用,聚驅后油藏的烴氧化菌比水驅后大大減少,原因是細菌利用滯留的高分子聚合物為營養源生長較慢,但油藏依然含有大量的微生物.聚驅后菌群結構是聚合物降解菌—厭氧發酵菌—產乙酸鹽菌—產甲烷菌的結構模式.聚驅后的烴氧化菌比水驅后減少2~3個數量級,已經形成穩定微生物體系,有利于激活內源微生物技術,為聚驅后油藏的剩余油提供采油途徑.
4 分子生態學分析
研究聚驅后油藏中的細菌和古菌,利用PCR-DGGE指紋圖譜,分析16S rDNA克隆文庫的序列的生物進化樹(確立微生物種類),以及油藏微生物群落的16S rDNA多態性,得到內源微生物群落的16S rRNA基因分布圖譜.從分子水平上分析油藏不同區塊中內源細菌和古菌的分布情況、群落結構、生物多樣性,以及微生物群落中各種細菌和古菌的組成及其種群大小,研究大慶油田第一采油廠中新201站的14口井微生物群落結構.
4.1 細菌
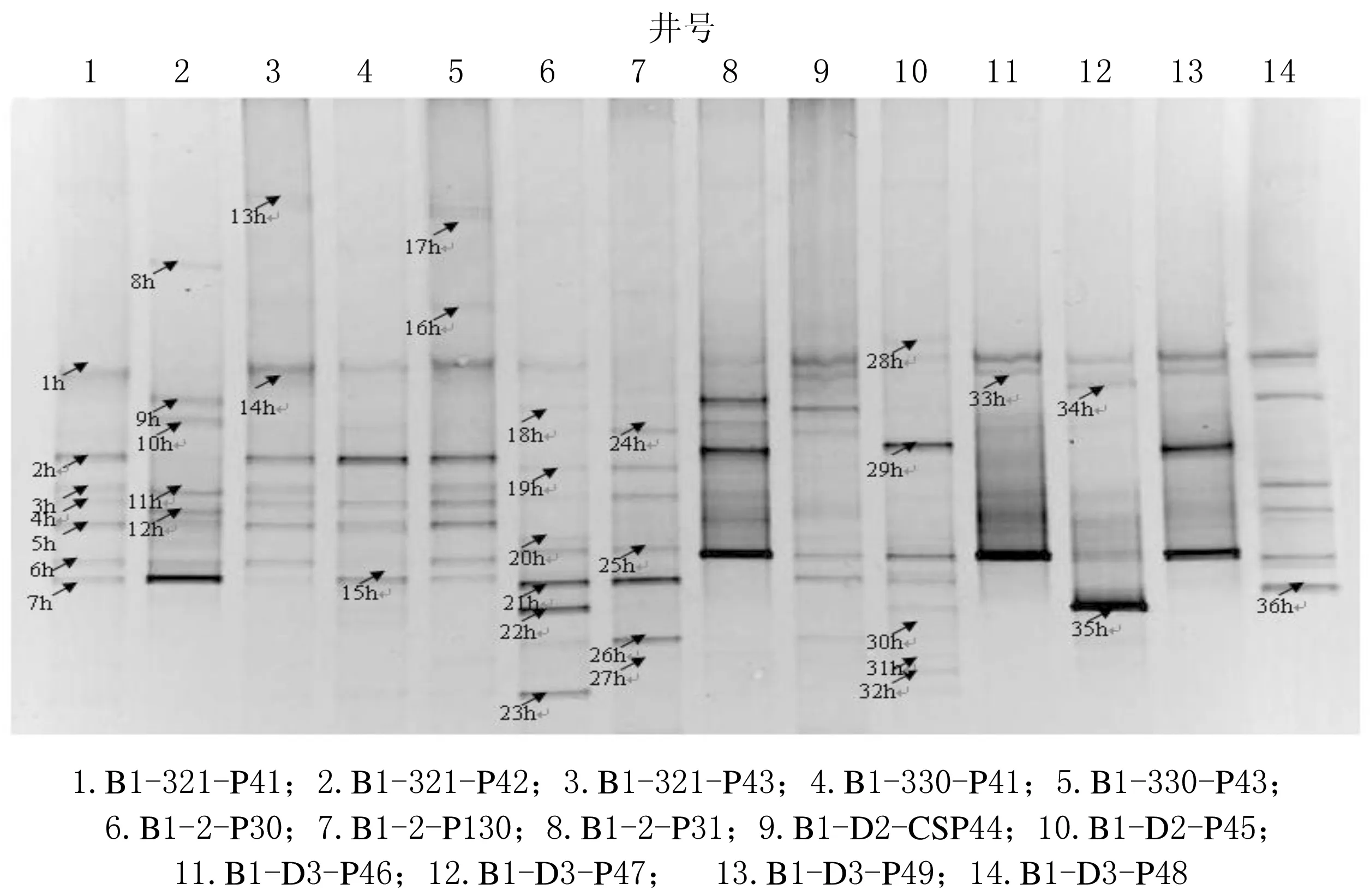
圖2 聚驅后油藏菌16S rRNA基因V9高可變區DGGE圖譜
聚驅后油藏菌16Sr RNA基因V9高可變區DGGE圖譜見圖2.
圖2表明,油井之間細菌群落的差異較大,優勢菌群也不盡相同.主要的優勢菌是Thauera、Petrobacter、Escherichia、Pseudomonas以及未培養細菌.Thauera是兼性厭氧的革蘭氏陰性桿菌,具反硝化能力,在以乙酸鹽、丙酸鹽和乙醇等進行硝化作用時,可降解多環芳烴類物質,在廢水處理中應用較多;Petrobacter菌有很好的烴降解功能;Pseudomonas的一些菌種具有烴降解功能,有些產生表活劑和一些小分子物質;Enterobacteriaceae的一些菌株產生生物表活劑,在采油中也有很好應用.這幾種菌特別是Petrobacter和Pseudomonas細菌對于采油具有非常重要的意義.其他井中的優勢菌群主要是Acinetobacter、Pseudomonas和Chloroflexi,其中Acinetobacter是油藏中常見的細菌,最適生長溫度為33~45 ℃.一些菌株具有可產表面活性劑、乳化原油或者降解長鏈烷烴的功能.
在采油井和注水井中檢測出多種未培養細菌,它們在油藏的微生物群落結構中起重要作用,因而還需要通過的篩選純培養及激活實驗得到更多的信息.
4.2 古菌
聚驅后油藏古菌16S rRNA基因V3高可變區DGGE圖譜見圖3,聚驅后油藏各井主要內源細菌的多樣性分析見圖4.
由圖3-4可知,檢測出的主要是Methanosaeta、Methanobacterium、Methanospirillum、Methanomicrobiaceae、Crenarchaeota以及一些未培養的古菌.其中注水井中的優勢菌群Methanosaeta及未培養古菌在采油井樣品中未檢測出,而其余少量的Methanobacterium、Methanomicrobium、Methanospirillum及未培養古菌在注入井和采油井中有分布,且在采油井中數量顯著增加,同時采出水中未培養古菌的種類也有所增加.這證實封閉的厭氧環境更適于產甲烷古菌的生長.
注水井中的優勢菌Methanosaeta的最適生長溫度為55~60 ℃,且只能以乙酸鹽為底物發酵產甲烷,該地層的溫度在42°左右.由于油田長期回注水,且與外界開放環境相通,導致注水井地層條件發生改變,形成適宜該屬古菌生長的環境,使該屬成為注水井的優勢菌群,并隨著向采油井的趨近,溫度等條件與原始條件愈加接近,該菌的生長條件不能得到滿足,所以在采出液中并未檢測到.
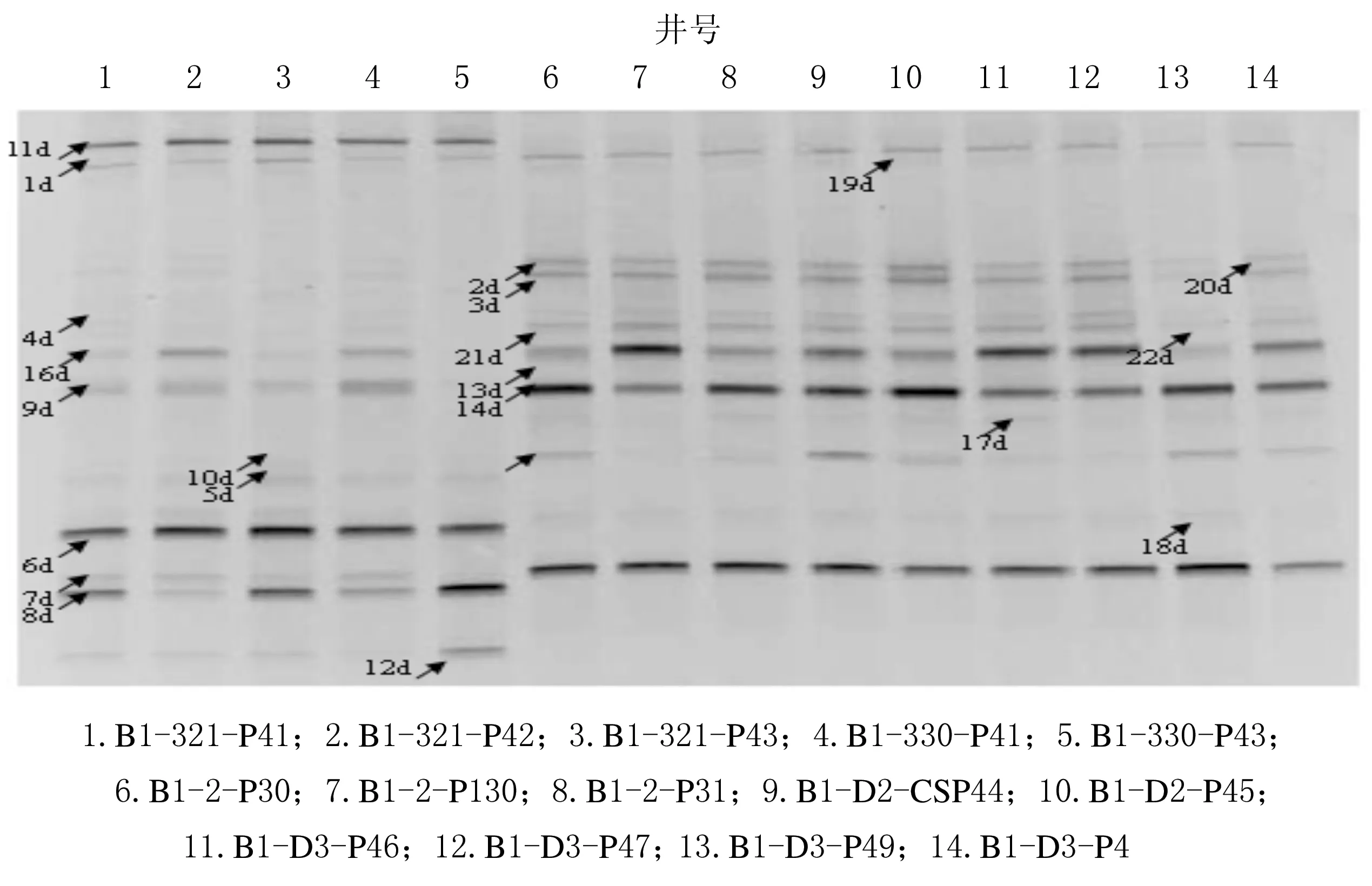
圖3 聚驅后油藏古菌16S rRNA基因V3高可變區DGGE圖譜
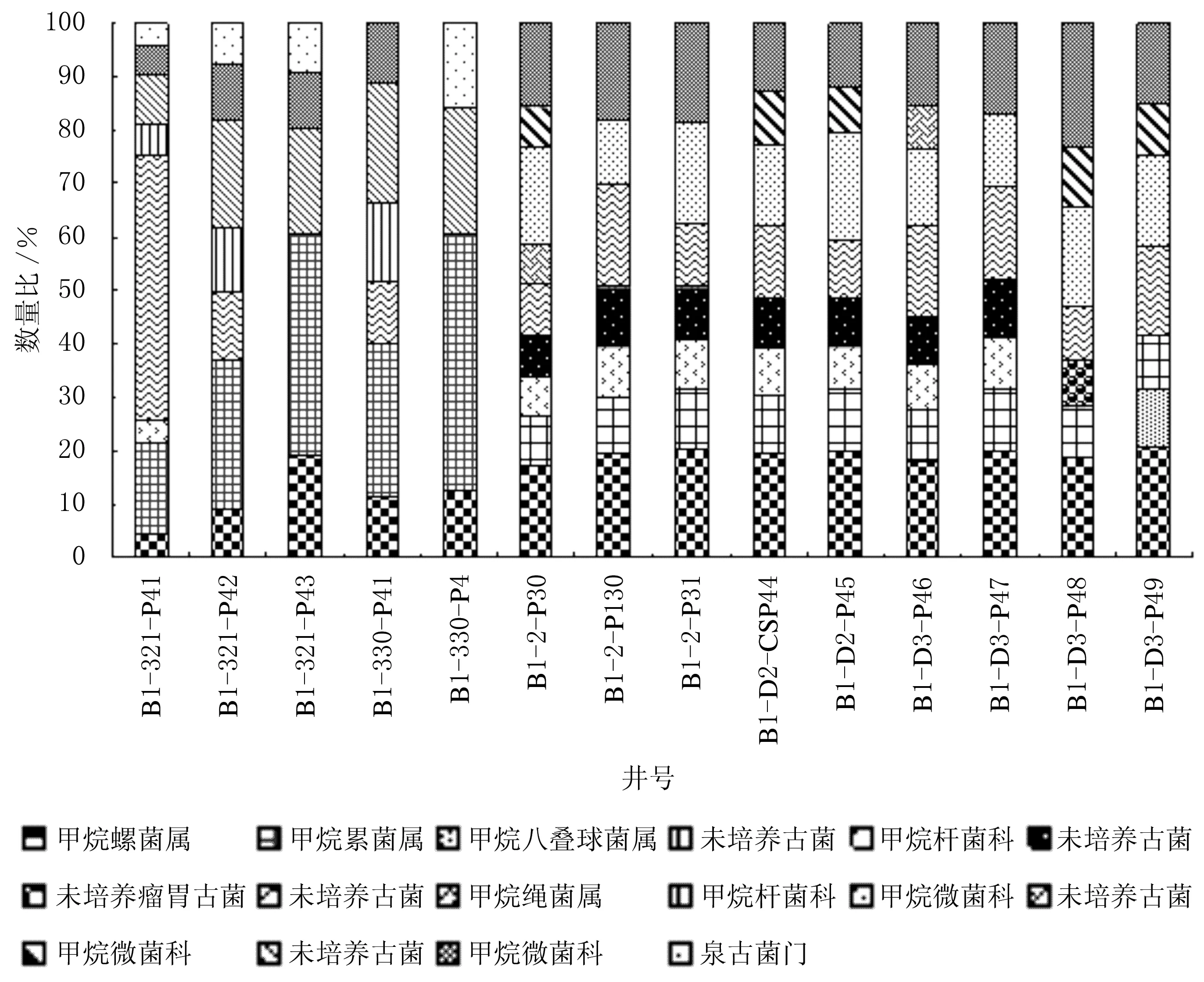
圖4 聚驅后油藏各井主要內源細菌多樣性
其余種屬的古菌最適生長溫度為33~50 ℃,故在注水井和采油井中有分布.采油井的優勢菌群Methanomicrobium、Methanospirillum和Methanobacterium以氨作為唯一氮源,以硫化物作為硫源,以H2/CO2或者甲酸鹽作為底物生成甲烷,是油田常見的古菌,在其他油田油井樣品中被檢測出.產甲烷菌的作用發生在生物降解的末端,它們在深層油藏原油的厭氧烴降解過程中發揮作用.同時,由圖3-4還可知,在檢測出的古菌中,未培養的古菌占比例很大,尤其是其中的一些還是優勢菌屬,由于古菌生長條件的特殊性,導致絕大多數的菌未能被培養,所以對于這些菌的利用也非常有限,如果能在實驗室條件下,尋找合適的培養條件對古菌進行純培養,這對于微生物采油具有重要意義.
5 結論
(1)大慶油藏水驅和聚驅后期油層中含有種類多、數量高的微生物群落,包括烴氧化菌、甲烷菌、發酵菌等,其地層中微生物群落的多樣性為大面積采用內源微生物采油技術提供條件.
(2)細菌的DGGE分析結果表明,聚驅后區塊14口井中,在注水井周圍細菌群落結構比較穩定,而各采油井中的細菌種類和數量有很大差異.在采油井中檢測到的細菌主要是變形菌綱的陶厄氏菌屬、油桿菌屬、假單胞菌屬、不動桿菌屬和腸桿菌科微生物.聚驅井組水樣中DGGE檢測出的優勢古菌菌群主要是產甲烷菌(甲烷微菌科、甲烷螺菌屬和甲烷桿菌屬),在深層油藏的厭氧烴降解過程中發揮作用.
(3)聚驅后油藏中存在眾多微生物,區塊的本源菌數量為103~104個/ mL.微生物種類和數量與鄰近的水驅油藏差別不大,聚驅后油藏具有開展內源微生物驅資源基礎.

