冠狀散囊菌基因組DNA提取方法比較研究
劉石泉 趙運林 胡治遠 雷存喜
(1.湖南農業大學生物科學與技術學院,湖南長沙 410128;2.湖南城市學院化學與環境工程系,湖南 益陽 413000;3.黑茶研究所,湖南益陽 413000)
茯磚茶屬于后發酵茶,是所有茶類中加工工藝最復雜、生產加工周期最長、工藝最獨特的黑茶類產品。在茯磚茶制造中,選用黑毛茶為原料,通過篩分、汽蒸、握堆、稱茶、蒸茶、壓制、包裝、發花、干燥、檢驗等工序制成[1]。其中發花是茯磚茶品質形成的關鍵工序。黑毛茶經渥堆、發酵及發花工藝產生金黃色的冠突散囊菌(Aspergillus Cristatus(Raper&Fennell)Malloch&Cain,該菌俗稱金花)使茯磚茶內質金花普茂,獨具菌花香,湯色紅濃、香氣純正、滋味醇和。一直以來,茯磚茶是作為邊疆少數名族日常生活中不可或缺的必備品,在邊疆享有“寧可三日無糧,不可一日無茶”的美譽,其奧妙與茯磚茶的品質風味是不可分割的[2]。歷來邊疆少數民族通過判斷金花質量和數量來衡量茯磚茶的品質優劣[3],開發優質品牌茯磚茶,發展壯大茯磚茶產業、夯實品牌基礎,顯然離不開冠狀散囊菌的分子生物學如DNA、蛋白質等研究。本研究旨在對茯磚茶中的優勢菌種——冠狀散囊菌進行DNA提取方法的比較研究,為后續冠狀散囊菌的DNA分子標記技術,進行群體遺傳研究打下基礎。
隨著分子生物學的發展,基因工程技術的廣泛應用,通過提取DNA來用基因工程技術改善微生物的目的產量已成為許多科學工作者正在探索的熱門課題,文獻檢索表明目前已有多種DNA的提取方法,但專門針對冠狀散囊菌DNA的提取方法未檢索到,我們認為很有必要參考真菌的 DNA提取方法[5-7],對冠狀散囊菌DNA的提取進行系統的比較研究。因為冠狀散囊菌是真核細胞,擁有結構復雜的細胞壁,難以破壞,所以提取冠狀散囊菌基因組DNA比提取大腸桿菌等細菌DNA要困難得多。本試驗擬通過使用溶菌酶破壁法、纖維素酶破壁法、果膠酶破壁法、CTAB法、SDS法提取冠狀散囊菌菌絲體和子囊孢子的基因組DNA,然后進行電泳檢測、ITS序列的PCR擴增檢測以及紫外分光光度計測定DNA濃度和純度。期望在前人研究方法的基礎上,摸索一套簡便、易行的適于提取冠狀散囊菌總DNA的方法,獲得的總DNA含蛋白質少、降解不明顯、產量較高、重復性好。
1 材料與方法
1.1 材料
1.1.1 菌株 從2007年益陽茶廠有限公司產金湘益特制禮品茯磚茶,采用PDA培養基培養,運用平板梯度稀釋法分離獲得的茯磚茶中的優勢菌種——冠狀散囊菌。
1.1.2 儀器 高速臺式冷凍離心機(Z36HK)、Bio-Rad DNA電泳儀、紫外可見分光光度計(TU-1810DASPC)、DNA擴增儀(TC-25/H)、凝膠成像分析系統(Gellabsystem)等。
1.1.3 主要試劑 溶菌酶、纖維素酶、果膠酶、RNaseA等購置于上海生物工程有限公司;使用的真菌通用引物[8]ITS1(5'– TCC GTA GGT GAA CCT GCG G-3') 和 ITS4(5'– TCC TCC GCT TAT TGA TAT GC-3')由上海生物工程有限公司合成;其他為國產分析純試劑。
1.1.4 溶液配制 DNA緩沖液:100 mmol/L Tris-HCl(pH 8.0)、10 mmol/L EDTA。
SDS 裂解液:2%Triton X-100、3%SDS(m/m)、0.5 mol/L NaCl、100 mmol/L Tris-HCl(pH 8.0)、50 mmol/L EDTA、2% β-巰基乙醇(v/v)用前加)。
CTAB 裂解液:100 mmol/L Tris-HCL(pH 8.0)、20 mmol/L EDTA(pH 8.0)、1.4 mol/L NaCl。
0.1mol/L 磷酸鈉緩沖液(pH 7.4):77.4 mL 0.1 mol/L Na2HPO4、22.6 mL 0.1 mol/L NaH2PO4。
山梨醇緩沖液:用0.1 mol/L磷酸鈉緩沖液(pH 7.4)配制1.2 mol/L 山梨醇。
溶菌酶、纖維素酶、果膠酶緩沖液:用0.1 mol/L磷酸鈉緩沖液分別配制成20 mg/mL酶液后用0.22 μm細菌濾膜過濾除菌。
PBS 緩沖液:0.01 mol/L Na2HPO4和 NaH2PO4(pH 7.0)、0.15 mol/L NaCl。
PDA液體培養基:將馬鈴薯洗凈去皮,稱取200 g,切成小塊放入燒杯中,加適量蒸餾水,煮沸1小時,稍冷后用雙層紗布過濾,加入蔗糖20 g,混勻,用量筒定容至1000 mL,趁熱分裝在三角瓶中,在1.1 kg/cm2(121℃)中保持20分鐘滅菌(固體培養基在滅菌前加1%的瓊脂)。
1.2 冠狀散囊菌基因組DNA提取方法
1.2.1 溶菌酶破壁法 冠狀散囊菌接種于50 mL PDA液體培養基中,28℃、280 rpm震蕩培養培養96h,用無菌紗布過濾分開子囊孢子和菌絲體,室溫下10 000 rpm離心5 min收集子囊孢子,自然干燥后分別準確稱取0.1 g子囊孢子和菌絲體,分別用PBS緩沖液1.5 mL重懸子囊孢子和菌絲體,室溫下10 000 rpm離心5 min收集子囊孢子和菌絲體;用山梨醇溶液100μL重懸,加入5μL 20 mg/mL溶菌酶37℃溫浴過夜(12h);液氮速凍,然后65℃水浴中溶解,反復3次;向懸浮液中加入150μL 5 mol/L KAc(pH8.9)輕輕混勻,然后12 000 rpm離心10 min;將上清轉移到新的1.5 mL離心管中,加入等體積的酚:氯仿:異戊醇(25:24:1),輕輕顛倒數次,然后12 000 r/min離心10 min;重復抽提一次;轉移上清到新的1.5 mL離心管中,加入2倍體積的無水乙醇和1/10體積的3M醋酸鈉溶液,輕輕混勻,-20℃ 放置30 min后12 000 rpm離心10min;除去上清,將沉淀溶解在100μL DNA緩沖液中,加入6 μL RNaseA(10 mg/mL),37℃溫浴30 min,加入1/2 體積的7.5 mol/L NH4Ac(pH7.5)和等體積的異丙醇,-20℃放置30 min后12 000 r/min離心10 min;除去上清,加入500μL 70%乙醇漂洗沉淀2次,12 000 r/min離心5 min;風干除去乙醇,用50 μL ddH2O溶解冠狀散囊菌DNA,-20℃保存備用。
1.2.2 纖維素酶破壁法 操作同1.2.1,其中20 mg/mL溶菌酶換成含20 mg/mL纖維素酶溶液。
1.2.3 果膠酶破壁法 操作同1.2.1,其中20 mg/mL溶菌酶換成含20 mg/mL果膠酶溶液。
1.2.4 CTAB法 冠狀散囊菌的重懸子囊孢子和菌絲體液制備方法同1.2.1,分別取1.5 mL子囊孢子和菌絲體重懸液,室溫下10 000 r/min離心5 min收集孢子和菌絲體;分別用液氮碾磨破壁。加250 μL CTAB 裂解液混勻,65℃保溫1 h。10 000 r/min離心10 min。取上清,將上清轉移到新的1.5 mL離心管中,加入等體積的酚∶氯仿∶異戊醇(25∶24∶1),輕輕顛倒數次,然后12 000 r/min離心10 min;重復抽提一次;然后轉移上清到新的1.5 mL離心管中,加入2倍體積的無水乙醇和1/10體積的3M醋酸鈉溶液,輕輕混勻,-20℃放置30 min后12 000 rpm離心10 min;除去上清,將沉淀溶解在100μL DNA 緩沖液中,加入 6 μL RNaseA(10 mg/mL),37℃溫浴30 min,加入1/2 體積的 7.5 mol/L NH4Ac(pH 7.5)和等體積的異丙醇,-20℃放置30 min后12 000 r/min離心10min;除去上清,加入500 μL 70%乙醇漂洗沉淀2次,12 000 r/min離心5 min;風干除去乙醇,用50μLddH2O溶解冠狀散囊菌DNA,-20℃保存備用。
1.2.5 SDS法 將250 μL CTAB裂解液換成加250 μL SDS 裂解液,其他操作同1.2.4。
1.3 冠狀散囊菌基因組DNA質量檢測
1.3.1 凝膠電泳檢測 基因組DNA用1%瓊脂糖凝膠電泳,EB染色,點樣2 μL,80 V恒定電壓40 min,然后用凝膠成像分析系統(Gellabsystem)拍照。
1.3.2 純度及濃度檢測 樣品稀釋100倍,終體積500 μL,做3個平行對照,混勻后用紫外可見分光光度計(TU-1810DASPC)測定,分析各種方法所提冠狀散囊菌基因組DNA純度及濃度。A260值代表其濃度,一般OD260/OD280<1.7,表明樣品中蛋白質含量過多;OD260/OD280>2.0,表明 RNA含量過多;OD260/OD280為1.8表示純度好。
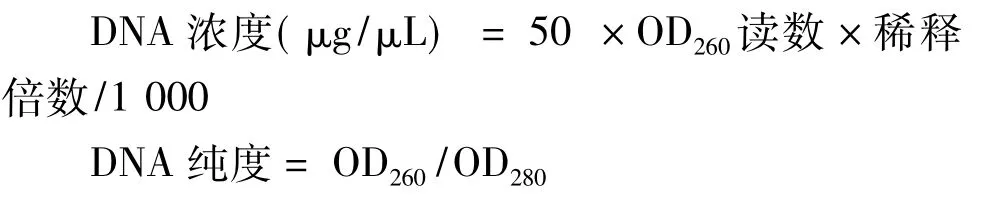
1.3.3 ITS的PCR檢測 使用50 μL反應體系為:10 × buffer(5 μL)、25 mM DNTP(1 μL)10 μM ITS1(3 μL) 、10 μM ITS4(3 μL)、DNA 模板(2 μL)、5 U/μL TaqE(0.2 μL)、DDH2O(35.8 μL);使用的PCR 程序為:94℃預變10 min,94℃ 45 s、55℃ 60 s、72℃ 2 min,35個循環,最后72℃延伸10 min。用1.5%瓊脂糖凝膠電泳,EB 染色,點樣2 μL,80 V 恒定電壓 40 min,然后用凝膠成像分析系統(Gellabsystem)拍照。
2 結果與討論
2.1 瓊脂糖凝膠電泳檢測冠狀散囊菌基因組DNA
從電泳結果(圖1)可以看出,各種方法所提冠狀散囊菌基因組DNA分子大小基本一致,說明五種方法均能提取該菌株基因組DNA;十條條帶的亮度都是冠狀散囊菌菌絲體作提取材料的要亮,說明用冠狀散囊菌菌絲體作為材料提取的DNA的收獲量明顯優于用子囊孢子;用溶菌酶、纖維素酶、果膠酶提取DNA從瓊脂糖凝膠電泳檢測條帶上很難發現有明顯差異說明其破壁能力相差不大;用CTAB法提取該菌株基因組DNA瓊脂糖凝膠電泳條帶亮度最弱,說明該法說明DNA的收獲率較低,而用SDS法提取該電泳條帶亮度最亮,說明該法說明DNA的收獲率最高,是較為理想的DNA提取方法。
2.2 冠狀散囊菌基因組DNA的濃度、純度比較
用分光光度計測定出了各種方法提取的冠狀散囊菌基因組DNA的濃度,通過紫外可見分光光度計(TU-1810DASPC)測定各個DNA的純度和濃度如表1所示,其中溶菌酶破壁法、纖維素酶破壁法、果膠酶破壁法三種酶破壁法,均以菌絲體基因組DNA的得率較高,其中最高的是溶菌酶,達到了1.57 mg/mL。CTAB法和SDS法同樣以菌絲體基因組DNA的得率較高,SDS法在所有方法中基因組DNA的得率最高,其中以菌絲體為材料的DNA得率達到了最高1.69 mg/mL。5種方法所提取的DNA都在OD260處有顯著吸收峰。用子囊孢子為材料提取的基因組 DNA,其 OD260/OD280比值都接近1.8,說明它們的純度都較高,去蛋白和去RNA的效果都較好;用菌絲體為材料提取的基因組DNA,其OD260/OD280比值都小于1.8,且比用子囊孢子的對應方法都要小,說明有菌絲體作為提取基因組DNA的材料,含有一定殘留的蛋白質的量較用子囊孢子的要高。其OD260/OD280比值除纖維素酶法外沒有明顯大于1.8的,說明去RNA的效果都較好。為了不影響后續試驗,本研究沒有使用TE緩沖液溶解DNA,而使用了ddH2O。若用TE緩沖液溶解DNA,由于pH值和離子存在會稍微影響光吸收值,其OD260/OD280比值會稍高,更接近標準值 1.8[9]。
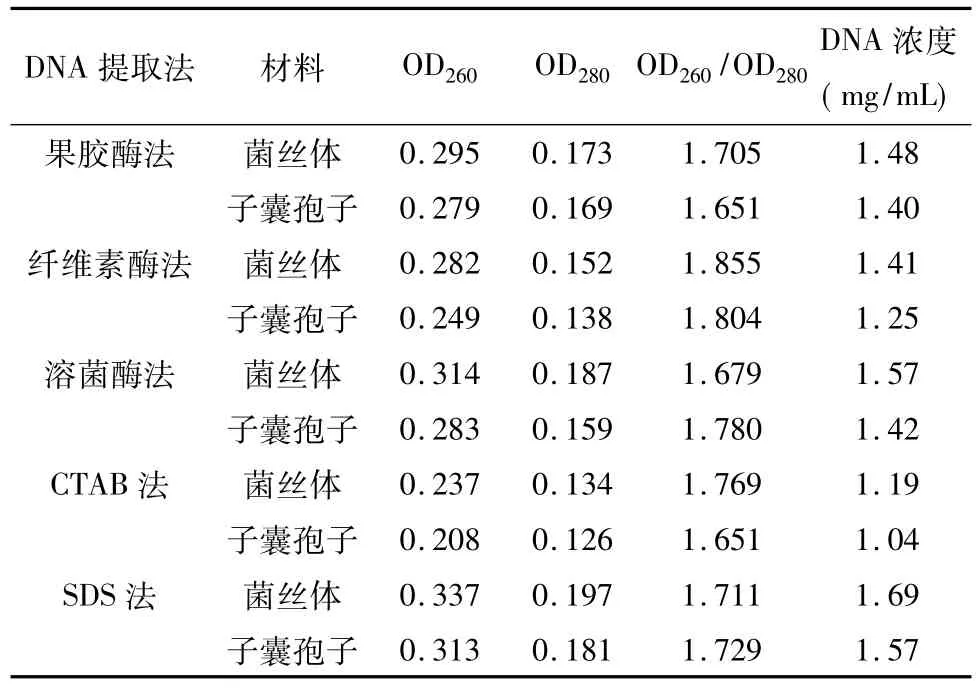
表1 DNA五種不同提取方法純度和濃度檢測結果Table 1 The concentration and purity of Eurotium cristatum DNAs extracted by five methods
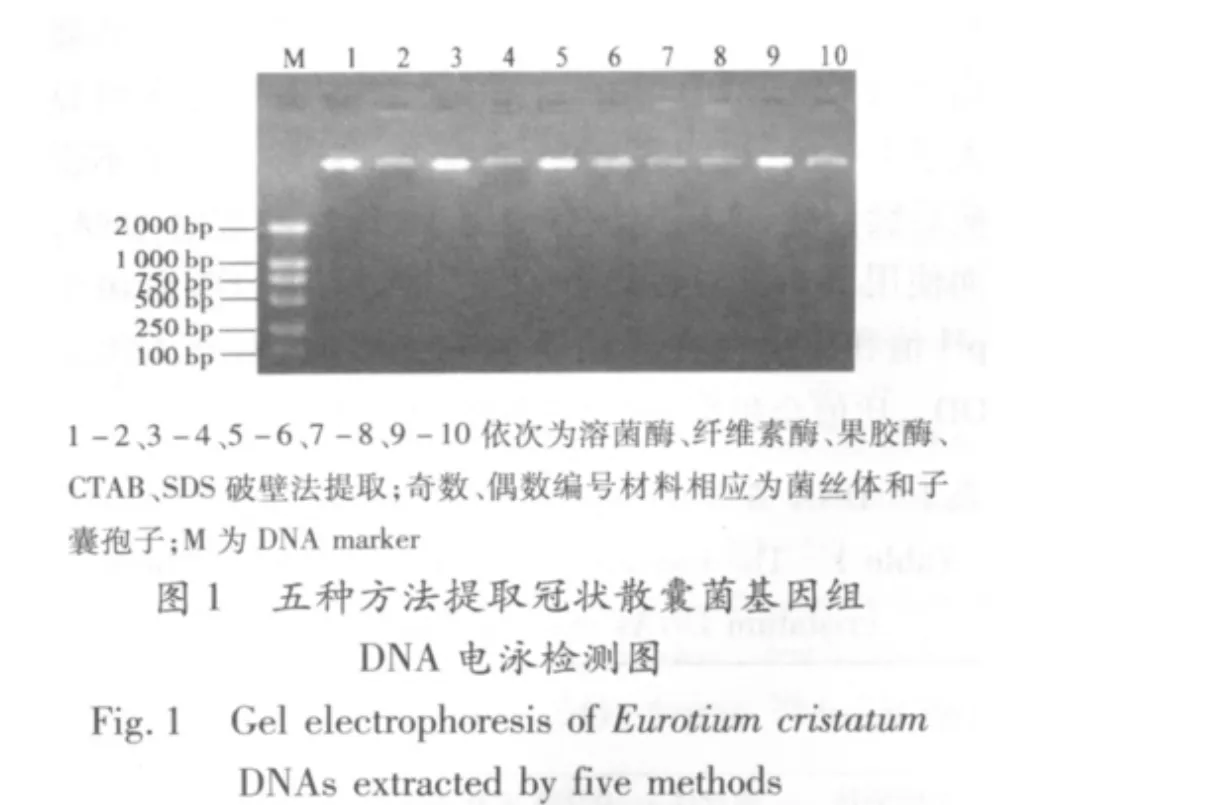
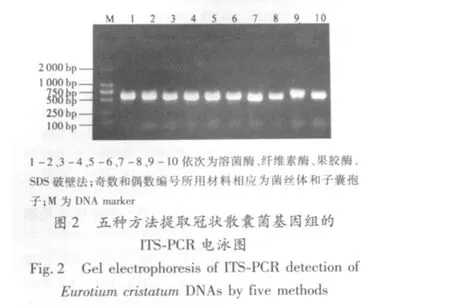
2.3 冠狀散囊菌基因組DNA的ITS序列PCR檢測結果
使用真菌通用引物ITS 1(5'-TCC GTA GGT GAA CCT GCG G-3')和ITS4(5'-TCC TCC GCT TAT TGA TAT GC-3')進行PCR擴增,從凝膠電泳結果(圖2)可以看出,各種方法所提冠狀散囊菌基因組DNA均能擴增出長度為560bp的目的條帶,說明五種方法均能較為完整的提取冠狀散囊菌基因組DNA。
3 討論
文獻檢索表明,溶菌酶破壁法、纖維素酶破壁法、果膠酶破壁法、CTAB法、SDS法均有提取真菌基因組的較為成功的先例,只是未應用在冠狀散囊菌中進行研究,更未進行系統的比較研究,本實驗不但進行了這5種方法的比較,而且對5種方法分別用冠狀散囊菌菌絲體和子囊孢子作為材料,對比了其提取基因組DNA的效果,實驗結果說明能篩選出較為切實可行的提取方法。
溶菌酶在食品工業、醫學和酶工程中應用十分廣泛[10]。在DNA的提取中主要應用在細菌中進行輔助破壁,如金黃色葡萄球[11]、白色瘤胃球菌[12]等。其中三種酶法提取DNA中,溶菌酶破壁法效果較好,其DNA收獲量較其他酶法也稍高,我們認為這主要與溶菌酶的作用及特點有關,溶菌酶以溶解革蘭氏陰性細菌的細胞壁而具有溶菌作用,原因在于它能水解N-乙酰葡萄糖胺與N-乙酰胞壁酸之間的β-1.4糖苷鍵。溶菌酶發揮溶菌作用的最適酸度在 pH 8.0 左右,溶菌酶在 pH 1.2 ~11.3 的廣泛范圍內劇烈變化時都沒有發現溶菌酶活性任何改變,因此溶菌酶對酸堿度的變化不敏感。在堿性范圍時,穩定性較差。溶菌酶的熱變性是可逆的,其變性溫度一般不高于70℃,溶菌酶是相當穩定的[13]。但冠狀散囊菌是真菌,其細胞壁結構與革蘭氏陰性細菌顯著不同,從試驗結果看,其DNA收獲量遠較SDS法的低,很可能是溶菌酶裂解法不能使真菌細胞壁裂解充分,基因組DNA釋放不充分,同時也導致去除蛋白質及苯酚不徹底。
纖維素酶由多種水解酶組成的一個復雜酶系,自然界中很多真菌都能分泌纖維素酶。習慣上,將纖維素酶分成三類:C1酶、Cx酶和β葡糖苷酶。C1酶是對纖維素最初起作用的酶,破壞纖維素鏈的結晶結構。Cx酶是作用于經C1酶活化的纖維素、分解β-1,4-糖苷鍵的纖維素酶。β葡糖苷酶可以將纖維二糖、纖維三糖及其他低分子纖維糊精分解為葡萄糖[14,15]。其纖維素酶對底物的最適作用溫度為45℃,最適 pH 值為 4.5 - 5.0[16]。纖維素酶在環境、藥品、食品、飼料、釀酒、洗滌劑工業和石油開采等方面都有很好的應用[16],纖維素酶預處理能明顯提高植物的破壁效果[17,18]。
果膠酶是分解果膠的一個多酶復合物,通常包括原果膠酶、果膠甲酯水解酶、果膠酸酶。通過它們的聯合作用使果膠質得以完全分解。天然的果膠質在原果膠酶作用下,轉化成水可溶性的果膠;果膠被果膠甲酯水解酶催化去掉甲酯基團,生成果膠酸;果膠酸經果膠酸水解酶類和果膠酸裂合酶類降解生成半乳糖醛酸。但作用pH 2.5-6.0較為窄,且最適作用pH 3.5,作用溫度為15~55℃左右。最適作用溫度為50℃。目前果膠酶在食品、紡織、醫藥、造紙、環境、生物技術、飼料等領域得到廣泛應用[19]。
我們用上述溶菌酶、纖維素酶、果膠酶三種酶都能有效提取真菌DNA,且其提取效果有一定的差異,但差異不大,我們認為這三種酶各自的優化作用條件應該有差異,但我們統一用一種條件進行裂解,顯然不能說明三種酶的作用全貌,相對來講溶菌酶的稍好,可能是該酶的適應pH值相對較廣,而纖維素酶、果膠酶屬于酸性適應裂解酶。
CTAB法主要用于植物DNA的提取[20]以真菌菌絲體為材料的DNA提取也有一些成功報道[21-24],但提取質量亟待改善,主要原因是真菌多糖、多酚等次生物質的存在使提取的真菌DNA中總殘留多糖雜質,由于其許多理化性質與核酸很相似,因此很難將它們分開。多糖的污染,不僅使DNA定量不準,還直接影響下游反應酶的活性[25]。正因此很多學者在運用該法時往往加以改進,如楊同文等[26]采用CTAB結合DNA凝膠回收試劑盒提取食用菌DNA來除去雜質污染。我們的實驗證明CTAB法提取冠狀散囊菌基因組DNA在五種方法中效果確實是最差的,說明其提取方法還有待優化和改進。
SDS法廣泛用于植物、動物、微生物的DNA提取[27-29],其中特別是對多糖含量豐富的植物效果尤為明顯,如李靜等對石斛基因組DNA研究[30],本研究證實對冠狀散囊菌基因組DNA提取效果是最好的,不但DNA收獲率較高,而且其紫外可見分光光度計(TU-1810DASPC)DNA的純度檢測也證實其純度較其他方法的好。
本實驗中,所用的材料冠狀散囊菌菌絲體和子囊孢子,五種方法在提取DNA時也表現出一定的差異,但都證實用冠狀散囊菌菌絲體作為DNA提取材料優于用子囊孢子。具體體現在DNA的收獲量、純度上(見表1),筆者認為,導致該差異出現的主要原因是冠狀散囊菌菌絲體細胞壁和子囊孢子子囊壁的結構不同導致,冠狀散囊菌菌絲體提取效果普遍優于對應的子囊孢子,說明菌絲體結構上更容易破壁而釋放基因組DNA。另外DNA的存在環境致使細胞多糖、多酚等非DNA組分影響其DNA提取也是不可忽視的一個重要因素,很顯然,相關的研究尚需進一步的深入。
綜合以上實驗結果,結合成本因素我們建議用冠狀散囊菌菌絲體作為材料,采用SDS法進行基因組DNA提取,能穩定獲得含蛋白質少、降解不明顯、產量較高的基因組DNA。
1 金冬雙,龔淑英.黑茶的微生物作用研究進展.茶葉,2007,33(4):203-207.
2 王融初,彭雄根.茯茶生產科技發展與西北民族情緣.茶葉通訊,2007,34(1):44-47.
3 劉作易,秦京.“金花”菌與茯磚茶品質.貴州農院學報,1991,10(1):79-82.
4 Nathalie F,Danielle B,Kenneth L,et al.Soil washing improves the recovery of total community DNA from polluted and high organic content sediments.Journal of Microbiological Methods,2004,56:181-191.
5 Karen L M,Robert H F.Convenient deteration of DNA extraction efficiency using an external DNA recovery standard and quantitativecompetitive PCR.Journal of Microbiological Methods,2004,57:259-268.
6 Linda W C,Robin K,Patricia L,et al.Evaluation of DNA extraction methods for the detection of mycobacterium avium subsp.Paratuberculosis by polymerase chain reaction Diagnostic.Microbiology and Infectious Disease,2004,48(1):39-45.
7 Lee Y K,Kim H W,Liu C L,et al.A simple method for DNA extraction from marine bacteria that produce extracellular materials.Journal of Microbiological Methods,2003,52:245 -250.
8 Chen Y C,Eisner J D,Kattar M M,et al.Polymorphic internal transcribed spacerregion 1 DNA sequencesidentifymedically important yeasts.Journal of Clinical Microbiology,2001,39(11):4042-4051.
9 張文玲.轉基因產品定性PCR檢測的技術要點.種子,2009,28(2):109-110.
10 陳 艷,江明鋒,葉煜輝.溶菌酶的研究進展.生物學雜志,2009,26(2):64-66.
11 談小云,陳小英,陳知本.用溶菌酶-SDS微量法提取金黃色葡萄球菌質粒DNA.中國藥科大學學報,1987,18(1):36-39.
12 程 超,郝永清,張林沖.白色瘤胃球菌DNA提取的優化試驗.飼料工業,2009,30(2):29-30.
13 陳 艷,江明鋒,葉煜輝.溶菌酶的研究進展.生物學雜志,2009,26(2):64-66.
14 謝 敬.纖維素酶的研究進展.化學工業與工程技術,2010,31(5):46-49.
15 劉曉晶,李 田,翟增強.纖維素酶的研究現狀及應用前景.安徽農業科學,2011,39(4):1920-1921,1924.
16 楚 杰,李樹品.纖維素酶高活性菌株的選育及酶最適作用條件的研究.山東科學,1998,11(2):51-54.
17 萬日余,顧岱芳.纖維素酶在草莓汁生產中的應用.冷凍與速凍食品工業,1996(4):20-21.
18 陳 穎,劉根齊,李文彬.3種小球藻DNA提取方法的比較.植物生理學通訊,2010,37(3):242-244.
19 李祖明,張洪勛,白志輝.微生物果膠酶研究進展.生物技術通報,2010,3:42-48.
20 陳昆松,李 方,徐昌杰.改良CTAB法用于多年生植物組織基因組DNA的大量提取.遺傳,2004,26(4):529-531.
21 王 凡,洪 葵.CTAB法提取野野村菌基因組DNA.微生物學通報,2010,37(8):1211-1215.
22 吳志紅,汪天虹,黃 衛.簡便易行的絲狀真菌染色體DNA提取法.菌物系統,2001,20(4):575-577.
23 王藝紅,林俊芳,張煒陽.食用菌DNA提取方法研究.食用菌,2008,3:18-20.
24 易潤華,朱西儒,周而勛.簡化CTAB法快速微量提取絲狀真菌DNA.湛江海洋大學學報,2003,23(6):72-73.
25 Fang G,Hammar S,Grumetr R.A quick and inexpensive method for removing polysaccharidesfrom plantgenomic DNA.Bio Techniques,1992,13:52 - 56.
26 楊同文,馬利華.CTAB結合DNA凝膠回收試劑盒提取食用菌DNA.生物技術,2009,19(1):32-34.
27 吳 琦,王紅寧,劉世貴.三種黑曲霉細胞基因組DNA提取方法的比較.生物技術,2003,13(6):30-31.
28 劉少華,陸金萍,朱瑞良.一種快速簡便的植物病原真菌基因組DNA提取方法.植物病理學報,2005,35(4):362-365.
29 孫繼民,王衛衛,侯小娟.用CTAB和SDS法簡單快速提取拉曼被孢霉DNA的通用方法.湖南農業科學,2007,6:61-63.
30 李 靜,尹俊梅,任 羽.SDS法提取石斛基因組DNA的研究.熱帶農業科學,2009,29(12):22-26.

