妊娠絨毛膜癌肺轉移的診治進展
馬冬捷 綜述 張志庸 李單青 審校
妊娠絨毛膜癌(簡稱絨癌)(gestational choriocarcinoma),是最常見的妊娠滋養細胞腫瘤(gestational trophoblastic neoplasia, GTN),是由細胞滋養細胞惡性轉化形成的高度惡性腫瘤,極易發生血行轉移,常出現肺轉移。多繼發于葡萄胎,也可繼發于流產、異位妊娠及早產或足月產后。臨床表現為陰道不規則出血及轉移灶引起的相關癥狀。自一系列有效化療藥物用于絨癌治療之后,絨癌已成為可治愈的惡性腫瘤之一,但耐藥及復發仍是治療失敗的主要原因,特別是肺轉移灶的處理,如何掌握手術指征和時機成為治療難點[1]。
1 疾病特點
1.1 流行病學及病因 絨癌有明顯的種族、地域差異,我國發生率約1/2,882次妊娠,屬高發區域[2]。歐洲及北美約1/40,000次妊娠,東南亞和日本分別為9.2/40,000次和3.3/40,000次妊娠。病因可能與遺傳因素有關,危險因素包括完全性葡萄胎史、高齡產婦、種族等[3]。絨癌肺轉移發生率達85.1%[1]。
1.2 腫瘤生長方式及生物學特點 絨癌的特點是滋養干細胞失去控制而異常增生,以致失去原有絨毛結構,侵潤破壞血管的能力極強,不斷浸潤溶解子宮內膜基質、侵入子宮肌層,早期即侵透血管而血行轉移。最常見的轉移部位為肺(80%)、陰道(30%)、腦(10%)、肝(10%),淋巴系統轉移較罕見[4,5]。絨癌癌栓脫落后循靜脈回流經右心進入肺動脈,可栓塞肺動脈小分支,絨癌細胞增殖侵透血管壁后,破壞肺組織,與血腫混合而成肺轉移灶;侵透肺小靜脈后,癌細胞經左心隨體循環動脈轉移到腦、肝等全身各臟器[2,5]。因此肺常是血行轉移的第一站,跳躍肺的遠處轉移極為罕見[6]。若未能有效控制肺轉移,極易發生腦轉移等遠處轉移,成為絨癌最常見的死亡原因。
1.3 病理及免疫組化特點 絨癌肺轉移灶中心常為凝血塊及壞死組織,外周圍繞著兩層惡性滋養細胞:內層為單核的細胞滋養細胞層,可有少量核異型和不典型有絲分裂像,但與預后無關;外層為多核的合體滋養細胞層,特征性缺失絨毛膜絨毛,絨毛膜促性腺激素(human chorionic gonadotropin, hCG)染色陽性[4]。周圍肺組織受壓塌陷、出血、水腫和炎性細胞浸潤。免疫組化有助鑒別診斷,合體滋養細胞β-hCG強陽性,人胎盤生乳素(human placental lactogen, hPL)弱陽性[7]。絨癌hCG、抑制素(inhibin)、人類白細胞抗原-G(human leukocyte antigen-G, HLAG)、黑色素瘤細胞粘附分子(melanoma cell adhesion molecule, Mel-CAM, CD146)常呈陽性[8]。有效化療可使肺轉移灶滋養細胞死亡,殘留凝血塊及壞死組織機化并形成纖維包裹;化療失敗者,出血壞死區內仍散在少數滋養細胞[1]。有時病灶較小又無明顯出血壞死,易被誤認為低分化鱗癌,需結合子宮有原發絨癌病灶、血或尿hCG升高、腫瘤細胞無細胞間橋以及免疫組化hCG陽性鑒別診斷[7]。
1.4 臨床表現 早期絨癌肺轉移通常無明顯臨床表現,轉移灶較多、較大時可有咯血、胸悶憋氣、胸痛甚至血胸等表現,嚴重者可出現呼吸衰竭。目前由于絨癌患者需定期復查胸部CT,常能在早期無癥狀時發現肺轉移灶[2]。
2 診斷
2.1 診斷標準 育齡女性,依據確定的絨癌病史或產后或流產后陰道持續不規則出血,血、尿β-hCG異常升高而疑診絨癌,結合肺部CT演進出現轉移陰影,可臨床診斷絨癌肺轉移,確診需子宮或轉移灶切除后的病理檢查。絨癌細胞可分泌hCG,測定β-hCG是協助診斷、評價療效及隨診的敏感而特異性指標[1,2]。
準確評估患者應包括行盆腔超聲或MRI或動脈造影,了解原發灶范圍及位置,行胸腹CT、頭顱MRI了解全身情況[6,9]。PET-CT能有效檢測出CT及MRI未能發現的隱匿轉移或復發病灶[9]。
>60%的絨癌患者初診時已發生肺轉移。絨癌肺轉移的胸部X線特點為圓形結節狀[1]。CT典型表現為肺外周或胸膜下單發或多發類圓形軟組織密度結節影。轉移灶的影像演進過程中,早期可表現為小片狀影或磨玻璃樣微結節影,逐漸增濃、增密、增大,形成邊緣不光滑的結節或腫塊,少有胸膜牽拉,最終發展為邊緣清晰、密度均一的結節或腫塊,可有空洞,肺門或縱隔淋巴結常無腫大。化療后肺內轉移灶影像表現可呈現動態變化過程。隨著絨癌肺轉移灶的增大,將特征性伴隨血β-hCG上升。對化療和隨診過程中新出現的肺內陰影,要結合血β-hCG水平變化判定是否為疾病進展[2]。穿刺活檢絨癌肺轉移灶出血播散風險高,且陽性率低,既不必要也不推薦[5]。
2.2 鑒別診斷 注意與肺內其它病變相鑒別,如原發肺癌、結核瘤、化療引起的肺組織損害及免疫力下降導致的肺部感染等[10]。
2.3 分期 目前通用國際婦產科聯盟頒布的FIGO2000版GTN分期評分系統(表1、表2),總分≤6分為低危組,>6分為高危組[6]。
3 治療
絨癌的治療原則以化療為主,輔以手術、放療、介入等綜合治療,低危組對甲氨蝶呤(MTX)或放線菌素D(ActD)單藥化療耐藥風險較低,高危組需要多藥聯合化療[6]。絕大多數患者化療后絨癌肺轉移灶即可消失。
3.1 隨診及療效判斷標準 隨診患者應保證避孕條件下每周查血β-hCG,至連續3周陰性后,每月查1次至少12個月[5]。完全緩解(complete response, CR)指化療后連續3次血β-hCG正常,且轉移灶消失。部分緩解(partial response, PR)指化療后β-hCG下降至初治時的50%以下,轉移灶縮小。耐藥指化療2個療程后,β-hCG下降不滿意(未成對數下降),或呈平臺狀,甚至上升,影像提示病灶不縮小或變大,或出現新發轉移灶。復發指完全緩解停止化療3個月以上,再次出現血β-hCG升高(排除妊娠)或影像發現新發病灶[1]。病理陽性指病灶內滋養細胞殘留或免疫組化hCG或β-hCG染色陽性[11]。
3.2 化療 EMA/CO方案[依托泊苷(VP-16)+MTX+ActD/環磷酰胺(CTX)+長春新堿(VCR)]毒性低,緩解迅速,被公認為目前治療高危患者的一線化療方案。對初治化療耐藥的絨癌患者多采取更換方案的挽救性化療,仍無效者需考慮手術切除耐藥病灶[12]。
EMA/EP方案[VP-16+MTX+ActD/VP-16+順鉑(DDP)]是針對5-FU聯合長春新堿和放線菌素或EMA/CO化療耐藥患者的有效補救方案[13,14]。已轉移的高危GTN患者初步EMA/CO治療緩解率達66.7%,經含鉑方案挽救性化療、手術切除殘留病灶及全腦放療等綜合治療,完全緩解率達93.3%[15]。紫杉醇可作為三線方案,60%的高危轉移患者經EMA/CO一線治療治愈,19%經二、三線挽救性化療及有選擇的手術治療治愈,長期緩解率為81.4%,5年生存率為78%[16]。
Feng等[14]對91例耐藥和復發性GTN患者以毒性更低的FAEV方案[氟尿苷(FUdR)+ActD+VP16+VCR]化療,完全緩解率為60.4%,輔以手術治療后,3年生存率為74.9%。適時合理地實施輔助手術,能夠提高復發耐藥患者的緩解率[12,14]。
3.3 手術指征及時機 90%以上的絨癌肺轉移患者,經規范化療即可取得完全緩解效果。僅有少數具有肺部耐藥病灶或復發相關病灶患者需要手術治療,只有手術指征選擇適當才能真正發揮治療作用。
1965年Thomford等[17]提出切除肺轉移灶的手術指征:①患者身體狀況能夠耐受開胸手術;②原發灶已得到控制(已行子宮切除或動脈造影提示盆腔無腫瘤);③全身無其它轉移灶;④影像顯示肺轉移病灶局限于單側肺;⑤血β-hCG水平<1,000 mIU/mL。在此基礎上,隨著化學治療學、病理學以及婦科學的不斷進步和臨床經驗的積累,絨癌肺轉移的手術指征也在不斷修正。
合體滋養細胞易被化療殺滅,絕大多數患者血β-hCG呈對數下降直至恢復正常。但少數化療滿意患者的肺轉移灶經多療程鞏固化療后仍存在,臨床多因此行肺葉切除術,而病理檢查肺內病灶多為出血壞死或纖維化,常無滋養細胞殘留。此類患者的復發率并不比CR患者更高,也應視作CR而非PR[10]。CT所示的殘留病灶雖經化療仍難以完全吸收消失,難以確定的此類肺內病灶即為耐藥轉移灶,隨診患者多病情長期無進展,故可隨診觀察,如血清hCG保持正常,既不應過度化療,更不必急于手術[2,11]。但必須規律隨訪血β-hCG及轉移灶影像變化,尤其停藥6個月內更要警惕復發[10]。
經過化療,絨癌肺轉移灶周圍纖維癱痕形成,化療藥物在病灶部位不能達到有效濃度而耐藥,或化療使瘤細胞突變而出現獲得性耐藥[1]。如經若干療程后肺轉移灶仍未完全消失,且血β-hCG下降不滿意或下降曲線出現“拖尾”現象(從10 mIU/mL到2 mIU/mL下降緩慢),提示耐藥滋養細胞尤其是細胞滋養細胞仍可能存活,并產生低水平β-hCG,此時建議切除肺內耐藥灶、防止復發[18]。FIGO評分高危及達CR后鞏固化療不足2個療程是絨癌復發的明確相關因素。復發患者使用單純化療獲得完全緩解后的再次復發率明顯高于化療結合手術切除耐藥殘留病灶者,完全緩解率也明顯低于化療結合手術者[19]。若有證據提示肺轉移灶與復發或耐藥相關且病灶局限,則挽救性化療輔以手術切除肺轉移灶是提高緩解率、改善預后的有效手段。復發及耐藥患者的完全緩解率分別為88.9%和78.6%,病理陽性率分別為55.5%和35.7%[11]。

表1 FIGO 2000滋養細胞腫瘤分期[6]Tab 1 FIGO 2000 staging and classification of GTN
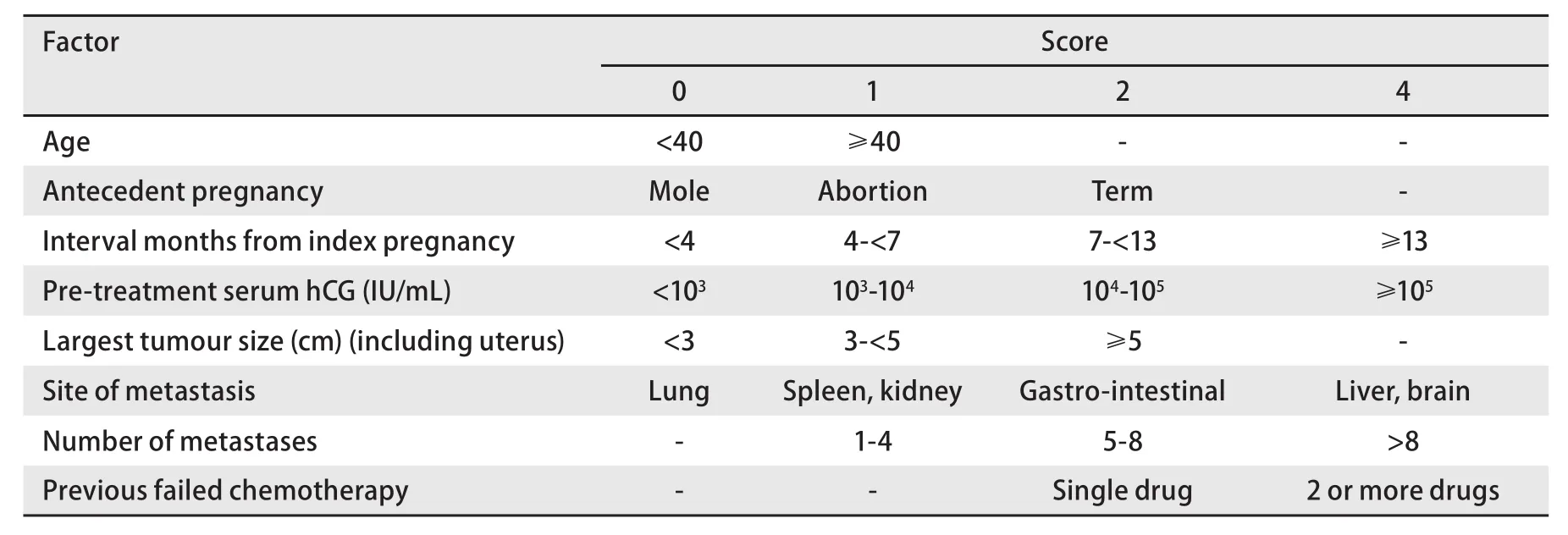
表2 評分系統Tab 2 Scoring system
絨癌耐藥及復發患者對化療常不敏感,手術對去除耐藥病灶、防止復發有不可替代的作用。但圍手術期化療對控制可能的手術刺激瘤細胞血行轉移效果不確定,故手術成功的前提是病灶穩定而局限[11]。術前血β-hCG水平越高,提示滋養細胞增生活躍,手術難以根除病灶,發生遠處轉移的幾率高,預后差。手術時機應選擇在血β-hCG控制正常或接近正常時施行[11,18]。術前血β-hCG<20 mIU/mL的患者均療效良好,β-hCG>63 mIU/mL的患者均死亡。建議控制在術前血β-hCG<10 mIU/mL時施行手術,較為安全[1,2]。手術決策時必須注意全面考慮患者的全身狀況,如除肺以外,其它部位存在無法根除的病灶,即使肺部病灶能夠切除,也不應手術。
綜上,目前的手術指征為:肺轉移灶局限于一葉肺的耐藥病灶,子宮原發腫瘤已有效控制,全身其它部位無轉移灶,經化療血β-hCG控制正常或接近正常水平。
3.4 手術技巧及圍手術期處理 對局限于單一肺葉內的病灶,多行解剖性肺葉切除。由于絨癌細胞極易發生血行擴散轉移,術中必須操作輕柔,避免粗暴擠壓腫瘤,嚴格按照先結扎肺靜脈后結扎肺動脈原則進行,以免腫瘤擴散。出現肺門及縱隔淋巴結轉移者極少見。同側但不同肺葉的轉移灶以切除最大病灶所在一肺葉為主,其余病灶行楔形切除。肺轉移灶切除后,肺內又出現新的耐藥轉移灶時,如仍符合手術指征,可考慮再次手術切除[2]。對肺周邊小的單個轉移灶,肺楔形切除術能夠高選擇性地切除肺轉移灶達到治療目的,并最大限度保留健康肺組織[20]。隨著胸部微創外科技術的進步,已逐漸實踐應用胸腔鏡(video-assisted thoracic surgery, VATS)治療絨癌肺轉移。
與其它腫瘤的手術時機通常宜在化療間歇期進行截然不同,絨癌手術治療必須在圍手術期聯合化療中進行,以減少手術造成的腫瘤播散,減滅隱匿轉移灶。術后待β-hCG正常后,鞏固化療2個療程后可考慮停藥[12]。術后拔除胸腔引流管前,向胸腔內灌注氟尿嘧啶1,000 mg;術前術后行腰椎穿刺,鞘內注射甲氨蝶呤可預防和治療腦轉移[1,2]。
3.5 其它治療與展望 放療對2 cm以內的絨癌肺轉移灶有效,但放療后肺纖維化將使未殺死的瘤細胞更難處理而較少采用。放療多用于局部控制絨癌腦轉移或肝轉移灶,減少顱內出血等并發癥[1,20]。
IL-2基因轉導和TNF-α基因轉導能夠逆轉絨癌細胞的耐藥性[1]。絨癌是高度惡性上皮性腫瘤,高度表達EGFR,分子靶向治療能針對性抑制消除原發及轉移的絨癌細胞,較化療毒性低。包括靶向EGFR激酶抑制劑(西妥昔單抗、厄洛替尼、吉非替尼),靶向Erb2受體的重組抗體曲妥珠單抗以及阻斷c-myc癌基因表達類藥物。組織基質金屬蛋白酶抑制劑(tissue inhibitor of matrix metalloproteinases, TIMP)馬立馬司他(marimastat)可抑制腫瘤生長及轉移,阻止新生血管形成。尚有以抗hCG抗體進行免疫治療及誘導細胞凋亡的基因治療。以上多種新療法可能在治療化療耐藥絨癌方面出現突破性進展[21]。
4 預后影響因素
絨癌肺轉移患者預后影響因素中,末次妊娠性質、分期評分及肺轉移灶部位均非影響預后的獨立高危因素[18]。年齡>35歲及術前β-hCG>10 mIU/mL是手術療效不佳的獨立預測因素[12]。術前已更換4種以上化療方案或>13個療程的患者,手術療效差[11]。術后1周-2周內血β-hCG迅速下降至正常者,手術療效好[22]。
5 結語
在規范化療的基礎上,遵循個體化的原則,正確把握手術指征、時機、方法、切除耐藥性及與復發相關的絨癌肺轉移灶,是提高絨癌肺轉移患者完全緩解率、降低復發率的重要手段,可明顯改善絨癌肺轉移患者預后。分子靶向、免疫、基因治療等將成為新的治療選擇,微創胸外科治療絨癌肺轉移正在實踐之中。

